纤维肉瘤型隆突性皮肤纤维肉瘤的临床特征分析
2015-05-25贾振杰施成章
贾振杰 施成章
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protu⁃berans,DFSP)在1925年由Hoffman首次命名,系源于成纤维细胞或组织细胞,起源于真皮缓慢生长的肿瘤[1]。近来研究表明,瘤细胞表达Vimentin及CD34,电镜观察瘤细胞既有成纤维细胞的特征,又有一些神经鞘膜细胞的特点,个别病例中发现含有黑素小体的树突细胞,提示肿瘤尚有可能起源于神经鞘膜细胞[2]。其临床特点为隆起的坚实性斑块或结节,皮面微凹,呈色褐或暗红色,周围皮肤为淡蓝或红色。从组织病理学上一般将DFSP分为:普通型、黏液型、纤维肉瘤型和其他型(含黑色素细胞、巨细胞成纤维瘤样型、萎缩型和混合型等)[3]。
FS-DFSP由Penner于1951年首次报道,以组织学上出现一定数量的纤维肉瘤样(fibrosarcomatous,FS)区域为特征,约占DFSP全部的5%~16%。主要特征包括细胞成分增多、细胞异型性明显、核分裂像增多(>5/10HPF)及CD34(-)[4]。Hisaoka等[5]于1998年报道纤维肉瘤分化区域的出现导致了DFSP的组织学级别增高,不仅提示转移率和局部复发率的提高,同时总体生存时间(OS)和无疾病进展生存时间(PFS)缩短,认为该生物学特性与纤维肉瘤分化区域内肿瘤细胞增殖活性较高及P53途径的功能异常相关。有临床研究显示,与DFSP相比,FS-DFSP的局部复发率及远端转移率显著增加,患者预后不佳[6-8]。WHO(2013年)软组织肿瘤分类虽然将FS-DFSP作为DFSP的一个亚型进行描述,但将FS-DFSP的生物学行为明确定义为恶性,区别于DFSP的交界恶性/潜在低度恶性[7]。目前,对FS-DFSP的治疗仍以手术为主,强调切缘范围更大(2~4 cm),对无法手术或转移的患者予以放化疗及分子靶向治疗等综合治疗[9]。
FS-DFSP临床相对罕见,既往文献对FS-DFSP的报道也相对少见。本研究回顾性分析了经病理学确诊的18例FS-DFSP,对其临床特点、治疗及预后进行分析,为增强临床上对该疾病的认识提供参考。
1 材料与方法
1.1 临床资料
收集并回顾性分析天津市黄河医院外科自2004年6月至2014年6月共收治经病理学检查证实18例FS-DFSP(图1)。结合本病例特点并复习文献确立分析的指标为:年龄、性别、部位、既往非计划手术次数、肿瘤大小、深浅、末次手术切缘、化疗、复发、转移等因素[11]。
18例患者中男性12例,女性6例;年龄31~71岁,平均年龄47.2岁。原发部位:四肢6例(大腿4例,小腿2例)躯干12例(胸壁10例,背部1例,臀区1例)。肿瘤最长径4~23 cm,平均13.5 cm,其中≥5 cm 13例,<5 cm 5例。全部患者除1例初诊外,均为外院术后复发并初次至本院就诊。14例术前外院病理切片会诊,4例手术活检明确诊断。非计划手术次数0~7次,平均2.38次。末次手术至复发时间为3~16个月,平均为9.5个月。全部患者术前均经胸部CT,上腹及区域淋巴结B超等检查,明确是否出现远端脏器及区域淋巴结转移,18例患者未见转移。肿瘤区域CT、MRI等检查,以肿瘤是否累及筋膜为界确定其深浅,均各为9例。
1.2 治疗方法
18例患者的原发肿瘤均可全部切除并可耐受手术,予以一期手术广泛切除治疗。手术切缘均距肿瘤边缘≥3 cm,肿瘤基底累及或侵犯筋膜者,切除筋膜下1~2 cm肌肉,标记标本长短轴及最深处并送冰冻快速病理检查直至切缘(-)。创面游离植皮11例,临近皮瓣转位+游离植皮5例,临近皮瓣转位2例。

图1 FS-DFSP临床影像学及组织病理学特点Figure 1 Clinical imageologic and histopathological features of FS-DFSP
肿瘤基底深在和/或肿瘤最长径≥5 cm的12例患者术后接受MAID化疗方案4~6次。药物包括异环磷酞胺(10 g/m2),阿霉素(75 mg/m2),氮烯眯胺(250 mg/m2),美司钠为异环磷酰胺总量60%~100%。
1例胸壁FS-DFSP术后病理基底切缘(+),拒绝再次手术后接受术区放射治疗,先行6MV射线瘤床及肿瘤边缘外5 cm,大野照射5 000 cGy,后缩野追加10M电子线。术后10个月(末次化疗后4个月)复发,因复发同时出现肺转移,未再行手术及化疗治疗,行甲磺酸伊马替尼治疗。
1.3 统计学方法
应用SPSS 17.0软件包进行统计学分析。Ka⁃plan-Meier曲线方法进行生存分析,单因素分析采用Log-rank检验。采用Cox风险比例模型进行多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 治疗结果
18例患者均接受手术治疗,13例伤口Ⅰ期愈合,5例植皮部分坏死,经清创换药后痊愈。1例术后出现下肢静脉血栓,予以抗凝治疗及腔静脉滤器置入治疗,无其他围手术期并发症。手术切缘病理结果:17例R0,1例R1。局部复发2例,复发率11.1%,1例术后14月复发,再次手术治疗,至今无瘤生存。1例(切缘R1、予以术后放疗)术后10个月复发,因复发同时出现肺转移,未再行手术治疗,行甲磺酸伊马替尼治疗。
12例患者化疗不良反应尚可耐受,未见化疗中病情进展,化疗结束后病情进展(肺转移)3例,肺转移及局部复发1例,确诊于化疗后2~14个月,中位转移时间11.5个月。2例接受甲磺酸伊马替尼治疗的病例中,复发同时肺转移的1例的疗效为病情稳定(SD),19个月后病情进展,44个月时死亡。1例肺转移的病例疗效为SD,持续至12个月,病情进展,截至末次随访,带瘤生存20个月。1例(化疗后14个月转移)继续予以MAID方案治疗,病情进展,终止治疗。1例(化疗后2个月转移)未行再行化疗。未接受化疗患者均术后无瘤生存。
1例胸壁FS-DFSP术后病理基底切缘(+),术区放疗后9个月复发,肺转移患者因均为双肺多发转移未行放射治疗。
2.2 生存分析
全部患者均获得随访,时间18~86个月,平均53.4个月。截至末次随访,本组病情进展5例:3例死亡,带瘤生存1例,复发再手术后无瘤生存1例,无瘤生存13例。本组中位生存时间为49.50个月。从确诊到死亡或到最近一次随诊,2年生存率为93%,5年生存率为79%(图2)。
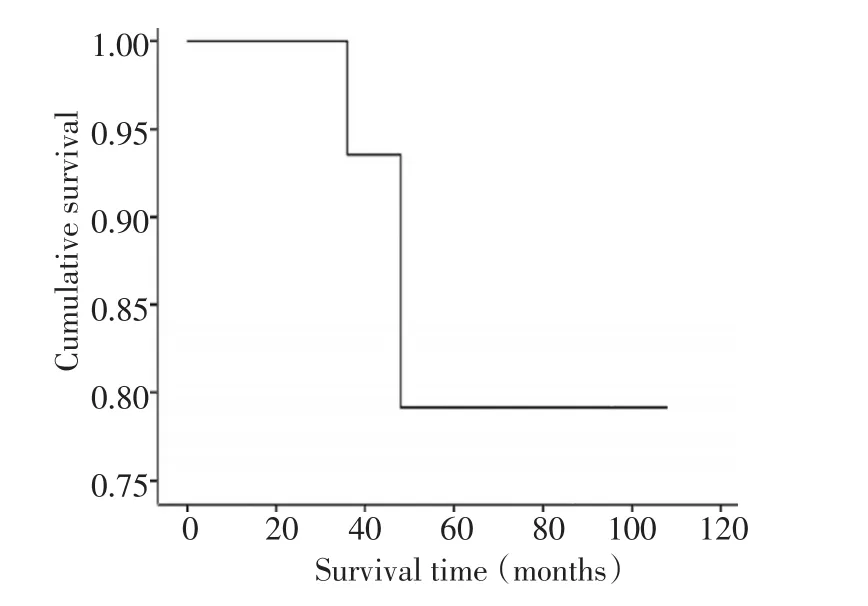
图2 18例FS-DFSP患者的总生存曲线。Figure 2 Overall survival curves of 18 FS-DFSP patients
2.3 预后的相关因素分析
单因素分析结果显示:性别(P=0.70)、年龄(P=0.71)、部位(P=0.20)、肿瘤大小(P=0.28)、深度(P=0.40)、复发(P=0.18)、手术切缘(P=0.10),化疗(P=0.20)与总生存时间(OS)无关。非计划手术次数(P=0.01)、转移(P=0.00)与OS相关,提示影响预后。Cox风险比例模型多因素分析未见与OS相关的独立因素。
3 讨论
手术切除病灶达到无瘤边界是FS-DFSP最主要的治疗手段,无瘤边界通常与手术切除范围(切缘距肿瘤边缘距离)及切缘状态相关。常见描述范围的手术方式为局部切除(local excision,LE)和局部广泛切除(wide local excision,WLE),描述切缘状态的手术方式为Mohs显微手术(Mohs micrographic surgery,MMS)。MMS手术摒弃了手术范围,是通过化学组织固定切片或特殊冰冻切片检测方法明确切缘阴性,目的是既获得R0切缘,同时尽可能保留正常组织。由于在组织学上FS-DFSP可以有分支沿皮肤纤维间隔生长,使肿瘤的生长范围很难确定,手术切除范围目前尚无明确定义[12-13]。Kurlander等[14]的一项多中心研究显示,手术范围≥3 cm者的复发率明显低于<2 cm者。Voth等[2]报道的一项循证医学证据结果显示:手术范围与局部复发率密切相关,LE术后复发率远高于切缘≥2 cm的WLE(38.8%vs.20%),手术范围不确定的患者局部复发率高达63.6%。与此相反,Wun⁃gde等[15]的报道显示,与切缘≥3cm对比,切缘≥5cm未见局部控制的优势,却明显增加了组织重建的难度。目前MMS治疗经典型DFSP的局部复发率≤10%[16],但MMS是否能评价FS-DFSP的切缘状况目前仍存在争议。有学者认为MMS能有效评价肿瘤周边及基底切缘状况,有利于减少肿瘤术后复发及转移[17]。有学者认为MMS治疗FS-DFSP的疗效仍缺乏足够的临床对比研究,由于FS-DFSP呈“蟹爪样”浸润生长,反应区的不连续可能导致切片上的切缘阴性并非肿瘤彻底切除,建议切缘≥3 cm的手术范围结合冰冻切片检查作为治疗FS-DFSP的首选术式[18]。本组病例手术方式为切缘≥3 cm的手术范围结合冰冻切片检查,复发率11.1%,与文献报道基本一致。虽然统计学分析结果显示部位、肿瘤大小、肿瘤深度等因素与OS无关,但在临床工作中,上述因素在客观上直接影响手术切除范围及切缘状态。本研究认为对于FS-DFSP手术范围不应<3 cm,结合切缘术中快速病理检查,可获得较满意的局部控制率,特别注意切除范围的深度,复发病例往往来源于深部组织而非皮肤,切忌因修复重建困难而放弃切除肿瘤的原则。本组病例的病变部位均位于可满足手术范围要求的体壁及四肢,未行MMS手术,但对于面部、手指、足趾等特殊解剖部位,MMS手术仍有其特殊的优势,因此,WLE与MMS可依据解剖部位的特殊性选择使用。
文献报道发生转移的FS-DFSP的患者预后欠佳且多有局部复发病史,多为肺转移,其次为软组织转移,胰腺转移也有报道[19-20]。Liang等[21]报道225例FS-DFSP中32例发生肺转移,23例有复发病史。Voth等[2]报道21例发生转移的患者中17例有复发病史,均为肺转移,10例为FS-DFSP死亡(1~49个月)。Liang等[21]报道的32例转移患者中,12例死亡。Hoesly等[11]报道17例FS-DFSP中3例转移,死亡2例。本研究中4例肺转移,3例死亡,1例带瘤生存,发生转移患者均有复发病史,既往非计划手术次数3~7次,预后分析显示非计划手术次数、转移与预后相关,末次手术后复发与预后无关。本研究分析显示,末次手术后复发率与OS未见相关,但既往非计划手术次数更能体现本病例复发病史特点且与OS相关(P=0.01),除1例初诊外,17例患者均有非计划LE手术后复发病史,个别患者手术次数多达7次,转移患者复发次数≥3次,复发次数越多,转移风险愈大。
生存分析显示Kaplan-Meier 2年生存率为93%,5年生存率为79%,中位生存时间为49.50个月,高于Hoesly等[11]报道的86%、42%,中位生存时间为41.30个月。分析原因认为本研究均获得较为规范的手术治疗,其他研究中均存在无法手术治疗的患者。Cox风险比例模型多因素分析未见与预后相关的独立因素,可能与本研究数量较少有关。
FS-DFSP转移风险高,预后差,但目前尚无公认的辅助治疗方案。对于切缘R1的经典型DFSP推荐辅助性放疗,对于FS-DFSP辅助性放疗是否能控制复发,抑制转移疗效尚未明确。有研究显示辅助性放疗可以减少复发的风险,特别是对切缘阳性及手术范围不足的高危患者。Dagan等[22]及DuBay等[17]报道33例R1、R2、RX切缘的FS-DFSP患者接受辅助放疗,12例患者复发,5例转移,3例复发并转移,13例患者无瘤生存。但由于肿瘤部位、治疗前复发次数、治疗后随访时间差别较大,因此辅助性放疗对于控制FS-DFSP的复发转移有效性还不能明确。本研究仅1例切缘R1的患者术后接受放射治疗后9个月出现复发并转移,不能对辅助性放疗疗效提供依据,因此对于R0切缘且肿瘤≥5 cm及部位较深的高危患者,辅助性放疗能否使患者受益仍需进一步临床随机对照试验的验证。
结合肉瘤的高危因素,辅助化疗能否使FS-DF⁃SP患者受益,目前尚无大宗病例报道。Hoesly等[11]研究17例FS-DFSP,6例予以MAID方案化疗,3例转移。Rutkowski等[20]认为对于进展期FS-DFSP,常规化疗药物无效。王春萌等[23]对3例进展期患者予以MAID方案治疗,未见受益。本研究12例接受化疗的患者中,4例出现转移,1例进展期再行化疗,疗效PD,结果显示辅助化疗与OS无关。在该12例患者中,11例患者均已接受充分的外科治疗,提示辅助性化疗对原发灶切除后具有肉瘤高危因素的FS-DFSP患者控制复发及转移的效果并不确切,且对Ⅳ期FSDFSP挽救性的系统治疗效果不明显。
有研究显示具有染色体异位t(17;22)的DFSP对甲磺酸伊马替尼敏感,t(17;22)在95%DFSP中存在,而对缺乏特异性染色体异常的FS-DFSP对甲磺酸伊马替尼不敏感[24]。文献报道与上述结论不符,McAr⁃htur等[25]首次报道对 1 例具有 t(17;22)转移性 FSDFSP予以甲磺酸伊马替尼治疗有效,而对另1例无t(17;22)转移性FS-DFSP予以甲磺酸伊马替尼治疗无效。Rutkowski等[26]报道甲磺酸伊马替尼治疗8例具有 t(17;22)局部晚期和转移性FS-DFSP,部分有效(PR)5例,SD 1例,疾病进展(PD)2例,随访治疗有效患者的中位进展时间1.7年。后报道甲磺酸伊马替尼治疗7例有t(17;22)无法手术的局部晚期和转移性FS-DFSP,结果类似,2组病例虽然提示预后不良,但对存在t(17;22)的FS-DFSP有效率为71%[20]。王春萌等[23]报道甲磺酸伊马替尼治疗2例局部晚期和转移性FS-DFSP,疗效PR。本组仅2例转移患者接受甲磺酸伊马替尼治疗,截至末次随访1例疗效SD,治疗后19月病情进展,44个月死亡;1例疗效SD,治疗后12个月病情进展,带瘤生存20个月,虽然预后不良,但OS得以改善。
总之,FS-DFSP临床相对少见。手术能否彻底切除肿瘤,降低复发率是治疗FS-DFSP的关键,肿瘤的转移及复发是影响OS的重要因素。对非R0切缘应予以辅助放疗,辅助化疗及甲磺酸伊马替尼疗效尚需进一步研究观察。本研究的局限性为回顾性研究,时间跨度较大,样本量较小,术前资料来源不一,未发现与预后相关的独立因素。期望在以后的临床工作中,规范临床资料,通过多中心研究扩大样本量,进一步充分揭示FS-DFSP的临床特点及预后相关因素。
[1]Monteagudo C,Llombart B,Burgués O,et al.Biphasic dermatofi⁃brosarcoma protuberans with a labyrinthine plexiform highgrade fibrosarcomatous transformation[J].J Cutan Pathol,2015,42(3):206-212.
[2]Voth H,Landsberg J,Hinz T,et al.Management of dermatofibro⁃sarcoma protuberans with fibrosarcomatous transformation:an evidence-based review of the literature[J].J Eur Acad Dermatol Venereol.,2011,25(12):1385-1391.
[3]Zhang J,Wu N,Xia C,et al.Fibrosarcomatous dermatofibrosar⁃coma protuberans;a clinicpathological analysis of 12 cases[J].Chin J Pathol,2013,42(11):753-757.[张 锦,吴 楠,夏 春,等.伴有纤维肉瘤变的隆突性皮肤纤维肉瘤12例临床病例分析[J].中华病理学杂志,2013,42(11):753-757.]
[4]Bichakjian CK,Olencki T,Alam M,et al.Dermatofibrosarcoma protuberans,version 1.2014[J].J Natl Compr Canc Netw,2014,12(6):863-868.
[5]Hisaoka M,Okamoto S,Morimitsu Y,et al.Dermatofibrosarco⁃ma protuberans with fibrosarcomatous areas.Molecular abnor⁃malities of the p53 pathway in fibrosarcomatous transformation of dermatofibrosarcoma protuberans[J].Virchows Arch,1998,433(4):323-329.
[6]Mentzel T,Beham A,Katenkamp D,et al.Fibrosarcomatous(high-grade)dermatofibrosarcoma protuberans:clinicopatholog⁃ic and immunohistochemical study of a series of 41 cases with em⁃phasis on prognostic significance[J].Am J Surg Pathol,1998,22(5):576-587.
[7]Socoliuc C,Zurac S,Andrei R,et al.Multiple Histological Sub⁃types of Dermatofibrosarcoma Protuberans Occurring in the Same Tumor[J].Rom J Intern Med,2015,53(1):79-88.
[8]Valdivielso-Ramos M,Torrelo A,Campos M,et al.Pediatric der⁃matofibrosarcoma protuberans in Madrid,Spain:multi-institu⁃tional outcomes[J].Pediatr Dermatol,2014,31(6):676-682.
[9]Yang Y,Chen Y,Song JG,et al.Guideline diagnosis and treat⁃ment of soft tissue sarcoma in China[J].Chin J clin oncol,2010,37(24):1385-1389.[杨 蕴,陈 勇,宋金纲,等.中国软组织肉瘤诊治策略[J].中国肿瘤临床,2010,37(24):1385-1389.]
[10]Llombart B,Serra-Guillén C,Monteagudo C,et al.Dermatofibro⁃sarcoma protuberans:a comprehensive review and update on di⁃agnosis and management[J].Semin Diagn Pathol,2013,30(1):13-28.
[11]Hoesly PM,Lowe GC,Lohse CM,et al.Prognostic impact of fi⁃brosarcomatous transformation in dermatofibrosarcoma protuber⁃ans:A cohort study[J].J Am Acad Dermatol,2015,72(3):419-425.
[12]Kim M,Huh CH,Cho KH,et al.A study on the prognostic value of clinical and surgical features of dermatofibrosarcoma protuber⁃ans in Korean patients[J].J Eur Acad Dermatol Venereol,2012,26(8):964-971.
[13]Serra-Guillén C,Llombart B,Nagore E.Mohs micrographic sur⁃gery in dermatofibrosarcoma protuberans allows tumour clear⁃ance with smaller margins and greater preservation of healthy tis⁃sue compared with conventional surgery:a study of 74 primary cases[J].Br J Dermatol,2015,172(5):1303-1307.
[14]Kurlander DE,Martires KJ,Chen Y,et al.Risk of subsequent pri⁃mary malignancies after dermatofibrosarcoma protuberans diag⁃nosis:a national study[J].J Am Acad Dermatol,2013,68(5):790-796.
[15]Wunder JS,Nielsen TO,Maki RG,et al.Opportunities for im⁃proving the therapeutic ratio for patients with sarcoma[J].Lancet Oncol,2007,8(6):513-524.
[16]Loghdey MS,Varma S,Rajpara SM,et al.Mohs micrographic sur⁃gery for dermatofibrosarcoma protuberans(DFSP):a single-cen⁃tre series of 76 patients treated by frozen-section Mohs micro⁃graphic surgery with a review of the literature[J].J Plast Reconstr Aesthet Surg,2014,67(10):1315-1321.
[17]DuBay D,Cimmino V,Lowe L,et al.Low recurrence rate after surgery for dermatofibrosarcoma protuberans:a multidisciplinary approach from a single institution[J].Cancer,2004,100(5):1008-1016.
[18]Levy RM,Hanke CW.Mohs micrographic surgery:Facts and controversies[J].Clin Dermatol,2010,28(3):269-274.
[19]Murata H,Ohashi A,Ashida A,et al.Fibrosarcomatous variant of dermatofibrosarcoma protuberans with pancreatic metastasis[J].Int J Dermatol,2014,53(2):e140-142.
[20]Rutkowski P,Dębiec-Rychter M,Nowecki Z,et al.Treatment of advanced dermatofibrosarcoma protuberans with imatinib me⁃sylate with or without surgical resection[J].J Eur Acad Dermatol Venereol,2011,25(3):264-270.
[21]Liang CA,Jambusaria-Pahlajani A,Karia PS,et al.A systematic review of outcome data for dermatofibrosarcoma protuberans with and without fibrosarcomatous change[J].J Am Acad Derma⁃tol,2014,71(4):781-786.
[22]Dagan R,Morris CG,Zlotecki RA,et al.Radiotherapy in the treatment of dermatofibrosarcoma protuberans[J].Am J Clin On⁃col,2005,28(6):537-539.
[23]Wang CM,Luo ZB,Chen Y,et al.Analysis of effect and safty of Imatinib mesylate in the treatment of advance,unresectable or metastatic dermatofibrosarcoma protuberans[J].Chinese Journal of Practical Surgery,2013,2(33):133-136.[王春萌,罗志斌,陈勇,等.甲磺酸伊马替尼治疗隆凸性皮肤纤维肉瘤疗效和安全性分析[J].中国实用外科杂志,2013,2(33):133-136.]
[24]Rutkowski P,Wozniak A,Switaj T.Advances in molecular charac⁃terization and targeted therapy in dermatofibrosarcoma protuber⁃ans[J].Sarcoma,2011,2011:959132.
[25]McArthur GA.Molecular targeting of dermatofibrosarcoma protu⁃berans:a new approach to a surgical disease[J].J Natl Compr Canc Netw,2007,5(5):557-562.
[26]Rutkowski P,Van Glabbeke M,Rankin CJ,et al.European Or⁃ganisation for Research and Treatment of Cancer Soft Tissue/Bone Sarcoma Group;Southwest Oncology Group.Imatinib me⁃sylate in advanced dermatofibrosarcoma protuberans:pooled analysis of two phase IIclinical trials[J].J Clin Oncol,2010,28(10):1772-1779.
