不同分子类型家蚕病原性白僵菌的分离及致病性试验
2015-05-24苘娜娜马焕艳鲁华云倪春霄孟祥坤余荣峰鲁兴萌
苘娜娜马焕艳鲁华云倪春霄孟祥坤余荣峰鲁兴萌
(1杭州市种子总站,浙江杭州 310020;2浙江大学蚕蜂研究所,浙江杭州 310058;3
淳安县茧丝绸总公司,浙江淳安 311700)
不同分子类型家蚕病原性白僵菌的分离及致病性试验
苘娜娜1马焕艳2鲁华云1倪春霄1孟祥坤2余荣峰3鲁兴萌2
(1杭州市种子总站,浙江杭州 310020;2浙江大学蚕蜂研究所,浙江杭州 310058;3
淳安县茧丝绸总公司,浙江淳安 311700)
基于家蚕白僵病在部分蚕区季节性流行较为严重的现象,为了解家蚕病原性白僵菌在养蚕生产中是否存在菌种多样性或存在主流菌种,从浙江省淳安县(CA)、桐乡市(TX)、临安市(LA)和桐庐县(TL)蚕区采集的86份白僵病蚕或病蛹样品中分离得到53个菌株;通过核糖rDNA内部转录间隔区(ITS)序列分析和形态学观察确认,有47个分离菌株为球孢白僵菌属,3个为蜡蚧属,3个为拟青霉属;对ITS序列存在差异的7个分离菌株进行家蚕致病力试验,结果显示,不同菌株对家蚕的致病力存在一定差异,家蚕致病力依次为CA-12(球孢白僵菌属,76.67%)>CA-15(球孢白僵菌属,53.33%)>TX-1(蜡蚧属,28.33%)>CA-1(球孢白僵菌属,16.67%)>CA-6(拟青霉属,10.00%)>TX-12(蜡蚧属,0)=TX-13(0,蜡蚧属),球孢白僵菌株对家蚕的致病力最强,病势也最急,其他菌株对家蚕的致病力有高有低;推测家蚕白僵病致病性菌种呈多样性,试验结果为进一步研究家蚕白僵病的防控提供了参考依据。
家蚕;白僵菌;菌株;ITS序列分析;致病力
家蚕白僵病是养蚕生产上一种常见且危害严重的寄生性真菌蚕病,在我国江苏、浙江、广西、广东等主要蚕区都曾严重暴发[1-4],导致蚕茧大幅减产甚至绝收。球孢白僵菌[Beauveria bassiana(Bals)Vuill,以下简称白僵菌]是该病的主要病原。白僵菌寄主范围非常广,可寄生15个目700多种昆虫及螨类[5],家蚕等鳞翅目昆虫也是白僵菌易感宿主。白僵菌具有极其丰富的遗传多样性[6-7]和种群异质性[8],不同菌株的生态习性及对寄主昆虫的致病力都存在较大的差异[9];因此,开展白僵菌分类研究具有重要意义。传统上的白僵菌分类主要是依据分生孢子和产孢结构的形态特征,但对于形态特征不明显的菌株,若用传统的方法又很难准确鉴定[10]。目前随着分子生物学技术的飞速发展,利用核糖rDNA内部转录间隔区(Internal Transcribed Spacer ITS)序列测定,能实质性地反映出属间、种间以及菌株间的碱基对差异而成为真菌分类研究的一项重要技术手段[11]。
本研究从浙江省淳安县、桐乡市、临安市和桐庐县等蚕区采集的白僵病蚕或僵蛹中分离出菌株,通过ITS序列分析、形态学观察及家蚕致病力试验,寻求养蚕生产中是否存在白僵菌主流菌种,或存在菌种多样性,以期为家蚕白僵病的防控提供依据。
1 材料与方法
1.1 试验材料
供试白僵蚕或僵蛹:2010年在春蚕和夏蚕的5龄僵蚕或僵蛹中采集样品,从淳安县采集21份,桐乡市采集36份,临安市采集9份,桐庐县采集20份,共计86份。样品采集后装袋、按地区编号(淳安县样品代号为“CA-X”,X=1~21份;桐乡市样品代号为“TX-X”,X=1~36份;临安市样品代号为“LA-X”,X=1~9份;桐庐县样品代号为“TL-X”,X=1~20份);放入冰箱中4℃保存备用。
对照菌株:以本实验室保存的已确定种名的球孢白僵菌(BJ)为对照。
蚕品种:菁松×皓月,由桐乡市蚕业有限公司生产,在浙江大学家蚕病理学与病害控制研究室饲养至2龄起蚕备用。
主要试剂和仪器:DNA buffer(含Mg2+)、dNTP、Taq酶、PCR产物回收试剂盒、DNA marker、蛋白酶K等,购自宝生物工程(大连)有限公司;PCR所需引物,由生工生物工程(上海)有限公司合成;酸化玻璃珠(直径425~600μm),购自Sigma公司(美国);氯化苄、醋酸钠(NaAc)等其它化学试剂,均为国产或进口的分析纯;培养基为马铃薯葡萄糖琼脂培养基(PDA)。快速核酸提取仪FastPrep-24,由美国Bio-Rad公司生产;PCR仪Veriti 96,由美国Ap⁃plied Biosystems公司生产;数码显微镜三维分析系统VHX-900,由日本KEYENCE公司生产。
1.2 试验方法
1.2.1 白僵菌菌株分离与鉴定 将采集的86份白僵病蚕或僵蛹的样品及对照菌株BJ,参照文献[12-13]的方法对白僵蚕或僵蛹样品菌株进行分离和鉴定,菌株编号沿用初始样品编号。
1.2.2 分离菌株基因组DNA的提取 参照氯化苄提取白僵菌基因组DNA的方法[14]提取分离菌株基因组DNA,并做了适当改进。改进之处是取新鲜气生菌丝使用酸化玻璃珠破碎法振荡,以及在提取过程中加入蛋白酶K。具体步骤:刮取培养皿内分离菌株的纯培养物(气生菌丝),加0.5 mL DNA提取液(100 mmol/L Tris-Cl、40 mmol/L EDTA),0.1 mL 10%十二烷基磺酸钠(SDS),0.3 mL氯化苄,2倍菌丝体积的酸化玻璃珠混合。使用快速核酸提取仪4 000 r/min剧烈振荡40 s×5次,使管内混合物呈乳状;加2μL浓度为20 mg/mL的蛋白酶K后50℃温浴1 h;冷却至室温后,加入0.3 mL预冷的3 mol/L醋酸钠(NaAc,pH 5.2)溶液,混匀后冰浴15 min,4℃8 000 r/min离心15 min;取上清液移至新EP管中,加入等体积-20℃预冷的异丙醇于室温沉淀30 min,4℃12 000 r/min离心15min,沉淀用-20℃预冷的75%乙醇洗涤1次,干燥后溶于200μL双氧水(ddH2O)中;加2μL浓度为10 mg/mL的RNA酶,37℃水浴1 h;加入等体积的Tris饱和酚,4℃12 000 r/min离心10 min;取上清加入等体积酚—氯仿—异戊醇(25∶24∶1)4℃12 000 r/min离心10 min;取上清加入等体积氯仿—异戊醇(24∶1)4℃12 000 r/min离心10 min;取上清移至新EP管中加入1/10体积浓度为3 mol/L的NaAc(pH 5.2),再加入等体积-20℃预冷的异丙醇,放入-20℃冰箱使DNA沉淀30 min;4℃12 000 r/min离心10min,沉淀用75%预冷的乙醇4℃6 000 r/min离心3 min,洗涤2次,待乙醇挥发完全后,加100μL ddH2O溶解沉淀物,-20℃保存备用。
1.2.3 PCR扩增及测序 采用真菌通用引物[15]ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)进行扩增,由英潍捷基(上海)贸易有限公司合成。PCR反应体系(50μL):0.5μL Taq酶,5μL 10×PCR buffer(含Mg2+),2μL浓度为2.5 mmol/L的dNTP,1μL模板DNA,引物各0.5μL,40.5μL双蒸水。扩增反应条件:94℃5 min;94℃1 min,55℃50 s,72℃55 s,32个循环;最后72℃延伸10 min。扩增产物在1%琼脂糖凝胶中电泳20 min检测是否有目的条带,纯化后由英潍捷基(上海)贸易有限公司进行测序。
1.2.4 进化树构建 将PCR产物测序所得的核苷酸序列通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行同源检索(http://blast.ncbi.nlm.nih.gov/Blast.cgi);用ClustalW软件进行多序列比对;Gene.Doc软件进行序列编辑;用MEGA4软件包中的Neighbor-Joining法构建分子进化系统树,并用Bootstrap分析方法对所构建的进化树进行可靠性检验。
1.2.5 菌落分生孢子着生状态和形态观察 将白僵蚕或蛹来源的分离菌株与对照菌株提取的DNA,PCR产物经测序后,将ITS序列有差异的菌株在PDA培养基上培养10 d(26℃)后,取分生孢子以0.1%Tween-80的无菌水配制成浓度1×107个/mL的分生孢子悬浮液,然后用接种针分别将各分生孢子悬浮液点植于PDA平板培养基上,每皿3点,成正三角形排列,每个菌株3个培养皿,倒置于26℃恒温培养箱中培养。第7天通过数码显微镜三维分析系统VHX-900,放大900倍,利用实时2D、快速深度合成技术观察记录各菌株分生孢子的着生状态。
1.2.6 不同菌株对家蚕致病力的测定 将每个菌株配制成浓度为1×107个/mL的分生孢子悬浮液,取5 mL分生孢子悬浮液放在细胞培养皿(35 mm× 10 mm)中,将2龄起蚕(菁松×皓月)浸2 s后取出正常饲养,每区20头蚕,3次重复。实验室保存的BJ菌株设为阳性对照组,处理同上,空白对照组用无菌水处理。每天调查蚕的死亡情况,3龄起蚕后结束统计。虫尸保湿放置,检查是否会产生菌丝。计算僵虫率,找出致病力较强的菌株。
将致病力较强的菌株分别配制成浓度为1× 102、1×103、1×104、1×105、1×106个/mL的分生孢子悬浮液,试验方法同上。采用Excel进行回归分析[16],计算LC50,并对各菌株进行毒力比较分析。
2 结果与分析
2.1 真菌菌株的分离与鉴定
从浙江省淳安县、桐乡市、临安市和桐庐县等蚕区采集的86份白僵蚕或蛹样品中,分离得到53个菌株,其中:淳安县9个菌株,桐乡市30个菌株,临安市9个菌株,桐庐县5个菌株。对53个分离菌株的DNA特异扩增了rDNA的ITS序列(18S rDNA,ITS 1,5.8S rDNA和ITS 2),扩增产物经1%琼脂糖凝胶电泳,得到1条清晰目的条带,分子量在580 bp左右。PCR产物纯化经双向测序后,与GeneBank数据库中已登陆的基因序列进行比对发现:有47个分离菌株为球孢白僵菌,其中40个与对照菌株ITS序列完全相同,7个分离菌株(CA-1、CA-2、CA-10、CA-12、CA-13、CA-15、CA-16)与对照菌株存在个别碱基差异,并存在3个不同序列。其余分离菌株中有3个(TX-1、TX-12和TX-13)为蜡蚧属(Lecanicillium),其种名分别为L.attenuatum[17]、L.saksenae[18]、L.aphanocladii[19];3个分离菌株(CA-6、CA-20和TX-30)为拟青霉属(Paecilomy⁃ces),即家蚕灰僵菌,但通过NCBI数据库Blast比对尚不足以鉴定到具体的“种”,需进一步结合形态学特征确定种名,结果见表1。
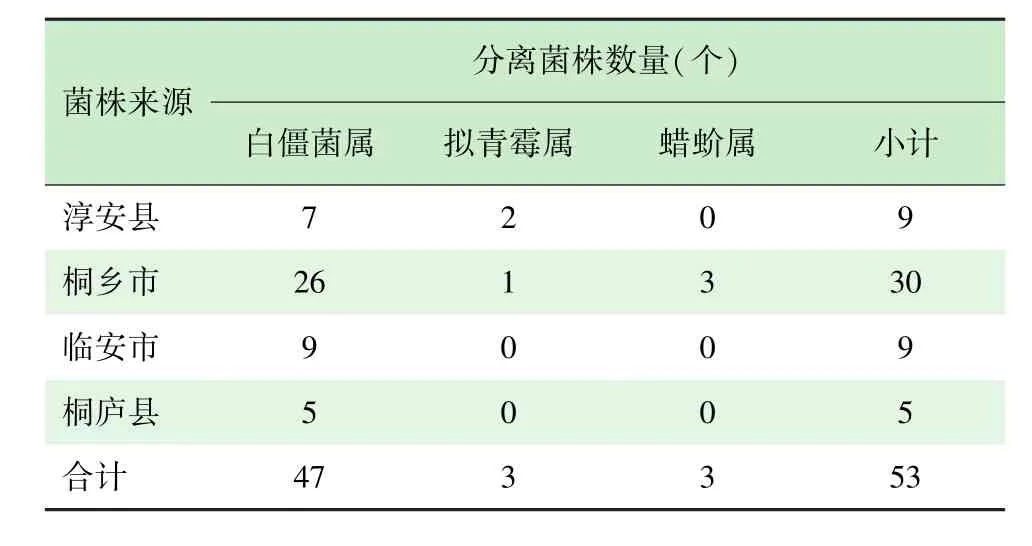
表1 分离菌株基于ITS序列分析的分类鉴别
2.2 分子进化树分析
将同属白僵菌属但ITS序列存在差异的3个分离菌株CA-1、CA-12和CA-15,及拟青霉属的CA-6和蜡蚧属的TX-1、TX-12、TX-13与对照菌株BJ进行核苷酸序列联配比较,采用MEGA的Neighbor⁃Joining法构建ITS序列系统进化树,如图1所示。从系统进化树结果分析,分离菌株可被划分为3类:CA-15、CA-12、CA-1与对照菌株BJ聚为一类,置信值为100%,亲缘关系密切;蜡蚧菌TX-1、TX-12、TX-13聚为一类,置信值大于80%;灰僵菌CA-6自成一类。

图1 基于ITS核酸序列的系统树
2.3 菌落特征和分生孢子的形态
从表2可以看出,将7个分离菌株(CA-1、CA-12、CA-15、CA-6、TX-1、TX-12、TX-13)及对照菌株BJ在PDA培养基上进行菌落形态观察发现,不同属间菌株表现出不同的形态特征。
2.4 分生孢子的着生状态
从菌株分生孢子的着生状态来看,白僵菌BJ(对照)、CA-1、CA-12、CA-15的分生孢子梗多与气生菌丝呈直角分叉对生或散生状态,在顶生的分生孢子下方不远处反复分枝产孢,形成“之”字形弯曲的产孢轴,成簇生长的分生孢子梗上的分生孢子集积而成为葡萄状;蜡蚧菌TX-1、TX-12、TX-13分生孢子梗为离散的皮刺状,轮状着生或单生,长锥型,端部渐狭;灰僵菌CA-6在培养基上培养数日后集积的分生孢子呈淡灰色,在分生孢子梗上下的每个小梗顶端串生分生孢子形成孢子链(图2)。

表2 ITS序列有差异的菌株在PDA培养基上的形态特征比较

图2 不同白僵菌菌株分生孢子的生长形态
2.5 不同白僵菌菌株对家蚕的致病力测定
选用2龄起蚕(菁松×皓月),配制孢子悬浮液浓度为1×107个/mL,采用浸虫法[20-21]测定各分离菌株的致病力。从表3可见,不同白僵菌菌株对家蚕的致病力不同,CA-12、CA-15这2个菌株的致病力较高,对家蚕的致死率分别达到76.67%、 53.33%,TX-1、CA-1、CA-6这3个菌株的致病力相对偏弱,对家蚕的致死率分别为28.33%、16.67%和10.00%,而TX-12、TX-13这2个菌株在观察期内未发现致病力,对家蚕的致死率为0。不同白僵菌菌株对家蚕的致病力依次排序为CA-12>CA-15>TX-1>CA-1>CA-6>TX-12=TX-13。

表3 不同白僵菌菌株对家蚕的致病力(2~3龄)
根据以上试验结果,我们进一步做菌株筛选试验。选取初筛致病力较高的菌株CA-12和对照菌株BJ,分别配成浓度为1×102、1×103、1×104、1×105、1×106个/mL的孢子悬浮液,将2龄起蚕浸渍2 s后正常饲养,计算LC50,结果显示CA-12菌株的LC50为8.48×105个/mL,对照菌株BJ的LC50为1.32× 105个/mL,说明对照球孢白僵菌的家蚕致病力较强(表4)。

表4 高致病性球孢白僵菌LC50测定
3 讨论
白僵菌通过ITS法能够准确快速地鉴定出多数菌株的种名,但对于个别核酸序列数据库中的相同序列较多时,需结合序列比对分析或结合形19:34 2017/5/17态学、生化等表型方法进行鉴定。本研究通过ITS序列分析对不同来源的菌株进行鉴定,53个菌株中有47个为球孢白僵菌属,3个为蜡蚧属(家蚕蜡蚧头孢霉)[22-23],3个为拟青霉属(家蚕灰僵菌),表明感染家蚕表现出白僵病症状的病原种类呈多样性,球孢白僵菌是主要病原菌。另外,发现淳安地区球孢白僵菌间的ITS的差异位点较多,推测是由于白僵菌在自然群体中存在较高的遗传多样性或物种变异所导致,与该地区属于山林地区,野外昆虫数量较多有关。7个分离菌株(CA-1、CA-12、CA-15、CA-6、TX-1、TX-12、TX-13)在相同的培养条件下,菌落形态、分生孢子形态等生物学性状均存在一定的差异,即使来自同一蚕区淳安县的白僵菌菌株CA-1、CA-12、CA-15之间,生物学性状也存在差别,说明相同蚕区的家蚕白僵病病原存在差异,与家蚕白僵病病原的复杂性一说相吻合[24]。
家蚕的致病力是反映菌株性状的重要指标之一。通过家蚕致病力试验发现,不同种类、不同来源的7个分离菌株对家蚕的致病力存在差异,家蚕致病力依次为CA-12(球孢白僵菌属,76.67%)>CA-15(球孢白僵菌属,53.33%)>TX-1(蜡蚧属,28.33%)>CA-1(球孢白僵菌属,16.67%)>CA-6(拟青霉属,10.00%)>TX-12(蜡蚧属,0)=TX-13(蜡蚧属,0),球孢白僵菌对家蚕的致病力最强,病势也最急,其他菌株对家蚕的致病力有高有低[25]。同时,在试验中发现同样来源于桐乡地区的蜡蚧属菌株TX-1(L.attenuatum)、TX-12(L.saksenae)和TX-13(L.aphanocladii)对家蚕的致病力存在较大的差异。根据文献[22]可知,蜡蚧菌的半致死浓度LC50为2.55×106个/mL,本试验配制的蜡蚧属菌株孢子浓度为1×107个/mL,所配溶液浓度高于半致死浓度,而只发现TX-1菌株对家蚕有致病性,TX-12和TX-13菌株回感没有使家蚕发病,推测蜡蚧菌不同的“种”对家蚕的致病性有差异。
[1] 洪根法,帅兆林,程飞能.临安市秋蚕僵病发生原因及防治技术的探讨[J].蚕学通讯,2000,31(4):55-56.
[2] 陈爱萍.金坛市秋蚕白僵病发生原因及防治对策[J].江苏蚕业,2011,33(4):28-29.
[3] 朱方容.大量使用白僵菌治松毛虫或引发广西蚕区僵病暴发[EB/OL].广西农业信息网,2010-04-04.http://www.gxny. gov.cn/web/2010-04/274443.htm.
[4] 廖富蘋,徐兴耀.我省上半年部分地区白僵病暴发原因分析及应对措施[J].广东蚕业,2003,37(3):1-5.
[5] 李增智.球孢白僵菌昆虫寄主名录[C]//中国植物学会真菌学会虫生真菌专业组.中国虫生真菌的研究与应用(第一卷).北京:学术期刊出版社,1988:241-255.
[6] 丁德贵,李增智,樊美珍,等.球孢白僵菌种群在松林中的寄主转移及遗传多样性对松毛虫持续控制的影响[J].应用生态学报,2004,15(12):2 315-2 320.
[7] Wang Sibao,Miao Xuexia,Zhao Weiguo,etal.Genetic diversity and population structure among strains of entomopathogenic fungus,Beauveria bassiana,as revealed by inter-simple sequence repeat(ISSR)[J].Mycological Research,2005,109(12):1 364-1 372.
[8] Castrillo L A,Vandenberg JD,W raight SP.Strain-specific detec⁃tion of introduced Beauveria bassiana in agricultural fields by use of sequence-characterized amplified region markers[J].Journal of Invertebrate Pathology,2003,82:75-83.
[9] Santoro PH,Neves PM,Alexandre TM,etal.Selection of Beauver⁃ia bassiana isolates to control Alphitobius diaperinus[J].Journal of Invertebrate Pathology,2008,97:83-90.
[10]Samson R A,Evans H C,LatgéJP.Atlas of entomopathogenic fun⁃gi[M].Berlin:Springer-Verlag,1988:5-16.
[11]陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3 785-3 786
[12]龚国淑,徐琴,张敏,等.一种简单的病原真菌单孢分离方法研究[J].玉米科学,2010,18(1):126-127.
[13]方中达.植病研究方法[M].3版.北京:中国农业出版社,1996:124-125.
[14]谢翎.球孢白僵菌抗逆相关功能基因克隆与基因工程菌株构建研究[D].合肥:安徽农业大学,2009.
[15]Guo Liangdong,Hyde K D,Liew E C.Detection and taxonomic placement of endophytic fungi within frond tissues of Livistona chinensis based on rDNA sequences[J].Molecular Phylogenetic and Evolution,2001,20(1):1-13.
[16]黄剑,吴文君.利用EXCEL快速进行毒力测定中的致死中量计算和卡方检验[J].昆虫知识,2004,41(6):594-598.
[17]林森,武侠,王凤龙,等.定殖烟草根结线虫卵和雌虫机会真菌的多样性[J].中国生态农业学报,2012,20(10):1 353-1 358.
[18]Sukarno N,Kurihara Y,Mangunwardoyo M IW,etal.Lecanicillium and Verticillium species from Indonesia and Japan including three new species[J].Mycoscience,2009,(50):369-379.
[19]Gams W,Zare R.A revision of Verticillium sect.Prostrata III.Ge⁃neric classificati[M].Nova Hedwigia,2001,(72):329-337.
[20]雷妍圆,吕利华,何余容.不同接种方式下球孢白僵菌对小菜蛾的致病力[J].植物保护,2010,36(6):142-146.
[21]文礼章.昆虫学研究方法与技术导论[M].北京:科学出版社,2009:371-380.
[22]朱志立,周奇迹,葛秀春.玫烟色拟青霉与蜡蚧头孢霉对家蚕病原性的研究[J].蚕业科学,1988,14(2):78-82.
[23]俞云峰.不同惰性载体上发酵产蜡蚧轮枝菌分生孢子生物特性的研究[D].杭州:浙江理工大学,2009.
[24]李佳丽,栾丰刚,李增智.安徽西南部家蚕白僵病病源及传播途径追踪[J].中国农业科学,2011,44(1):143-152.
[25]浙江大学.家蚕病理学[M].北京:中国农业出版社,2001:129.
S884.3+1
A
1007-0982(2015)03-0032-06
2015-04-21;接受日期:2015-06-15
杭州市科技计划项目(编号20091832B09)。
苘娜娜(1983—),女,山东威海,硕士研究生,农艺师。E⁃mail:49449341@qq.com
鲁兴萌,男,教授,博士生导师。Tel:0571-88982305,E⁃mail:xmlu@zju.edu.cn
