大鼠脑动脉瘤形成过程中MMP-2、MMP-9动态变化及多西环素对其的抑制作用
2015-05-23付强吕涛关俊宏
付强,吕涛,关俊宏
(中国医科大学附属盛京医院,沈阳110004)
多项研究证实,基质金属蛋白酶(MMPs)活性异常增加参与了脑动脉瘤的形成,其中MMP-2和MMP-9倍受关注[1~3]。2011年2月 ~2012年5月,我们应用大鼠肾性高血压模型,通过RT-PCR和免疫组化两种方法,在基因和蛋白水平动态观察大鼠脑动脉瘤形成过程中MMP-2及MMP-9的表达变化,阐明其在脑动脉瘤形成过程中的作用;同时,应用MMPs抑制剂多西环素干预肾性高血压大鼠,通过抑制大鼠脑动脉瘤形成过程中异常增高的MMPs表达来阻止或延缓动脉瘤的发生、发展。现报告如下。
1 材料与方法
1.1 材料 雄性SD大鼠90只,体质量200~250 g,由中国医科大学附属盛京医院动物实验中心提供。抗大鼠MMP-2单克隆抗体、抗大鼠MMP-9多克隆抗体、DNA marker(TIANGEN公司),PCR仪(BIOER公司),其他试剂为国产分析纯;引物序列合成由生工生物工程(上海)有限公司完成。
1.2 方法
1.2.1 实验动物分组及造模 将90只大鼠随机分成对照组(n=10)、模型组(n=40)和治疗组(n=40)。模型组和治疗组腹腔注射10%水合氯醛(0.03 mL/kg)麻醉后,经背肋缘下纵切口,用丝线结扎双侧肾动脉后支;术后1周用丝线结扎左侧颈总动脉,1%盐水代替饮水,建立大鼠肾性高血压模型。治疗组予以多西环素(1.5 mg/kg)混入饲料喂养;模型组仅给普通饲料;对照组模拟手术,普通饲料喂养。
1.2.2 脑动脉瘤形成及动脉壁病理观察 所有动物分别于术后 1、2、3 周及 1、2、3、4 个月处死,显微镜下仔细观察颅底右侧动脉环及其主要分支并将其剥离,光镜下观察动脉瘤形成情况及动脉壁病理变化。
1.2.3 脑动脉壁MMP-2、MMP-9蛋白检测 采用免疫组化染色。脱蜡和水化脑动脉壁组织切片,依据一抗要求预处理;3%甲醇—过氧化氢室温去离子水孵育10 min,阻断过氧化物酶活性;滴加一抗MMP-2、MMP-9(1∶50稀释),4 ℃冰箱过夜,PBS冲洗5 min×3次;滴加二抗IgG工作液,室温孵育30 min,PBS冲洗5 min×3次;滴加辣根酶标记链霉卵白素工作液,室温孵育30 min,PBS冲洗5 min×3次。DAB溶液显色,自来水冲洗。常规复染、脱水、透明、封片。阴性对照用 PBS来替代一抗,其余同上。
1.2.4 脑动脉壁MMP-2、MMP-9基因检测 RTPCR法检测MMP-2、MMP-9 mRNA在脑动脉中的表达。TRIzol一步法提取脑动脉总RNA,紫外分光仪测定RNA含量。采用TIANGEN成套试剂盒,β-actin作内参,自行设计引物。MMP-2正义序列为5'-GGAAGCATCAAATCGGACTG-3',反义序列为 5'-GGATACGGTCAGCACCTTTC-3';MMP-9 正义序列为5'-GAATCACGGAGGAAGCCAAT-3',反义序列为 5'-TAGCCCCAACTTATCCAGACT-3';β-actin 正义序列为 5'-GGAGATTACTGCCCTGGCTCCTAGC-3',反义序列为5'-GGCCGGACTCATCGTACTCCTGCTT-3'。RT-PCR反应:取2 μg总RNA加入50 μL反应体系中,循环参数RT:42℃,50 min;PCR:95℃预变性5 min,95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,经30个循环扩增后72℃延伸5 min。取10 μL PCR产物行1.5%琼脂糖凝胶电泳,用凝胶图像分析仪进行条带灰度扫描,结果以目的基因与β-actin灰度比值表示。
1.2.5 统计学方法 采用SPSS20.0统计软件。所有数据采用±s表示,组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组脑动脉瘤形成及动脉壁病理改变比较模型组中11只可见动脉瘤形成,主要位于右大脑前动脉—嗅动脉分叉部;动脉壁表现为内膜垫、内弹力膜完全消失,外膜增厚,成纤维细胞增生,肌层平滑肌消失,血管壁呈动脉瘤样扩张(插页Ⅳ图12);其余大鼠有不同程度动脉瘤样改变。治疗组仅有6只于右侧颅底动脉环前半动脉分叉部可见动脉壁轻度隆起,余大鼠无动脉瘤样改变。对照组大鼠右侧颅底动脉分叉部无上述改变。
2.3 各组脑动脉壁MMP-2、MMP-9蛋白表达比较见表1。模型组阳性颗粒主要位于内皮细胞、巨噬细胞、平滑肌细胞和成纤维细胞质,MMP-2、MMP-9则表达在胞质,呈棕黄色染色。动脉各段阳性颗粒分布不均匀,在动脉瘤样改变处分布更为密集(插页Ⅳ图13)。治疗组脑动脉壁MMP-2及MMP-9表达被抑制,其中MMP-9的抑制更为显著。随着时间推移,MMP-2及MMP-9表达仅有轻度增加,无高峰期出现(插页Ⅳ图14)。对照组大鼠脑动脉壁MMP-2及MMP-9仅少量表达(插页Ⅴ图15)。
2.4 各组脑动脉壁MMP-2、MMP-9基因比较 见图1、图 2。
3 讨论
表1 各组脑动脉壁MMP-2、MMP-9蛋白表达比较(%,±s)
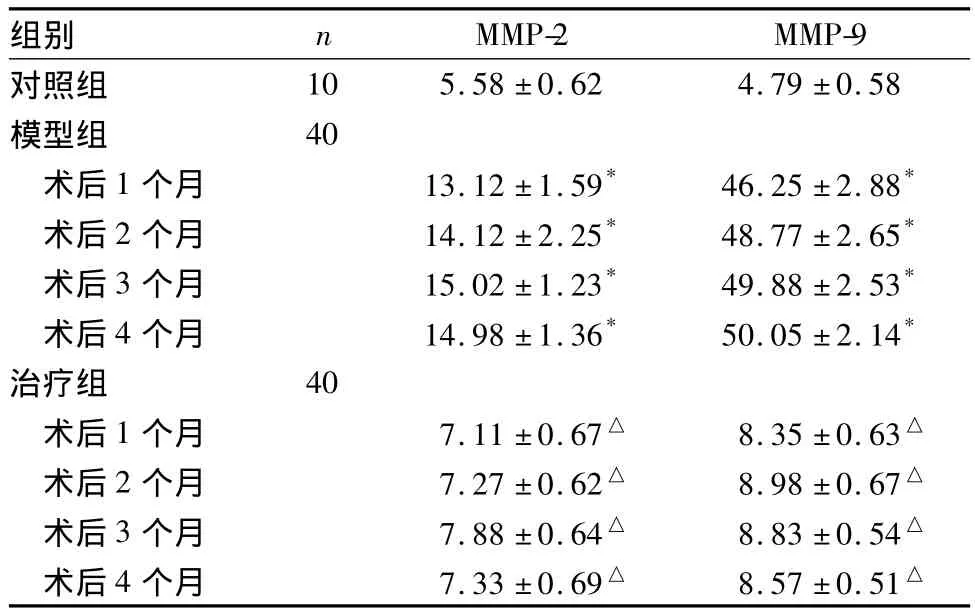
表1 各组脑动脉壁MMP-2、MMP-9蛋白表达比较(%,±s)
注:与对照组比较,*P<0.01;与模型组比较,△P<0.01。
组别 n MMP-2 MMP-9对照组10 5.58±0.62 4.79±0.58模型组 40术后1个月 13.12±1.59* 46.25±2.88*术后2个月 14.12±2.25* 48.77±2.65*术后3个月 15.02±1.23* 49.88±2.53*术后4个月 14.98±1.36* 50.05±2.14*治疗组 40术后1个月 7.11±0.67△ 8.35±0.63△术后2个月 7.27±0.62△ 8.98±0.67△术后3个月 7.88±0.64△ 8.83±0.54△术后4个月 7.33±0.69△ 8.57±0.51△
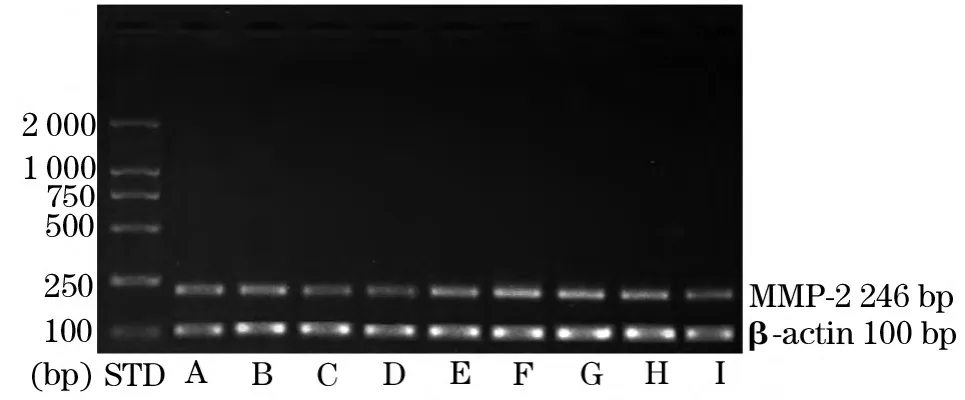
图1 各组脑动脉壁MMP-2基因比较

图2 各组脑动脉壁MMP-9基因比较
脑动脉瘤在人群中的发病率达1% ~3%,动脉瘤破裂出血常致患者伤残,甚至死亡,预后一般较差。开颅手术及血管介入治疗是现有的两种有效治疗手段,但两种方式均为有创性的操作,存在不同程度的手术风险及治疗局限性。学者们期望通过研究脑动脉瘤的发病机制,应用基因及药物等手段,从病因学角度对脑动脉瘤进行相关治疗,从而达到预防或控制脑动脉瘤生长,降低其发病率及改善预后的目的。

图12 模型组动脉瘤前期(HE染色,×400)

图13 模型组MMP-2、MMP-9蛋白表达(免疫组化法,×400)
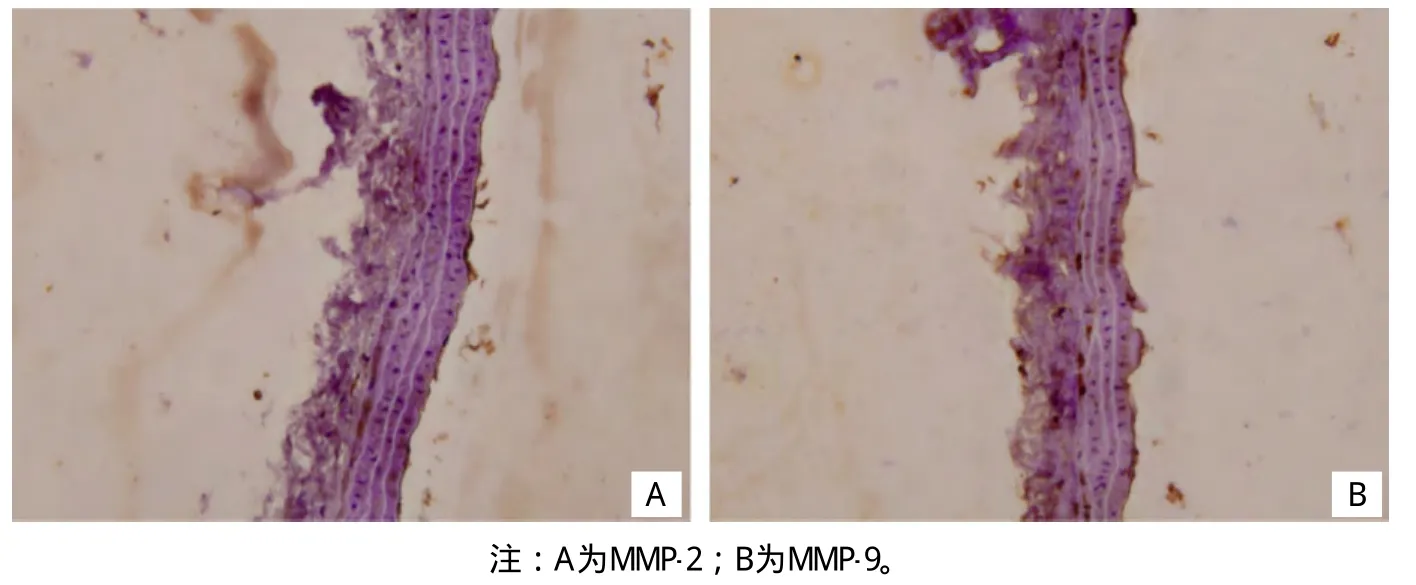
图14 治疗组MMP-2、MMP-9蛋白表达(免疫组化法,×400)

图15 对照组MMP-2、MMP-9蛋白表达(免疫组化法,×400)
MMPs是一组破坏细胞外基质的锌和钙依赖性的蛋白溶解酶,可以降解细胞外基质中的胶原蛋白、非胶原糖蛋白和弹力蛋白,参与细胞外基质重构,其中MMP-2、MMP-9与脑动脉瘤形成关系最为密切。近期研究[4]显示,四环素类抗生素是潜在基质金属蛋白酶抑制剂,其除抑制细菌蛋白合成而达到抗菌作用外,还是一种能影响细胞多种功能的药物。多西环素就是一种化学修饰四环素类抗生素,已被用来降低主动脉瘤[5]、牙周疾病[6]、关节炎等疾病的组织分解,以及减少肿瘤细胞的浸润、转移及血管的生成。
本研究应用免疫组化及RT-PCR法,系统动态观察大鼠脑动脉瘤形成过程中MMP-2及MMP-9表达的变化。结果表明,在大鼠肾性高血压形成早期,随血压升高,MMP-2、MMP-9表达开始升高;在肾性高血压后期,随血压不断升高,MMP-2、MMP-9表达维持在高水平状态,MMP-9较MMP-2表达水平更高;同时,我们应用安全有效剂量的多西环素来干预肾性高血压大鼠作为治疗组,与模型组对比,发现多西环素能显著抑制大鼠脑动脉瘤形成过程中增高的MMP-2、MMP-9,从而降低大鼠脑动脉瘤发生率。本实验结果表明,在大鼠脑动脉瘤形成过程中,动脉壁经历了由完整到逐渐被破坏、最终完全丧失正常层状结构,成为动脉瘤壁的变化过程。MMP-2、MMP-9表达的异常升高破坏了大鼠脑动脉壁弹力蛋白,导致维持脑动脉壁韧性的主要结构内弹力膜断裂、消失,此结果与文献报道[7~11]相一致。同时,我们发现MMP-9异常表达较MMP-2更为明显,为将来寻找有效抑制剂防治脑动脉瘤提供了参考靶点。
大量文献已经证明,多西环素易透过血脑屏障,具有长期用药耐受性高、不良反应小且使用方便、安全、经济等优点。所以,多西环素作为一种神经保护剂,在脑动脉瘤形成过程中可以起到降低疾病发生率的作用,但对于已形成的脑动脉瘤是否具有治疗作用,还有待进一步研究证实。
[1]Hobeika MJ,Thompson RW,Muhs BE,et al.Matrix metalloproteinases in peripheral vascular disease[J].J Vasc Surg,2007,45(4):849-857.
[2]齐巍,赵继宗,王硕,等.基质金属蛋白酶与脑囊性动脉瘤破裂的相关性研究[J].北京医学,2004,26(1):3-5.
[3]严广斌.基质金属蛋白酶[J].中华关节外科杂志(电子版),2010,4(4):566.
[4]Huffman MD,Curci JA,Moore G,et al.Functional importance of connective tissue repair during the development of experimental abdominal aortic aneurysms[J].Surgery,2000,128(3):429-438.
[5]蒋国会,李光勤.强力霉素的神经保护作用[J].国际神经病学神经外科学杂志,2006,33(4):319-322.
[6]Schwartz Z,Lohmann CH,Wieland M,et al.Osteoblast proliferation and differentiation on dentin slices are modulated by pretreatment of the surface with tetracycline or osteoclasts[J].J Periodontol,2000,71(4):586-597.
[7]Sottile J.Regulation of angiogenesis by extracellular matrix[J].Biochim Biophys Acta,2004,1654(1):13-22.
[8]Yamamoto D,Takai S.Pharmacological implications of MMP-9 inhibition by ACE inhibitors[J].Curr Med Chem,2009,16(11):1349-1354.
[9]Raffetto JD,Khalil RA.Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease[J].Biochem Pharmacol,2008,75(2):346-359.
[10]Ishibashi R,Aoki T,Nishimura M,et al.Imidapril inhibits cerebral aneurysm formation in an angiotensin-converting enzyme-independent and matrix metalloproteinase-9-dependent manner[J].Neurosurgery,2012,70(3):722-730.
[11]Gidday JM,Gasche YG,Copin JC,et al.Leukocyte-derived matrix metallopmteinase-9 mediates blood-brain barrier breakdown and is proinflammatory following transient focal cerebral ischemia[J].Am J Physiol Heart Circ Physiol,2005,289(2):558-568.
