清脉饮及其拆方对兔动脉粥样硬化闭塞症模型NO及ET表达的影响
2015-05-22魏齐等
魏齐等
【摘要】目的:研究清脉饮及其拆方对兔动脉粥样硬化闭塞症模型NO及ET表达的影响。方法:选取SPF级雄性健康新西兰白兔为研究对象,建立动脉粥样硬化闭塞症动物模型,36只白兔随机分为全方组、模型组、空白组、活血组、软坚组、清法组。造模的各组在造模完成后恢复普通饮食并分别予以相应药物干预8周后取材。以硝酸还原法测定NO,放免分析法测定ET水平的变化。结果:全方组、软坚组、活血组NO的水平与空白组相比无统计学意义(P >0.05),清法组NO的水平明显高于空白组(P <0.05),清法组、软坚组、活血组、全方组的NO水平均明显低于模型组(P <0.05),清法组的NO水平也低于软坚组、活血组、全方组(P<0.01);清法组、软坚组、活血组、全方组的ET水平均明显低于模型组(P <0.01),与空白组无明显差异,清法组、软坚组、活血组、全方组各组之间差异无统计学意义(P>0.05)。结论:清脉饮及其拆方能升高兔动脉粥样硬化闭塞症模型血液中NO的水平,降低ET的水平,对血管内皮细胞有保护作用,清法组效果最佳。
【关键词】动脉粥样硬化闭塞症;兔;NO ;ET
【中图分类号】R285.5【文献标志码】 A【文章编号】1007-8517(2015)08-0010-02
动脉粥样硬化闭塞症(Atherosclerotic Occlusion, ASO)是指动脉粥样硬化(Atherosclerotic,AS)累及周围动脉并引起慢性闭塞的一种AS相关疾病。近来血管内皮功能在AS发生发展中的作用日益受到关注,许多学者认为血管内皮细胞损伤导致的内皮功能障碍不仅是AS 的一个始动环节,还是导致其不断进展的重要因素[1]。因此,改善和恢复血管内皮功能已经成为AS 防治的重要目标之一。清脉饮是根据名老中医奚九一教授软坚清脉方精简,以清法为主治疗ASO的有效方剂[2],但是目前对以清法为主的复方中药治疗ASO的作用机理和疗效的研究很少,本实验在建立ASO动物模型的过程中使用清脉饮及其拆方进行干预治疗,旨在研究以清法为主改善血管内皮功能而达到对抗动脉粥样硬化的作用机理。
1资料与方法
1. 1 一般资料选用健康新西兰白兔36只(SPF级,青岛康大生物科技有限公司提供scxk ( 3 ) 20110001 ),雄性,体重(2.5~10.2) kg,随机分为全方组、模型组、空白组、活血组、软坚组、清法组,每组6只,于宁夏医科大学实验动物中心SPF级动物房饲养,室温20~22 ℃,湿度40%~50%,用普通饲料或高脂饲料饲养。普通饲料和高脂饲料均由青岛康大生物科技有限公司提供,高脂饲料配方:2%胆固醇、1%脱氧胆酸钠、5%猪油、92%普通饲料。
1.2 研究方法参照文献[3]造ASO动物模型。对全方组、模型组、活血组、软坚组、清法组白兔进行造模。造模方法[4]∶行造模的白兔自造模开始每天分别给予100g高脂饲料,第3天在3%戊巴比妥钠40mg/kg腹腔注射麻醉下行无菌手术,于右侧腹股沟下搏动处暴露股动脉,于无血管分支处用7号手术线绕动脉轻轻结扎,注意不要完全结扎。缝合切口,术后肌注青霉素20万U/只。第7天,静脉注射牛血清白蛋白(250mg/kg),继续喂养高脂饲料,共12周,造模完成。取胸主动脉组织行病理检查判断造模是否成功。继续予以普通饲料喂养8周,然后处死,取血及相关组织。实验持续共计20周。空白对照组:全程喂饲普通饲料,20周后处死。
1.3干预药品①全方:由垂盆草、昆布、大黄、丹参、牡蛎等12味药物组成;②软坚方:海藻、昆布等4味药物组成;③活血方:丹参、蒲黄等4味药物组成;④清法方:垂盆草、大黄等5味药物组成。以上中药饮片均由宁夏古方医院提供,依据传统方法煎煮、过滤,浓缩至140ml/剂。
1.4干预方法白兔经过12周造模完成后,自第13周起,全方组、活血组、软坚组、清法组相应予以清脉饮全方、活血方、软坚方和清法方的中药浓缩液灌胃,模型对照组予以灭菌水灌胃,共8周,白兔日灌胃液体用量为10ml·[KG-*1/5](kg·d)-1。按体型系数换算法中人兔等效药量换算方法计算给药剂量,相当于每组生药量为全方组14g·[KG-*1/5](kg·d)-1,软坚方组5g·[KG-*1/5](kg·d)-1,活血方组4.07g·[KG-*1/5](kg·d) -1,清法方组5.148g·[KG-*1/5](kg·d)-1。
1.5 标本取材及组织处理耳緣静脉穿刺取血约5ml,分别快速注入加入抗凝剂(10%EDTA二钠30μl、抑肤酶40μl)的试管和普通试管中,体积各半(加入抗凝剂的试管需轻轻混匀),于4℃ , 3000rpm/min离心10min,分离血浆和血清,分装,-20℃冻存。
1.6检测项目与方法
1.6.1血清NO测定采用硝酸还原法,按试剂盒说明书操作。反应结束后,将试管内反应液倒入0.5cm光径比色杯中,蒸馏水调零,550nm波长处测定各管吸光度值。代入下列公式中计算血清NO含量。NO(μmol/l)=(样品管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×100 μmol/L ×稀释倍数。
1.6.2血浆ET测定以放免分析法测定。采用非平衡法,严格按照试剂盒说明操作步骤操作。反应结束后,4℃条件下,3000rpm离心20min,吸弃上清液,在自动Y计数仪上测定各管沉淀物放射性计数,直接给出相关参数及标准曲线,自动计算样品浓度。
1.7统计学处理采用SPSS 18.0统计软件对所得数据进行分析,计量资料用均数±标准差表示,完全随机设计的两比较方差齐用t检验,方差不齐用秩和检验,P<0.05为差异有统计学意义。
2结果
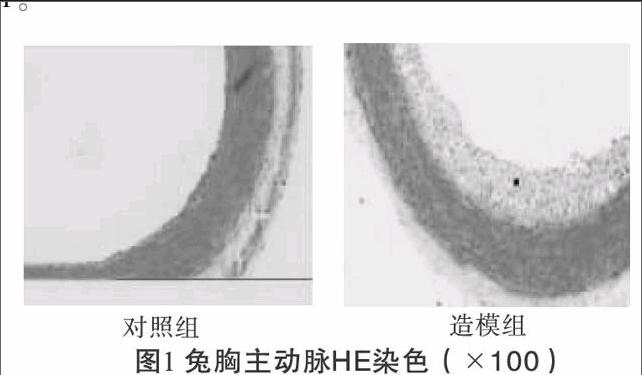
2.1兔主动脉HE染色空白对照组兔主动脉管腔表面光滑,内膜无明显增生,内皮细胞完整连续。模型组兔主动脉内膜增生明显,管腔狭窄,增生的内膜下有大量泡沫细胞,内皮细胞缺失或不连续,提示造模成功,见图1。endprint
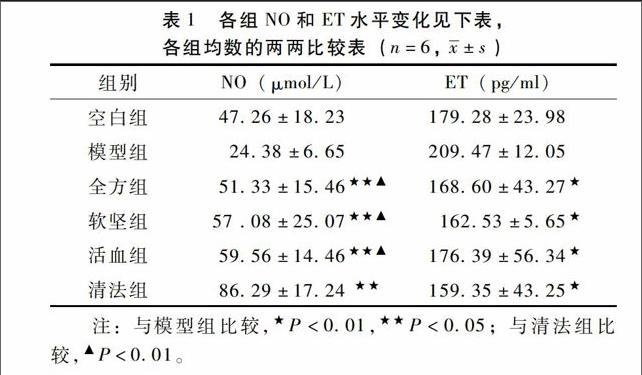
2.2 血清NO、血浆ET的测定全方组、软坚组、活血组NO的水平与空白组相比无统计学意义(P>0.05),清法组NO的水平明显高于空白组(P<0.05),清法组、软坚组、活血组、全方组的NO水平均明显高于模型组(P<0.05),清法组的NO水平也高于软坚组、活血组、全方组(P<0.01),清法组、软坚组、活血组、全方组的ET水平均明显低于模型组(P<0.01),与空白组无明显差异,清法组、软坚组、活血组、全方组各组之间差异无统计学意义(P>0.05)。详见表1。
3讨论
动脉硬化闭塞症(ASO)属于中医的“脉痹”范畴,以往对ASO研究多集中在活血化瘀方面,并且取得了不错的效果和获得了广泛的认可[5],而ASO治疗的其他治则方面的实验研究几乎没有。名老中医奚九一教授长期致力于中医血管病的研究,其在20世纪60年代初就提出了ASO“邪是标,癖是变,损是果,虚是机体的本质”的慢性病变过程的理论,提出“祛邪为先,活血生新,扶正康复”的治疗原则,并用其验方软坚清脉饮治疗ASO取效,为以清法治疗ASO开辟了新的路径[2]。其弟子赵凯[6]教授在此基础上总结认为ASO的病机为“毒滞脉络”, 且邪毒贯穿于疾病的始终,尊《内经》“以通为用”之旨,治法贵在清通,把清邪毒作为治疗的重点,特别是在ASO的早期和急性期,更强调热毒和湿毒作祟为主,并拟以垂盆草、大黄为君药的清脉饮用于临床,取得良效。
血管内皮细胞损伤导致的内皮功能障碍不仅是ASO 的一个始动环节,还是导致其不断进展的重要因素[1]。因此,改善和恢复血管内皮功能已经成为ASO 防治的重要目标之一。内皮细胞功能障碍是早期动脉粥样硬化过程中重要的病理生理变化,内皮细胞功能障碍伴随一氧化氮生物活性降低, 氧化产物的增加及多种黏附分子的表达, 从而启动粥样斑块的形成及发展, 最终导致血管疾病的发生[7]。NO和ET是依赖于血管内皮的一组重要活性物质,检测血液中二者的水平变化即可反映出血管的内皮功能状态。血管内皮细胞产生的NO,通过细胞膜迅速传递至血管平滑肌细胞,使平滑肌松弛,动脉血管扩张,从而调节血压和血流分布[8]。血管内皮细胞产生的NO在生理、病理情况下均有保持血管内皮细胞完整性的作用。NO对ET的合成和释放也有抑制作用,还能清除氧自由基,所以NO具有显著的抗血管动脉粥样硬化的作用。内皮素(ET) 是内皮细胞产生的主要缩血管物质,被认为是迄今发现的最强的内源性缩血管肽,具有很强的缩血管和促细胞增殖作用,血管内皮激活时,内皮素水平增加,而NO的产生减少,表现为内皮依赖性的舒张因子和收缩因子失衡,从而损伤血管内皮功能,造成血管动脉粥样硬化的发生[9]。本实验观察到,软坚组、活血组、全方组的NO水平均明显高于模型组,提示清脉饮及其拆方在一定程度上可以抵消高脂饮食和免疫损伤带来的影响,使其表达与空白组处于同一水平。而清法组NO的水平明显高于模型组且存在显著差异,同时也高于软坚组、活血组、全方组,提示清法组在保护血管内皮功能方面效果最佳。就ET的水平而言,清法组、软坚组、活血组、全方组的ET水平均明显低于模型组,提示清脉饮及其拆方可以降低兔动脉硬化闭塞症模型血液中的ET水平,清法组略低于软坚组、活血组、全方组,但各组之间的差异没有统计学意义。
综上所述,清脉饮及其拆方可以升高兔动脉硬化闭塞症模型血液中NO的水平,降低ET水平,对血管内皮功能有保护作用,其中清法拆方的效果最佳,这为实验及临床研究运用中医清法治疗ASO提供了新的选择。
参考文献
[1]居峰,吴剑,吴文宏,等.高甘油三酯血清对人脐静脉内皮细胞的损伤作用[J].中医执业药师·实验与研究,2011,8(12):27.
[2]王健,奚九一,赵兆琳.软坚清脉方对动脉硬化性闭塞主证的临床研究[J].中国中西医结合外科杂志,2004,10(2):67
[3]赵凯,钱月慧,程晓东.TNF-α、NF-KB在动脉粥样硬化闭塞症兔动脉中的表达变化[J].宁夏医科大学学报,2012,34 (1) :14-16
[4]陈凯伟,钱月慧.清脉饮及其拆方对动脉硬化闭塞症兔主动脉i-KB及NF-KB mRNA表达的影响[J].宁夏医科大学学报,2014, 36(7):720-723.
[5]段宝贵. 活血化瘀中药治疗动脉粥样硬化的研究进展[J].中医学报,2009,9(5):126-127.
[6]赵凯,张磊.清法治疗动脉粥样硬化闭塞症初探[J].中医杂志,2006, 47 (2) :144-145.
[7]李丹,李玉洁.血管内皮功能障碍与动脉粥样硬化研究进展[J]中国实验方剂学杂志,2012,8(2):72-75.
[8]Wagner PD, Masanes F, Wagner H, et al. Muscle angiogenic growthfactor gene responses to exercise in chronic renal failure[J]. Am J PhysiolRegul Integr Comp Physiol,2001,281(2): 539-546.
[9]赵泉,邓靖宇.血管内皮细胞在动脉粥样硬化中的损伤机理[J].中国普外基础与临床杂志,2004 ,25(3):25-29.
(收稿日期:2015.01.23)endprint
