代谢、血液碱化和纯氧影响呼吸调控的人体实验研究III:血液碱化后纯氧运动试验*
2015-05-22孙兴国WilliamStringer王桂芝葛万刚KarlmanWasserman
孙兴国,William W. Stringer,尹 希,王桂芝,4,吕 婧,,5,葛万刚,刘 方,4, Karlman Wasserman
(1.中国医学科学院 北京协和医学院 国家心血管病中心阜外医院 心血管疾病国家重点实验室,心血管病国家临床医学研究中心, 北京 100037;2.美国加州大学洛杉矶分校Harbor-UCLA 医学中心,洛杉矶生物医学研究院,圣约翰心血管研究中心,美国加州90502;3.河北医科大学第四人民医院功能科,石家庄 050000;4.山东省潍坊医学院麻醉学系临床麻醉学教研室和临床医学系,潍坊261061;5.广州市第一人民医院麻醉科,广州 510180)
代谢、血液碱化和纯氧影响呼吸调控的人体实验研究III:血液碱化后纯氧运动试验*
孙兴国1,2,△,William W. Stringer2,尹 希1,3,王桂芝2,4,吕 婧1,2,5,葛万刚1,刘 方1,4, Karlman Wasserman2
(1.中国医学科学院 北京协和医学院 国家心血管病中心阜外医院 心血管疾病国家重点实验室,心血管病国家临床医学研究中心, 北京 100037;2.美国加州大学洛杉矶分校Harbor-UCLA 医学中心,洛杉矶生物医学研究院,圣约翰心血管研究中心,美国加州90502;3.河北医科大学第四人民医院功能科,石家庄 050000;4.山东省潍坊医学院麻醉学系临床麻醉学教研室和临床医学系,潍坊261061;5.广州市第一人民医院麻醉科,广州 510180)
目的:在急性血液碱化前、后空气吸入下完成症状限制性最大极限心肺运动试验(CPET)的基础上,本文探讨在血液碱化后吸入纯氧对呼吸调控的影响。方法:正常志愿者5名在碱化血液后呼吸纯氧CPET,在静息、热身、运动及恢复期,连续测定肺通换气指标及每分钟动脉取样的血气指标,对CPET期间的呼吸气体交换和血气指标的动态变化进行分析,同时与急性碱化血液前、后空气CPET数据比较。结果:碱化血液后吸入纯氧运动呼吸反应与急性碱化血液前、后空气CPET呼吸反应基本一致。CPET期间,各运动状态下的每分通气量均与对照组相似(P>0.05);仅静息每分通气量较血液碱化空气CPET略高(P<0.05),而其它状态和恢复2min时均相近(P>0.05)。潮气量仅峰值运动时较对照和血液碱化空气CPET略低(P<0.05);而运动过程和恢复2min时的潮气量均相近(P>0.05)。呼吸频率在各个时间与血液碱化前后CPET均无差异(P>0.05)。在碱化血液后吸入纯氧运动各个时期的PaO2和SaO2较碱化血液前后空气CPET时明显提高(P<0.001,P<0.05)。血红蛋白浓度虽然较急性血液碱化前后均低,但仅较血液碱化前显著降低(P<0.05),比血液碱化后差异不显著(P>0.05) ; 开始时的PaCO2较碱化血液前后空气CPET时降低(P<0.05),无氧阈时相近(P>0.05),但到峰值及恢复2 min时明显增高(P<0.05);pH仅较对照增高(P<0.05),但与碱化血液空气试验时无差异;乳酸水平较对照略高,但仅在热身和恢复期有差异(P<0.05)。纯氧提高了两人无氧阈和三人峰值运动的功率和时间。结论:虽然血液碱化给予纯氧, CPET呼吸反应与碱化血液前、后空气CPET呼吸反应模式相似,表明运动中呼吸反应主要取决于代谢变化,而非动脉血气平均值高低。
碱化血液;吸入纯氧;心肺运动试验;呼吸反应模式;呼吸频率;潮气量;分钟通气量;
传统生理学分析呼吸调控时假设血液循环相对稳定不变,即呼吸调控信号从肺经过左心到达动脉的过程和时间延迟均被忽略。实际上,正常人呼吸时动脉血氧分压和二氧化碳分压一直是在一定范围内上下波动[1-6]。因此,动态分析呼吸通气指标和血气指标对于研究呼吸调控很有必要。心肺运动试验(cardiopulmonary exercise testing,CPET),作为一种无创伤、客观、定量、连续、可重复多次的临床检测方法,是目前人体整体功能学唯一的检测方法,可对心肺运动期间呼吸、循环、血液、代谢等多系统功能的连续动态变化进行整合分析[7-9],具有重要的临床价值。
血液循环和呼吸的共同目的是向组织运送代谢所需要的O2,同时把代谢产生的CO2运送出体外,O2和CO2为一体化自主调控的核心[10]。改变吸入O2浓度及体内血液CO2含量对呼吸调控产生的影响尚不清楚。近年有人关注心肺运动试验过程中吸入100% O2对呼吸调控的影响。Louvaris等[11]研究发现,慢性阻塞性肺疾病患者在恒定功率下吸入100% O2较吸入正常室内空气时的运动时间延长,但不影响运动肌肉的血流再分布。目前在这方面相关研究尚少,多数仅作了吸入100% O2与吸入室内空气的比较。为了研究动脉血液酸碱度、O2和CO2对呼吸调控的影响,本试验研究了在碱化血液前后空气CPET的基础上,碱化血液之后再吸入100%O2进行CPET测试,对比观察呼吸通气指标、动脉血气和混合静脉血气指标的变化,探讨酸碱、O2和CO2在呼吸调控中的作用。
1 对象与方法
1.1 研究对象
1.2 寻找个体化功率递增速率进行CPET预试验1.3呼吸气体交换测定和系统标定
1.4 动、静脉导管置入和血液采样准备
1.5 正式CPET方案的对照-吸入室内空气CPET
1.6 各种指标及其百分预计值的计算和测定
1.7 血液碱化后室内空气CPET
1.1 -1.7参见本刊急性血液碱化前后室内空气CPET[12,13]。
1.8 血液碱化后/纯氧吸入运动试验
完成急性血液碱化后吸入室内空气运动试验后休息3 h,再次开始行心肺运动试验检查,而且运动过程中保证吸入100%氧气。
1.9 运动过程中吸纯氧装置
Hans Rudolph“T”型非再呼吸活瓣装置(twoway non-rebreathing valves),三通开口,有两个活瓣,无活瓣端接咬口器,呼气活瓣开放端接气流计,吸气活瓣开放端接螺旋管,螺旋管接40L道格拉斯气袋(Douglas bag)并与100%纯氧气瓶连接,有专人控制此连接装置,使Douglas bag处于半充盈状态(20~30 L),保证正常气压下供应纯氧。
1.10 呼吸气体交换测定和系统标定及动、静脉导管置入和血液采样方法
同吸入正常室内空气状态下的CPET检查方法(见1.5)。记录通气指标并作血气分析,各种指标及其百分预计值的计算和测定见1.6。
1.11 按VCO2法心输出量和动静脉氧差计算VO2
由于当时测定技术有限,纯氧浓度超出质谱仪测定范围,无法测出及PET O2,因此,按CO2法计算。人体心输出量(cardiac output,CO)是一定的,通常用(每分摄氧量)计算CO,即式中C(a-v)O2为动-静脉氧含量差[14,15]。也可用V·CO2计算CO,即由此可得出O2。
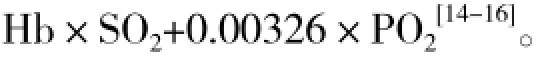
式中:Hb指血红蛋白浓度,SO2指血氧饱和度(%),PO2指血中氧分压(mmHg)。
血浆中CO2含量(CplCO2)的计算使用Henderson-Hasselbach公式推导出的标准公式计算[15,17-20]:CplCO2=2.226×s×PCO2×(1+10pH-pK′)
式中:2.226是CO2在标准温度、压力及干湿度条件下由 mmol/L换算为ml/dl的转换系数;s是CO2在mmol/L/mmHg下的等离子体溶解度系数,pK′是CO2-[HCO3-]缓冲系统的pK[15,17,21]。在37℃、pH7.4的正常人血浆中,s和pK’变量值为0.0307和6.0907,这两个常数取决于血液的温度和pH值,可由下式推导:
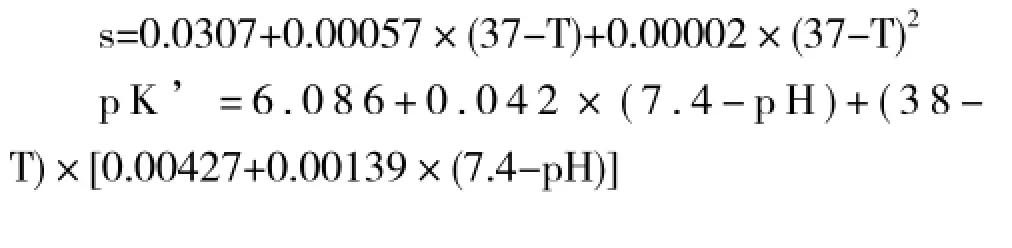
上式中T为血液温度(单位℃)。
血液中总CO2含量(CbCO2,ml/dl)可由道格拉斯等的公式[15,17]计算得出,该公式考虑到了运动中温度及pH值对s和pK′的影响:
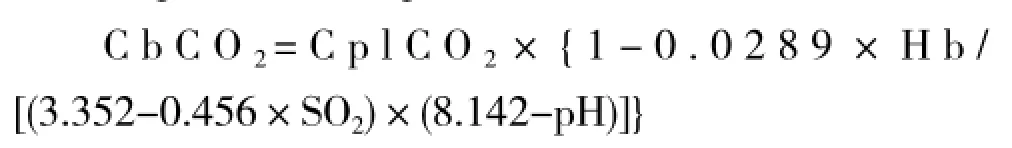
本试验过程中测了动脉血气及混合静脉血气,可从以上公式计算动脉血和混合静脉血O2含量及CO2含量,由此得出动脉血与混合静脉血中O2含量的差值[C(a-v)O2]以及混合静脉血与动脉血中CO2含量的差值[C(v-a)CO2]。
根据以上所有公式以及试验中所测得的血气和气体交换数值,从而可以计算出CO(CO2)和CO(O2)及SV(每搏心输出量,SV=CO/HR)。
1.12 统计学分析
应用统计软件SPSS 20.0进行统计学处理。采用双侧检验。计量资料以均值±标准差()表示。对各种连续动态测定的通气指标及动脉血气指标等参数,进行不同时间之间的单因素方差分析,两两比较;并与非碱化血液以及碱化血液呼吸室内空气状态下所测得的各参数进行方差分析。
2 结果
2.1 部分志愿者极限运动时间延长和功率增高
全部志愿者在碱化血液后按预计方案行CPET检查,达到的无氧阈功率、峰值功率和时间信息见表1(表1见彩图页IX)。在碱化血液基础上吸入100% O2,与非碱化血液吸入100% O2和碱化血液呼吸室内空气相比,5人中有3人的无氧阈功率和最大功率发生了不同程度的递增(25~40 W)以及运动时间延长30~60 s。
志愿者在递增功率运动第4~5分钟时达到无氧阈,在第8.5~9.5分钟时达到峰值。志愿者达到无氧阈时的功率是125~160 W,峰值功率负荷是250~360 W(表1,表1见彩图页IX)。
2.2 CPET通气及动脉血气指标的连续动态变化
从图1和图2(图1见彩图页X,图2见彩图页XI)中可以看出,运动试验中随着功率的递增,潮气量(VT)和每分通气量(V·E)、均呈现近线性渐进性递增(P<0.05);呼吸频率在低强度运动时增快不显著(P>0.05),超过无氧阈水平后显著增快(P<0.05)。急性碱化血液吸纯氧运动中的呼吸反应模式与非碱化及碱化血液吸入室内空气运动时基本一致。动脉血氧浓度一直维持高水平不变(P>0.05),动脉血PaCO2逐步提高到无氧阈后开始显著下降(P<0.05),动脉血pH值逐渐降低;[HCO3-]在无负荷运动时最高,随后逐渐下降,超过无氧阈水平后迅速降低(P<0.05);运动过程中乳酸水平逐渐升高,达到无氧阈水平后迅速增高(P<0.05);运动过程中血红蛋白水平逐渐增高,处于峰值状态时明显增高(P<0.05)。
2.3 在各运动状态下的通气及血气指标与非碱化血液吸入室内空气对照的比较
2.3.1 纯氧运动状态下的通气反应比较 碱化血液吸入纯氧CPET在每个运动状态下的肺通气详见表2(表2见彩图页IX);而与急性碱化血液前后两次空气CPET相比较的每30 s连续动态变化(图1,图1见彩图页X)。 碱化血液吸入纯氧CPET时的每分通气量,除了静息状态较碱化血液吸入空气运动时增高略显著外(P<0.05);热身状态和恢复2 min似乎略高,而运动中又略低,但均无统计学差异(P>0.05);与碱化血液前对照CPET比较静息、热身和恢复状态均增高(P>0.05),而无氧阈和峰值状态通气显著减低(P<0.05)。潮气量峰值状态下较非碱化血液及碱化血液呼吸室内空气明显减低(P<0.05),其余各状态均无差异(P>0.05)。在整个碱化血液吸入纯氧CPET期间的呼吸频率与碱化血液前、后空气CPET的呼吸频率均没有显著不同(P>0.05)。与碱化血液前、后空气CPET比较,VCO2各个状态下反应也均无差异(P>0.05)。
2.3.2 纯氧运动状态下的ABG反应比较 碱化血液吸入纯氧CPET在每个运动状态下的ABG相关指标变化详见表3(表3见彩图页IX);而与急性碱化血液前后两次空气CPET相比较的每状态及每分钟连续动态变化趋势(图2,图2见彩图页XI)。CPET各运动状态血红蛋白浓度均较碱化血液前和后吸入空气运动时进一步降低,但仅与碱化血液前差异显著(P<0.05)。 动脉血气分析指标中PaCO2和血氧饱和度均较碱化血液前和后吸入空气运动时明显增高(P<0.001和P<0.05 )。PaCO2较碱化血液前和后吸空气CPET时减低,无氧阈时无明显差异,但峰值状态及恢复2min明显增高(P<0.05)。pH较碱化血液前明显增高 (P<0.05),与碱化血液后呼吸空气运动无差异(P>0.05)。乳酸水平较碱化血液前增高,在热身状态及恢复期有显著差异(P<0.05)。
2.4 CPET核心功能指标
碱化血液吸入纯氧CPET期间心肺代谢等整体功能核心指标见表4(表4见彩图页XI)。碱化血液吸入纯氧时的峰值耗氧量为(4.30±1.18)L/ min,无氧阈时的氧耗量为(1.80±0.29)L/min,峰值氧脉搏为(22.66±6.12)ml/beat,摄氧通气效率(即摄氧效率峰值平台,OUEP)为75.72±32.24ml/L(P<0.01), CO2排出通气效率(通气效率最小值)为22.94±2.85,以上各值占预计值的百分比分别为134.14±34.17、104.28±16.48、122.36±18.52、170.31±70.96(P<0.01)、96.82±11.81。除了OUEP实测值及其百分预计值外(P<0.01),所有核心指标与服用NaHCO3碱化血液前、后吸入正常空气状态下行CPET检查所测得数据相比,均无统计学差异(P>0.05)。
3 讨论
3.1 相似的呼吸反应模式
碱化血液吸入纯氧CPET期间,随着运动功率逐步递增,潮气量、每分通气量、每分肺泡通气量和肺泡通气量均呈现直线性渐进性递增(P<0.05);呼吸频率在低强度运动时增快不显著(P>0.05),超过无氧阈水平呼吸频率才显著增快(P<0.05);在吸入100% O2运动过程中的呼吸反应模式与非碱化及碱化血液吸入室内空气时运动中呼吸模式一致。碱化血液后改变吸入的O2浓度只改变了血液中的PaCO2、pHa([H+]a)、CO2含量、PaO2、SaO2及O2含量的平均值,并未改变呼吸基本模式和CPET运动中的反应模式。血液中的PaCO2、pHa([H+]a)、CO2含量,PaO2、SaO2及O2含量调控呼吸并不仅取决于其平均值的高低,其随着呼吸转换而产生的“W”形波浪式信号的升降才是生命调控实现呼吸切换所必需[1-7]。
3.2 吸纯氧后运动耐力提高
本研究碱化血液后纯氧吸入CPET,5名受试者中3人的最大功率出现不同程度的递增25~40 W、运动时间延长30~60 s;而其中2人同时表现出AT延后。表明吸入纯氧提高了肺泡氧分压和动脉血氧含量,相对地减少了呼吸作功。已经有不少实验研究提高氧的补充,通过提高了动脉血氧含量而且减少相应的呼吸作功[11,22-26],提高峰值作功能力同时,也改善腿部肌肉血流峰值和氧运送能力[22,26];吸纯氧还可能通过降低所谓的呼吸肌代谢反射弧的作用,减少呼吸作功功率,进而减少运动中腿部肌肉交感神经血管收缩流出量[22,26]。Maltais等[26]研究发现,COPD患者在增量运动中,急性补氧可改善腿部肌肉血流峰值,使患者能完成超过峰值20%的额外工作。
3.3 不同运动状态的比较
在碱化血液吸入纯氧时的静息状态下,每分通气量较碱化血液增高(P<0.05),运动过程中每分通气量减低,恢复2 min时每分通气量增高(P>0.05);与非碱化血液吸入空气时比较,静息、热身、恢复状态每分通气量增高(P>0.05),无氧阈、峰值状态每分通气量减低(P>0.05)。碱化血液吸入纯氧时,峰值状态下的潮气量较非碱化血液及碱化血液呼吸室内空气时明显减低(P<0.05),其余各状态均无明显差异(P>0.05)。体内血O2含量增高,组织有足够的O2利用,因此不需更多的呼吸代偿,所以潮气量和每分通气量减低。Scanco等[27]研究发现,慢性阻塞性肺疾病患者吸入100% O2运动期间,每分通气量、心率、呼吸频率均减低,与本研究结果相似。
3.4 本实验的局限性
由于试验时设备条件所限,在吸入纯氧运动时不能直接测定摄氧量及呼气末氧分压,通过测定每分二氧化碳排出量和动静脉二氧化碳浓度差计算出二氧化碳方法每分输出量,特别是在正常情况下以二氧化碳方法测定每分输出量明显会比氧气测定方法误差大一些[14,15],我们再通过每分输出量除以动静脉氧差推算出每分摄氧量的结果可能会产生些许误差;本研究样本量小,存在统计偏倚,因此本试验研究有其局限性。
3.5 未来人体呼吸调控研究方向的建议
对于未来研究,建议加大样本量对与此有关的内容进行系列研究,特别是关注在生命任何代谢状态下肺泡和动脉的氧气、二氧化碳和血液中氢离子浓度的动态波浪式变化在参与呼吸调控的综合分析研究,以便探讨以氧代谢为核心的呼吸、循环一体化调控机制。
1. Sun XG, Guo ZY. New theory of breathing control: a complex model integrates multi-systems[J]. FASEB J, 2011, 25:lb634.
2. Sun XG, Guo ZY. Decreased magnitudes of arterial O2and CO2oscillation explain Cheyne-Stokes periodic breathing pattern in heart failure patients[J]. FASEB J, 2011, 25:847.24.
3. 孙兴国. 整体整合生理学医学新理论体系: 人体功能一体化自主调控[J]. 中国循环杂志, 2013, 28(2): 88-92.
4. 孙兴国. 生命整体调控新理论体系与心肺运动试验[J].医学与哲学(人文社会医学版), 2013, 34(3): 22-27.
5. 孙兴国. 整体整合生理学医学新理论体系概论I:呼吸调控新视野[J].中国应用生理学杂志, 2015, 31(4): 295-301.
6. 孙兴国. 整体整合生理学医学新理论体系概论II:循环调控新视野[J].中国应用生理学杂志, 2015, 31(4): 302-307.
7. 孙兴国. 整体整合生理学医学新理论体系概论III:呼吸循环代谢一体化调控中神经体液作用模式[J].中国应用生理学杂志, 2015, 31(4): 308-315.
8. Wasserman K, Hansen JE, Sue DY, et al. Principles of exercise testing and interpretation. Including pathophysiology and clinical application[M]. 5th Ed. Philadelphia: Lippincott Williams & Wilkins, 2011.
9. 谭晓越,孙兴国. 从心肺运动应用价值看医学整合的需求[J]. 医学与哲学(人文社会医学版), 2013, 34(3): 28-32.
10. Wasserman K, Stringer WW, Sun XG,et al. Circulatory coupling of external to muscle respiration during exercise[M]. In Wasserman K ed. Cardiopulmonary exercise testing and cardiovascular health. Armonk, NY: Futura Publishing Company, 2002: 2-25.
11. Louvaris Z, Vogiatzis I, Aliverti A, et al. Blood flow does not redistribute from respiratory to leg muscles during exercise breathing heliox or oxygen in COPD[J]. J Appl Physiol, 2014, 117(3): 267-276.
12. 尹希,孙兴国,Stringer WW,等. 代谢、血液碱化和纯氧影响呼吸调控的人体实验研究I:运动试验 [J]. 中国应用生理学杂志, 2015, 31(4): 341-344.
13. 孙兴国,Stringer WW,尹希,等. 代谢、血液碱化和纯氧影响呼吸调控的人体实验研究II:血液碱化后运动试验[J]. 中国应用生理学杂志, 2015, 31(4): 345-348.
14. Sun XG, Hansen J E, Ting H, et al. Comparison of exercise cardiac output by the Fick principle using O2and CO2[J]. Chest, 2000, 118: 631-640.
15. Sun XG, Hansen JE, Stringer WW, et al. Carbon dioxide pressure-concentration relationship in arterial and mixed venous blood during exercise[J]. J Appl Physiol, 2001, 90:1798-1810.
16. Stringer WW, Hansen JE, Wasserman K. Cardiac output estimated noninvasively from oxygen uptake during exercise[J]. J Appl Physiol, 1997, 82: 908-912.
17. Douglas AR, Jones NL, Reed JW. Calculation of whole blood CO2content[J]. J Appl Physiol, 1988, 65: 473-477.
18. Hachamovitch R, Brown HV, Rubin SA. Respiratory and circulatory analysis of CO2output during exercise in chronic heart failure[J]. Circulation, 1991, 84: 605-612.
19. McHardy GJR. The relationship between the differences in pressure and content of carbon dioxide in arterial and venous blood[J]. Clin Sci, 1967, 32: 299-309.
20. Nunn JF. Nunn’s applied respiratory physiology[M]. 4th ed. Oxford, UK: Butterworth-Heinemann, 1997.
21. Austin WH, Lacombe E, Rand PW, et al. Solubility of CO2 in serum from 15 to 38℃[J]. J Appl Physiol, 1963, 18: 301-304.
22. Amann M, Regan MS, Kobitary M, et al. Impact of pulmonary system limitations on leg muscle fatigue in patients with COPD[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299: R314-R324.
23. Bye PTP, Esau SA, Levy RO, et al. Ventilatory muscle function during exercise in air and oxygen in patients with chronic air-flow limitation[J]. Am Rev Respir Dis, 1985, 132: 236-240.
24. O’Donnell DE, D’Arsigny C, Webb KA. Effects of hyperoxia on ventilatory limitation during exercise in advanced chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 163: 892: 898.
25. Somfay A, Porszasz J, Lee SM, et al. Dose-response effect of oxygen on hyperinflation and exercise endurance in non hypoxaemic COPD patients[J]. Eur Respir J, 2001, 18: 77-84.
26. Maltais F, Simon M, Jobin J, et al. Effects of oxygen on lower limb blood flow and O2uptake during exercise in COPD[J]. Med Sci Sports Exerc, 2001, 33: 916-922.
27. Scanco G, van Meerhaeghe A, Willeput R, et al. Effect of oxygen on breathing during exercise in patients with chronic obstructive lung disease[J]. Eur J Respir Dis, 1982, 63(1):23-30.
Human experiments of metabolism, blood alkalization and oxygen effect on control and regulation of breathing III: pure oxygen exercise test after blood alkalization
SUN Xing-guo1,2△, STRINGER WW2, YIN Xi1,3, WANG Gui-zhi2,4, LV Jing1,2,5, GE Wan-gang1, LIU Fang1,4, WASSERMAN K2
(1.State Key Laboratory of Cardiovascular Disease, Fuwai Hospital, National Research Center of Clinic Medicine for Cardiovascular Diseases, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100037, China; 2. Los Angeles Biomedical Research Institute at Harbor-UCLA Medical Center, University of California at Los Angeles, St. John’s Cardiovascular Research Center, California 90502; 3. The 4thPeople’s Hospital Affiliated Hebei Medical University, Shijiazhuang 050000; 4. Departments of Anesthesiology and Clinical Medicine, Weifang Medical University, Weifang 261061; 5. Department of Anesthesiology, the 1stPeople’s Hospital of Guangzhou, Guangzhou 510180, China)
Objective: Aer performed symptom-limited maximum cardiopulmonary exercise testing (CPET) before and aer acute alkalized blood, we repeated CPET with pure oxygen. Methods: Five volunteers, 3hr aer alkalizing blood room air CPET, re-performed CPET inhaling from Douglas bag connected with pure oxygen tank. We compared with those of room air CPETs before and after alkalized blood. Results: After alkalized blood oxygen CPET had a similar response pattern as those of CPETs before and aer blood alkalization. During the CPET, all breath frequency, minute ventilation and tidal volume at each stage were similar to those of CPETs before and aer alkalized blood (P>0.05),except there was a lower peak tidal volume than those of both CPETs and a slightly higher resting minute ventilation only than CPET aer alkalized blood (P>0.05). Aer alkalized blood, oxygen CPET, all PaO2and SaO2and most Hb were lower than those of both CPETs (P<0.05).e pHa and [HCO3-]a were higher than those of CPET before alkalized blood (P<0.05); but were not CPET aer alkalized blood (P>0.05). PaCO2was similar to that of CPET before alkalized blood (P>0.05), but was lower than that of CPET aer alkalized blood at resting and warm-up (P<0.05); then was similar to both CPETs at anaerobic threshold (P>0.05); but was higher at peak exercise higher than those of both CPETs (P<0.01). Oxygen increased 2,3 volunteers’ workload and time at AT and peak exercises. Conclusion: Respiratory response pattern to oxygen CPET aer alkalized blood is similar to those of both CPETs before and aer alkalized blood.e CPET response is dominantly depended upon metabolic rate, but not levels of pHa, PaCO2and PaO2.
alkalizing blood; inhale pure oxygen; cardiopulmonary exercise testing;respiratory response pattern;respiratory frequency; tidal volume; minute ventilation
R332.3
A
1000-6834 (2015) 04-349-007
* 【基金项目】国家自然科学基金医学科学部面上项目(81470204);国家高新技术研究发展计划(863计划)课题(2012AA021009);中国医学科学院国家心血管病中心科研开发启动基金(2012-YJR02)
2015- 06-05
2015-07-05
△【通讯作者】Tel: 010-88398300 ;E-mail: xgsun@labiomed.org
