结核分枝杆菌对氯法齐明耐药的体外诱导实验研究
2015-05-22左小淑王彬徐建付雷陆宇
左小淑 王彬 徐建 付雷 陆宇
·论著·
结核分枝杆菌对氯法齐明耐药的体外诱导实验研究
左小淑 王彬 徐建 付雷 陆宇
目的 利用浓度梯度倍增的氯法齐明(clofazimine, Cfz)体外诱导获得结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)耐药株,并进行耐药机制的初步研究。 方法 选取Mtb标准株H37Rv,从亚最低抑菌浓度 (sub-minimal inhibitory concentration,sub-MIC)[1/8 MIC(按照Cfz的MIC值为0.12 μg/ml配置)、1/4 MIC、1/2 MIC…]开始,在Cfz浓度倍增的7H11固体培养基上进行传代培养,逐步诱导菌株对Cfz的耐药性,并通过药物敏感性试验和全基因组测序来进行验证;同时利用Alamar blue微板分析法 (microplate Alamar blue assay,MABA)测定诱导耐药菌株对10种抗结核药物(INH、RFP、EMB、Mfx、Lzd、Cs、Cm、TMC207、TBI-166、Cfz)的MIC情况。 结果 Mtb标准株经诱导后对Cfz的MIC值是诱导前的32~64倍(诱导前Cfz的MIC值是0.12 μg/ml)。对10种抗结核药物敏感性试验显示,Cfz诱导耐药菌株对TMC207(Bendaquiline)及TBI-166产生交叉耐药。耐药株在7H9液体培养基中进行无药连续培养10代后,测定其MIC值无明显变化,MIC数值都稳定在32 MIC~64 MIC之间,对此诱导耐药株进行全基因组测序共检测到195个单核苷酸多态性(single nucleotide polymorphisma,SNP)突变和19个插入缺失(InDel)突变。 结论 从亚MIC药物浓度开始,逐渐递增的长期药物刺激能够诱导结核分枝杆菌对氯法齐明的获得性耐药,获得的耐药株耐药性稳定。
结核分枝杆菌; 氯法齐明; 抗药性, 细菌; 体外研究
WHO最新报告2013年全球结核病(TB)新发患者估计达900万例,其中多耐药结核病(MDR-TB)48万例(包括3.5%新发患者和20.5%曾接受过抗结核治疗患者),并且耐药程度逐年增加,耐药结核病治疗效果不佳[1]。面对临床多药耐药结核病患者的逐年递增和无药可选的尴尬境地,自2008年WHO在抗结核药物治疗指南中公布氯法齐明(clofazimine, Cfz)可作为第五组抗结核药物应用以来,该药被越来越广泛地应用于临床,尤其是与一线或多种二线抗结核药物联合治疗耐药结核病[2-5],Cfz临床耐药的情况也逐渐出现甚至呈逐渐增加趋势[6],需要引起高度重视。
在TB猖獗的发展中国家,耐药结核病患者中Cfz耐药的发生率逐渐升高[7]。Cfz不同于其他抗结核药物,其作用靶点目前尚不清楚;另外,由于Cfz的临床耐药情况尚不稳定,临床耐药分离株较难获取[8-9],故本研究拟通过实验室人工体外诱导Cfz耐药菌株,为进一步研究Cfz的作用机制和耐药机制提供帮助,对于干预Cfz耐药的发生、指导临床合理用药具有重要意义。
材料和方法
一、材料
1. 菌株:Mtb标准菌株H37Rv(ATCC27294)为北京市结核病胸部肿瘤研究所药物研究室保存菌株。
2. 试剂及培养基:7H9、7H11培养基为美国碧迪医疗器械有限公司产品;白蛋白-葡萄糖-过氧化氢酶(albumin dextrose catalase,ADC) 和阿尔玛蓝(Alamar blue)为英国AbD Serotec公司产品,4 ℃避光保存;二甲基亚砜(dimethyl sulfoxide,DMSO)为成都化学试剂厂产品;Ezup 柱式细菌基因组DNA抽提试剂盒(SK8255/8256)为生工生物工程(上海)股份有限公司产品。
3. 仪器: 恒温培养箱为上海智城分析仪器制造有限公司产品,型号ZHWY-100B;生物安全柜为美国Esco公司产品;多功能酶标仪为Infinite 200 PRO为瑞士Tecan产品;NanoDrop2000为美国 Thermo Fisher Scientific 公司产品。
4. 药物:异烟肼(INH,批号:SLBC3024V)、利福平(RFP,批号:080M1506V)、乙胺丁醇(EMB,批号:050M0034),均为美国Sigma公司产品;莫西沙星(Mfx,批号:BXFZG31)为德国Bayer公司产品;利奈唑胺(Lzd)、环丝氨酸(Cs)、卷曲霉素(Cm)购自中国生物制品检定所;Cfz购自南京立业制药有限公司;贝达喹啉(bedaquiline,Bdq 或 TMC207)为全球结核病药物研发联盟(TB Alliance)惠赠、TBI-166为中国医学科学院药物研究所惠赠。INH、EMB、Cs用灭菌蒸馏水溶解,其余药用DMSO溶解,溶解后以0.22 μm滤膜过滤,-80 ℃保存。
5. 培养基的制备:配置7H11含药(Cfz)琼脂培养基和不含药两种培养基。Cfz含药培养基的浓度梯度分别为:1/8最低抑菌浓度(MIC)(按照Cfz的MIC值为0.12 μg/ml配置)、1/4 MIC、1/2 MIC、MIC……64 MIC。
二、 方法
1. Cfz的MIC和临床耐药界点(clinical breakpoints)的确定: 采用微孔板阿尔玛蓝测定法(microplate alamar blue assay,MABA)对Cfz进行最低抑菌浓度的测定[10], Cfz终浓度设置为0.03~3.84 μg/ml,标准菌株H37Rv终浓度为5×105菌落形成单位(CFU)/ml,测定Cfz对标准菌株的MIC数值。
2. 体外诱导耐药实验: 取冻存于-80 ℃超低温培养箱中H37Rv标准菌株400 μl,加入到含有30 ml新鲜配置的7H9溶液和75 μl 20%吐温80溶液的细胞培养瓶中,充分混匀后置于37 ℃温箱中复苏2~3周,待其生长至对数生长期,备用。
取该生长状态下的菌悬液200 μl,用酶标仪测其吸光度A570 nm(A570 nm=0.1相当于108CFU/ml),然后用7H9液体培养基稀释至107CFU/ml,取100 μl稀释后菌悬液分别接种到5个含Cfz浓度为1/8 MIC(0.015 μg/ml)7H11固体培养板中,培养3周;观察菌株生长情况,再将生长菌落研磨后稀释至107CFU/ml,取100 μl分别接种到5个含Cfz浓度为1/4 MIC(0.03 μg/ml)7H11固体培养板中,培养3周;观察菌株生长情况,再将生长菌落研磨后稀释至107CFU/ml,取100 μl分别接种到5个含Cfz浓度为1/2 MIC(0.06 μg/ml)7H11固体培养板中,培养3周;观察菌株生长情况,按照Cfz浓度倍增制备含药培养基,重复上述流程,依次传代,直至培养基中无或仅有极少量结核分枝杆菌生长为止,记录观察结果。每次传代均设立3个不含药培养基作为对照。
根据参考文献[11]的要求,若诱导后的MIC值是诱导前的8倍以上,认为诱导耐药成功。本研究将Cfz临床耐药界点设定为>1 μg/ml[12]。
继续将获得的耐药菌株在不含药培养基中进行传代,连续传10代,期间先后进行3次MIC实验,验证其MIC数值是否稳定在一定范围。
3.DNA提取及全基因组测序:对获得的诱导耐药菌株进行基因组抽提,按照试剂盒(sk8255)提供的说明书进行操作,用琼脂糖凝胶电泳和NanoDrop 2000对抽提的基因组质量和纯度进行验证。将合格的样品送至北京康普森有限公司进行全基因组测序,使用Hiseq2500 测序平台(Illumina Ⅱ代测序技术) 对样品进行测序,通过BWA 软件和 Samtools软件比较测序数据对参考基因组 NC000962.3 的覆盖情况,判断样品与参考序列的近缘情况。对单核苷酸多态性(single nucleotide polymorphism,SNP)/插入或者缺失(insertion/deletion, InDel)突变进行检测及统计。
4.诱导耐药菌株对其他抗结核药物的敏感性: 从7H11固体培养基上选取结核分枝杆菌H37Rv和Cfz诱导耐药菌株培养2~3周的培养物制成菌悬液,接种到含20%吐温80、10%ADC的7H9培养基中,37 ℃静止培养1~2周,生长至浊度为McFarland 1(相当于107CFU/ml)时,1∶20稀释后,加入各孔100 μl,菌液的终浓度为106CFU/ml。药物的浓度范围分别为:INH 0.015~0.5 μg/ml,RFP 0.015~0.5 μg/ml,EMB 0.25~8 μg/ml,Mfx 0.06~2 μg/ml,Lzd 0.03~1 μg/ml,Cs 3.125~100 μg/ml,Cm 0.3~10 μg/ml,TMC207 0.125~4 μg/ml,TBI-166 0.05~1.6 μg/ml,Cfz 0.12~3.84 μg/ml。每板均设2个不含抗菌药的生长对照孔。96孔板置于37 ℃温箱孵育。6 d后向各实验药物孔和生长对照孔内均加入20 μl的10×Alamar blue和12.5 μl 的20%吐温80混合液,37 ℃ 温箱中孵育24 h;记录各孔的颜色,蓝色孔为无生长,粉红色孔为有生长,紫红色孔再继续37 ℃培养24 h(若不变为粉红色、且其相连的蓝色孔仍为蓝色,则记录为有生长)。MIC定义为阻止颜色变化(从蓝色变为粉红色)的最低药物浓度。
结 果
一、 MIC测定结果
通过MABA法测定标准菌株对Cfz的MIC数值,确定Cfz的MIC数值为0.12 μg/ml。
二、 体外诱导耐药实验
随着Cfz药物浓度的梯度递增,结核分枝杆菌生长的菌落明显减少,64 MIC(7.68 μg/ml)时仅有极少量细小菌落生长。对获得的该菌落进行药物敏感性试验,进行了3次以上的 MIC测定,发现其MIC数值是诱导前的32~64倍,可以判断该方法可以成功诱导Cfz的获得性耐药。
三、 DNA提取及全基因组测序分析
通过对诱导耐药菌株进行全基因组测序,并与H37Rv基因组NC000962.3 进行序列比对,共检测到195个SNP突变位点和19个InDel突变位点,195个SNP突变位点中分别包含63个非同义突变(non-Syn)、65个同义突变(Syn)和67个基因间区(intergenic)变异(表1)。19个InDel位点突变中,9个为编码序列(coding sequence, CDS)区域内可以引起读码框移位的突变,1个为不引起读码框的移位的突变;9个为基因间区的变异(表1)。分析位于CDS区的10个插入缺失突变(表2),其中3个介导代谢与呼吸过程(Rv0197等),2个为PE/PPE蛋白家族成员,其余分别参与信号通路、参与细胞壁和细胞合成、假设蛋白等。分析位于CDS区的128个SNP突变,有38个属于PE或PPE蛋白家族成员,1个参与转录调节基因(Rv0890c),14个假设蛋白,26个调节代谢与呼吸过程(Rv0869c,Rv2097c),17个参与信号转导基因,17个参与脂质代谢的基因,15个参与细胞壁和细胞合成的基因(表3)。
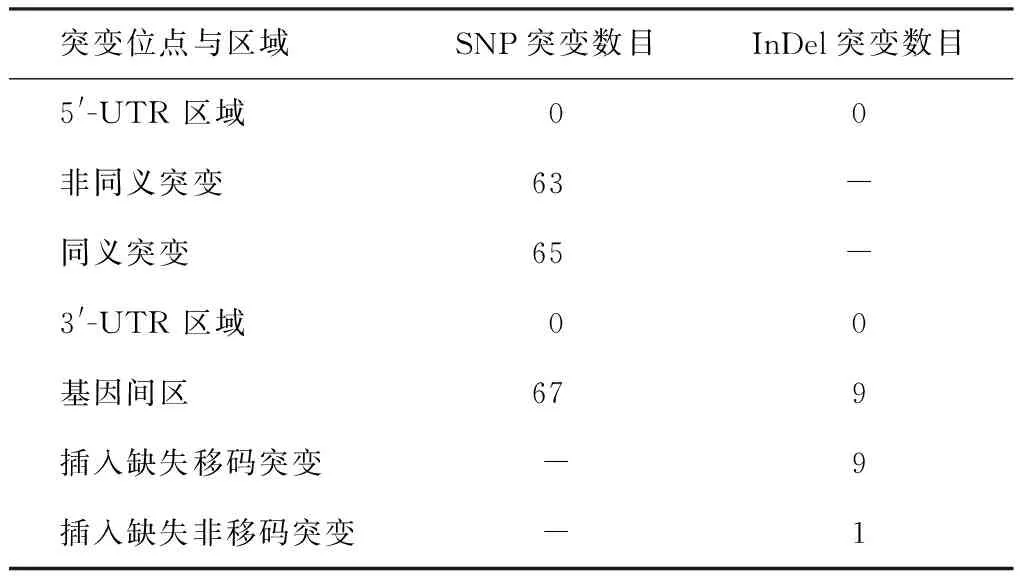
表1 不同突变位点与区域的SNP和InDel注释结果
注 数字是指发生SNP或InDel突变的位点个数;“-”指未检测
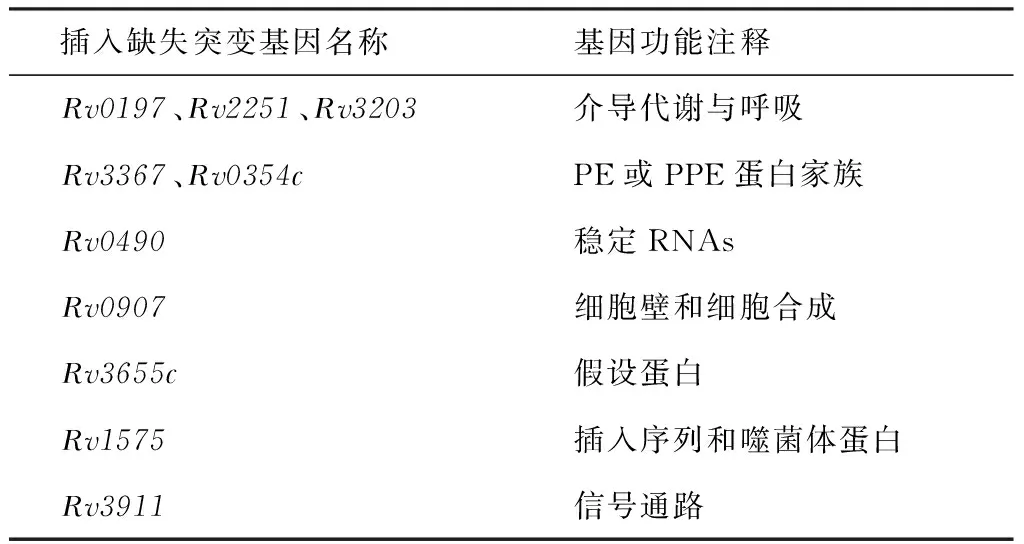
表2 不同插入缺失突变基因的InDel突变基因功能注释
四、交叉耐药实验
通过交叉耐药实验测定诱导后的耐药菌株对10种药物INH、RFP、EMB、Mfx、Lzd、Cs、Cm、TMC207、TBI-166、Cfz的MIC,发现获得的诱导耐药菌株对TMC207、 TBI-166等产生了交叉耐药(表4)。
讨 论
抗结核药物疗程长、患者依从性差、药物不良反应等因素,是产生耐药性的重要原因[13-14],抗结核药

表3 不同SNP突变基因注释
注 表中括号内的数值表示同一基因位点同一基因发生突变的个数
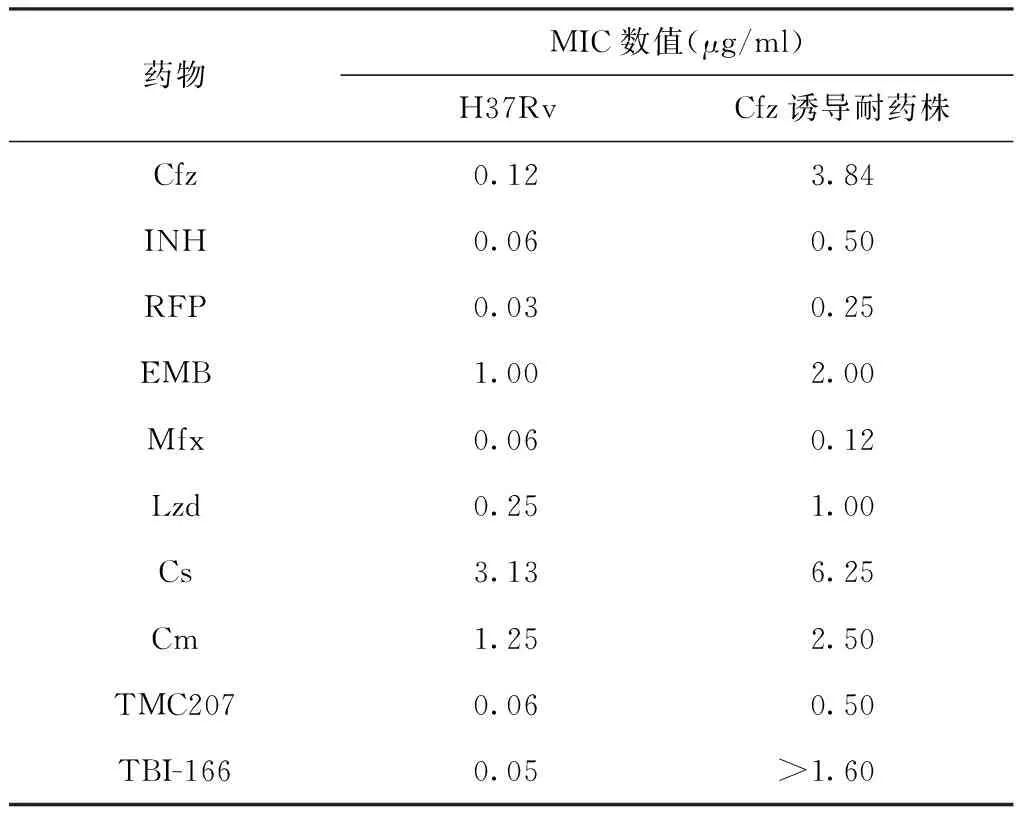
表4 本研究不同抗结核药物的交叉耐药试验结果
物的耐药机制研究一直是研究的热点和难点。本研究采用人工诱导耐药的方法,通过菌株在药物浓度不断增加的选择压力下,由敏感到耐药的演变过程,成功获得了体外诱导的氯法齐明耐药菌株,为其耐药机制的研究奠定了基础,为临床合理用药提供了可靠的理论依据。
与以往研究者筛选耐药株的方法不同[15-16],本研究从亚MIC浓度开始,以Cfz浓度梯度倍增的含药固体培养基对Mtb的标准株H37Rv进行体外人工诱导耐药试验,最终成功将Mtb标准株诱导为对Cfz耐药,并对TMC207、TBI-166等产生了交叉耐药。虽然该诱导菌株对INH、 RFP的MIC数值也有所增高,但未达到CLSI规定的耐药标准,且全基因组测序中并没有发现katG、inhA、rpoB等常见的耐药突变位点。
该研究结果表明,在逐渐增加药物浓度的长期刺激下,Mtb可以产生对Cfz的获得性耐药,并会产生对其他吩嗪类药物(如TBI-166)的交叉耐药,同时也对喹啉类药物(如TMC207)产生交叉耐药。这就提示临床医生在耐药结核病临床治疗中应该谨慎使用这类药物,避免获得性耐药和交叉耐药的产生。
那么,用该诱导方法获得的Cfz获得性耐药菌株对Mtb的耐药稳定性如何,是否会回复为敏感菌株,还是会一直持续耐药,目前尚未见相关报道。我们进一步将最后诱导获得的耐药菌株继续在不含药的培养基中进行传代10代,期间进行了3次MIC实验验证,其MIC数值基本稳定,保持在32 MIC~64 MIC之间;证实其为非适应性生长,从全细胞水平证实了采用MIC倍递增的方法对Mtb进行体外耐药性的诱导是成功的,同时也表明通过该诱导方法获得的Cfz耐药菌株的稳定性较强,其机制可能与Mtb修复其适应性损失的代偿性进化密切相关[17]。
本研究对诱导耐药菌株进行全基因组测序,将测序数据与参考基因组NC000962.3(Mtb标准菌株)进行比对后,共检测到195个SNP突变位点和19个InDel突变,说明该耐药菌株的基因型已经发生了改变,这就从基因分子水平上证实了耐药菌株的诱导是成功的。
在该诱导菌株的SNP突变中,检测到了Rv0678(编码假设蛋白)的突变,这与最新的一些报道是吻合的。Hartkoorn等[18]研究报道了Cfz体外诱导耐药株与 TMC207可以产生显著的交叉耐药,并且初步推测耐药产生的原因是由于调节基因Rv0678的突变上调了外排泵编码基因MmpL5[19];Somoskovi等[20]在1例MDR-TB患者的治疗过程中观察到类似的交叉耐药现象。目前认为该突变基因可能参与了Cfz耐药的发生。对于其他突变基因,是否参与了Cfz耐药性的发生发展,目前尚未检索到相关文献报道,其中某些基因可能参与了Cfz耐药过程,我们将通过后续有关实验来进行进一步验证。
就现有研究结果分析,Cfz也是外排泵作用的底物,其耐药与Rv0678基因突变导致外排泵相关基因MmpL5过表达有关。另一方面,MmpL5作用的这一类药物(clofazimine, bedaquiline)具有一些共性,这些化合物在作用机制上均作用于或影响着电子传递的过程,MmpL5是否仅特异作用于具有这一特点的化合物呢?尚需要进一步深入研究。
本研究通过体外诱导实验,成功获得了对Cfz耐药的Mtb耐药株,并且通过全基因组测序证实了这一点,SNP突变中的Rv0678基因突变已有多处报道与Cfz耐药相关。同时,通过该诱导耐药菌株对10种常用抗结核药物的药物敏感性试验,证实了该菌株对TBI-166、TMC207等药物产生了明显的交叉耐药性,这不仅对于指导临床合理选用抗结核药物具有实际意义,而且为更加深入地研究吩嗪类药物的耐药机制提供了思路。
当然,本研究尚存在一些不足:首先,本研究诱导了一批耐药菌株,并对该诱导菌株进行了全基因组测序,有必要诱导几批菌株,进行重测序验证,加强实验的可靠性。但由于结核分枝杆菌生长缓慢,以及Cfz耐药诱导需要周期长等原因,多批诱导需要较多时间投入。对重测序中发现的突变基因及其功能探究,以及这些突变基因与Cfz耐药机制的发生发展之间的联系,尚需要进一步进行反复验证和深入研究。目前,本实验室已经对第二批诱导菌株进行了重测序,同时选取了Cfz临床耐药株进行重新测序,结果见后续相关报道。
[1] Maitra A, Bhakta S. TB Summit 2014: prevention, diagnosis, and treatment of tuberculosis-ameeting report of a Euroscicon conference. Virulence, 2014, 5(5):638-644.
[2] Caminero JA, Sotgiu G, Zumla A, et al. Best drug treatment for multidrug-resistant and extensively drug-resistant tuberculosis. Lancet Infect Dis, 2010, 10(9):621-629.
[3] Gopal M, Padayatchi N, Metcalfe JZ, et al. Systematic review of clofazimine for the treatment of drug-resistant tuberculosis. Int J Tuberc Lung Dis, 2013,17(8):1001-1007.
[4] Grosset JH, Tyagi S, Almeida DV, et al. Assessment of clofazimine activity in a second-line regimen for tuberculosis in mice. Am J RespirCrit Care Med, 2013, 188(5):608-612.
[5] Zhang Z, Li T, Qu G, et al.In vitro synergistic activity of clofazimine and other antituberculous drugs against multidrug-resistantMycobacteriumtuberculosisisolates. Int J Antimicrob Agents, 2015, 45(1):71-75.
[6] van Ingen J, Simons S, de Zwaan R, et al. Comparative study on genotypic and phenotypic second-line drug resistance testing ofMycobacteriumtuberculosiscomplex isolates. J Clin Micro-biol, 2010, 48(8):2749-2753.
[7] Becerril-Montes P, Said-Fernandez S, Luna-Herrera J, et al. A population-based study of firstand second-line drug-resistant tuberculosis in a high-burden area of the Mexico/United States border. MemInstOswaldo Cruz, 2013, 108(2):160-166.
[8] David HL, Rastogi N, Clavel-Sérès S, et al. Studies on clofa-zimine-resistance in mycobacteria: is the inability to isolate drug-resistance mutants related to its mode of action?Zentralbl Bakteriol Mikrobiol Hyg A, 1987, 266(1/2):292-304.
[9] Oliva B, O’Neill AJ, Miller K, et al. Anti-staphylococcal activity and mode of action of clofazimine. J Antimicrob Chemother, 2004, 53(3):435-440.
[10] 陆宇,王彬,郑梅琴,等. 应用A1amar Blue和MTT测定抗结核药物最低抑菌浓度的研究.中国防痨杂志,2007,29(6): 499-501.
[11] Michéa-Hamzehpour M, Kahr A, Pechère JC. In vitro stepwise selection of resistance to quinolones, beta-lactams and amikacin in nosocomial gram-negative bacilli.Infection,1994,22 Suppl 2:S105-110.
[12] PSchon T, Jureen P, Chryssanthou E, et al. Wild-type distributions of seven oral second-line drugs againstMycobacteriumtuberculosis. Int J Tuberc Lung Dis, 2011, 15(4):502-509.
[13] Pablos-Mendez A, Raviglione MC, Laszlo A, et al. Global surveillance for antituberculosis-drug resistance, 1994-1997. World Health Organization-International Union against Tuberculosis and Lung Disease Working Group on Anti-Tuberculosis Drug Resistance Surveillance. N Engl J Med, 1998, 338(23):1641-1649.
[14] Munro SA, Lewin SA, Smith HJ, et al. Patient adherence to tuberculosis treatment: a systematic review of qualitative research. PLoS Med, 2007, 4(7):e238.
[15] Malik M, Chavda K, Zhao X, et al. Induction of mycobacte-rial resistance to quinolone class antimicrobials. Antimicrob Agents Chemother, 2012, 56(7):3879-3887.
[16] Siddiqi S, Takhar P, Baldeviano C, et al. Isoniazid induces its own resistance in nonreplicatingMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2007, 51(6):2100-2104.
[17] Andersson DI, Hughes D. Antibiotic resistance and its cost: is it possible to reverse resistance? Nat Rev Microbiol, 2010, 8(4):260-2671.
[18] Hartkoorn RC, Uplekar S, Cole ST. Cross-resistance between clofazimine and bedaquiline through upregulation ofMmpL5 inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2014, 58(5):2979-2981.
[19] Andries K, Villellas C, Coeck N, et al. Acquired resistance ofMycobacteriumtuberculosisto bedaquiline. PLoS One, 2014, 9(7):e102135.
[20] Somoskovi A, Bruderer V, Homke R, et al. A mutation associated with clofazimine and bedaquiline cross-resistance in MDR-TB following bedaquiline treatment. Eur Respir J, 2015, 45(2):554-557.
(本文编辑:范永德)
In vitro induction ofMycobacteriumtuberculosisresistance to clofazimine
ZUOXiao-shu,WANGBin,XUJian,FULei,LUYu.
DepartmentofPharmacology,BeijingKeyLaboratoryforDrugResistanceTuberculosisResearch,BeijingChestHospital,CapitalMedicalUniversity,BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
LUYu,Email:luyu4876@hotmail.com
Objective To inductMycobacteriumtuberculosis(Mtb) resistant strains in vitro by using gradient multiplied concentration of clofazimine (Cfz) and study the preliminary mechanisms of resistance. Methods We subcultured Mtb standard strains H37Rv to 7H11 solid medium with doubled Cfz concentrations from the beginning of sub-MIC concentrations (1/8 MIC, 1/4 MIC, 1/2 MIC...) and induced Cfz-resistance gradually. Than we tested the resistance through drug susceptibility testing and whole genome sequencing. Meanwhile, We measured the MICs of the induced resistant strains to ten anti-TB drugs(INH,RFP,EMB,Mfx,Lzd,Cs,Cm,TMC207,TBI-166,Cfz). Results MIC values of the Mtb standard strain after induction were 32 to 64 times higher than before (0.12 μg/ml), The drug susceptibility testing also showed that Cfz had a cross-resistance to TMC207 (Bendaquiline) and TBI-166; MIC values of the Mtb resistent strain was stable among 32 MIC to 64 MIC after continuously cultivating 10 generations in drug-free 7H9 liquid medium. We also detected 195 single nucleotide polymorphism (SNP) mutations and 19 insertion deletion (InDel) mutations in this resistant strain by whole genome sequencing. Conclusion Cfz resistent strain can be obtained by the long-term drug-induced stimulation from the beginning of sub-MIC concentrations to gradually increasing the concentrations. The resistent strain had a stable characteristic.
Mycobacteriumtuberculosis; Clofazimine; Drug resistance, bacterial; In vitro
10.3969/j.issn.1000-6621.2015.06.012
“十二五”国家科技重大专项(2012ZX09301002-005-003);北京市医院管理局临床医学发展专项经费资助(ZYLX201304)
101149 首都医科大学附属北京胸科医院耐药结核病研究北京市重点实验室 北京市结核病胸部肿瘤研究所药物研究室
陆宇,Email:luyu4876@hotmail.com
2015-02-04)
