不同产地木瓜中绿原酸、原儿茶酸和总酚的含量测定Δ
2015-05-21谢晓梅程菁菁安徽中医药大学药学院现代中药安徽省重点实验室安徽省115新安医药研究与开发产业创新团队合肥230012
韩 煜,杨 沫,谢晓梅,程菁菁,王 键(安徽中医药大学药学院/现代中药安徽省重点实验室/安徽省“115”新安医药研究与开发产业创新团队,合肥 230012)
中药木瓜又名皱皮木瓜,为蔷薇科木瓜属植物贴梗海棠Chaenomeles speciosa(Sweet)Nakai的干燥近成熟果实[1],主产于安徽宣城、重庆綦江、湖北资丘及云南等地,历代本草以宣木瓜为道地药材。木瓜含有有机酸、三萜类、多酚和多糖等[2-4]。植物多酚是一类广泛存在于植物体内的复杂次生代谢产物。随着多酚类成分在抗氧化、抗癌、防治心血管疾病等多方面活性的研究不断深入[5-8],植物多酚已成为当前研究的热点之一[9]。但目前鲜见中药木瓜多酚较为系统的研究报道。本文通过双波长切换高效液相色谱(HPLC)法和Folin-Ciocalteau比色法对国内主要产地木瓜中绿原酸、原儿茶酸和总酚含量进行比较,考察多酚与绿原酸、原儿茶酸含量的相关性,以为木瓜的质量控制和评价提供科学依据,并为其深度研究与开发利用积累试验资料。
1 材料
1.1 仪器
1260型HPLC仪,包括二元泵系统、自动进样器、柱温箱、二极管阵列检测器和ChemStation色谱工作站(美国Agilent公司);756MC型紫外可见分光光度计(上海精密科学仪器有限公司);BP221D型电子天平(德国Sartorius公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);Milli-Q实验室超纯水器(美国Millipore公司)。
1.2 试剂
绿原酸对照品(批号:110753-200413)、原儿茶酸对照品(批号:110809-200604)和没食子酸对照品(批号:110831-200302)均由中国食品药品检定研究院提供;乙腈为色谱纯,磷酸、甲醇等为分析纯,水为超纯水。
1.3 药材
木瓜药材产地及收集地详见表1。所有样品经安徽中医药大学彭华胜教授鉴定为蔷薇科植物贴梗海棠C.speciosa(Sweet)Nakai的果实,用前粉碎,过80目筛,混合均匀。
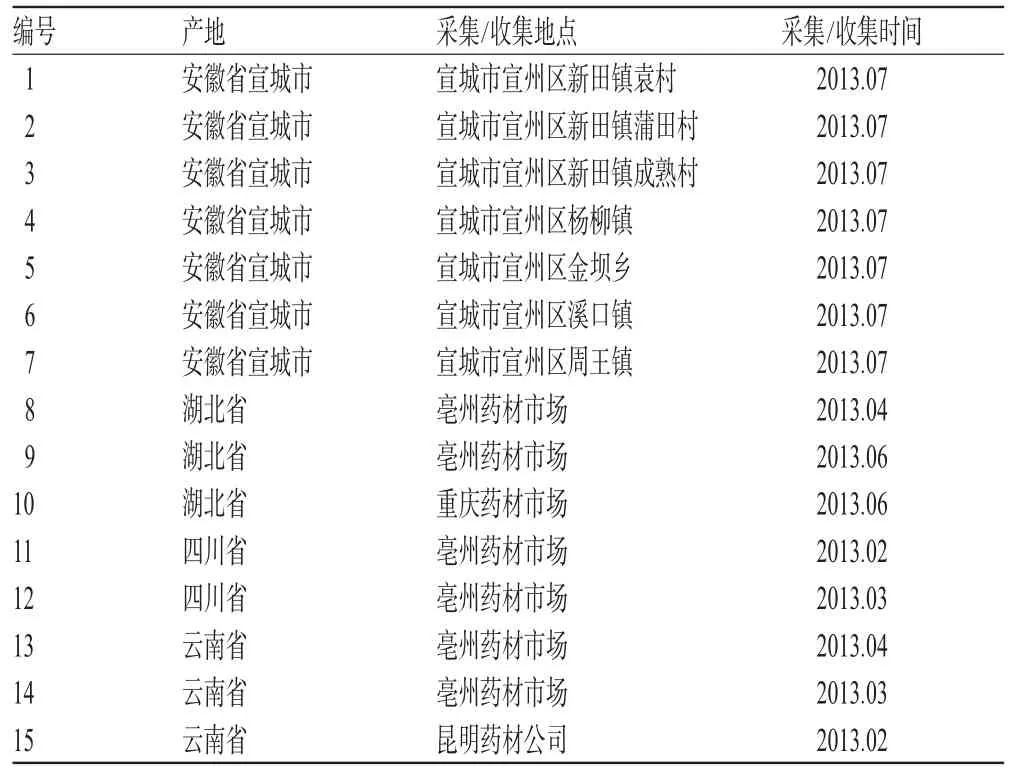
表1 木瓜药材产地和收集地Tab 1 The different habitats and collected areas of C.sinensis
2 方法与结果
2.1 原儿茶酸和绿原酸的含量测定
2.1.1 色谱条件与系统适用性试验 色谱柱:Shim-pack CLC-ODS(M)柱(250mm×4.6mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(15∶85,V/V);检测波长为259nm和325nm,波长切换程序为:0~14min,259nm,14~25min,325nm;流速:0.5ml/min;柱温:25 ℃;进样量:20μl。理论板数以原儿茶酸和绿原酸峰计,分别为14000、14500,测量峰与相邻峰分离度均大于5。色谱详见图1。
2.1.2 对照品溶液的制备 精密称取原儿茶酸对照品7.07mg、绿原酸对照品7.24mg,分别置于5ml量瓶中,加50%甲醇使溶解,定容,摇匀,制成原儿茶酸、绿原酸对照品贮备液;精密移取原儿茶酸对照品贮备液0.5ml、绿原酸对照品贮备液2ml,分别置于10ml量瓶中,加50%甲醇定容,制成每1ml含原儿茶酸0.0707mg和绿原酸0.2896mg的对照品溶液。
2.1.3 供试品溶液的制备 取木瓜供试品约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25ml,密塞,称定质量,超声(功率:250 W,频率:40 kHz)处理30min,放冷,用50%甲醇补足减失的质量,摇匀,滤过,即得。
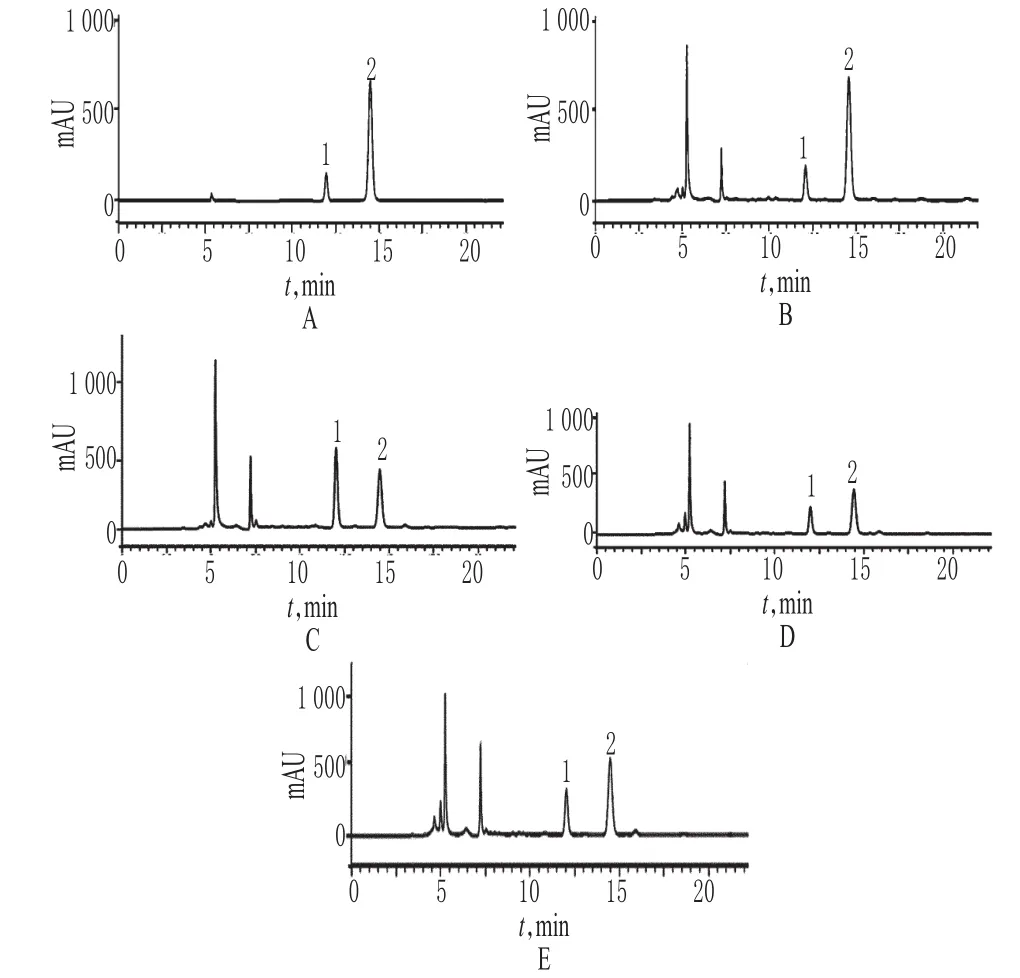
图1 高效液相色谱图A.对照品;B.宣城木瓜(编号 6);C.云南木瓜(编号13);D.四川木瓜(编号11);E.湖北木瓜(编号8);1.原儿茶酸;2.绿原酸Fig 1 HPLC chromatogramsA.reference;B.C.sinensis from Xuancheng(No.6);C.C.sinensis Yunnan(No.13);D.chaenomelis fructus from Sichuan(No.11);E.C.sinensis from Hube(iNo.8);1.protocatechuic acid;2.chlorogenic acid
2.1.4 检测波长和切换时间 采用二极管阵列检测器,在200~400nm波长范围扫描并记录与原儿茶酸、绿原酸保留时间相同的供试品色谱峰的紫外光谱,并与原儿茶酸、绿原酸光谱图比较。结果显示,供试品中与对照品保留时间相同的色谱峰,其紫外光谱与对照品一致,详见图2。依据所得光谱,分别选择原儿茶酸最大吸收波长259nm和绿原酸最大吸收波长325nm为各自的检测波长,结合供试品在259nm和325nm的色谱图,最终确定波长切换时间在进样14min时。
2.1.5 线性关系考察 分别精密吸取原儿茶酸对照品溶液0.5、3.0、10.0、30.0、35.0μl,绿原酸对照品溶液 1.0、2.0、5.0、10.0、15.0μl,按“2.1.1”项下色谱条件,依序注入HPLC仪,以色谱峰面积(y)为纵坐标,对照品进样量(x,μg)为横坐标,绘制标准曲线,得原儿茶酸的回归方程为y=5603x+203.5(r=0.9995),绿原酸的回归方程为y=4075x+757.9(r=0.9995);表明原儿茶酸、绿原酸的进样量分别在0.0354~2.47、0.289~4.34μg范围内与各自峰面积呈良好的线性关系。
2.1.6 精密度试验 取“2.1.2”项下对照品溶液适量,按上述色谱条件连续进样5次测定。结果,原儿茶酸、绿原酸峰面积的RSD分别为1.52%、1.04%,表明仪器精密度良好。
2.1.7 稳定性试验 取同一供试品(编号6)溶液适量,分别于配制0、1、2、4、12h时按上述色谱条件进样测定。结果,原儿茶酸、绿原酸峰面积的RSD分别为2.90%、0.21%,表明供试品溶液在12h内稳定。
2.1.8 重复性试验 取同一批木瓜供试品(编号6)6份,精密称定,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定。结果,原儿茶酸、绿原酸含量的RSD分别为2.29%、1.80%,表明本方法重复性较好。

图2 紫外光谱图A.原儿茶酸;B.绿原酸;C.与原儿茶酸保留时间相同的成分;D.与绿原酸保留时间相同的成分Fig 2 UV spectrumA.protocatechuic acid;B.chlorogenic acid;C.compound with the same retention time as protocatechuic acid;D.compound with the same retention time as chlorogenic acid
2.1.9 加样回收率试验 取同一批已知含量的木瓜供试品(编号6)0.5 g,精密称定,分别准确加入一定量的原儿茶酸和绿原酸对照品,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,计算加样回收率,结果详见表2。

表2 原儿茶酸和绿原酸的加样回收率试验结果(n=6)Tab 2 Results of recovery test of protocatechuic acid and chlorogenic acid(n=6)
2.1.10 原儿茶酸和绿原酸的含量测定 取不同产地的木瓜供试品各适量,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录峰面积,按外标法计算原儿茶酸和绿原酸含量。
2.2 总酚的含量测定
2.2.1 对照品溶液的制备 精密称取置五氧化二磷干燥器中的没食子酸、绿原酸和原儿茶酸对照品适量,分别置于5ml量瓶中,加甲醇使溶解,定容,摇匀,制成每1ml含没食子酸0.199mg、绿原酸0.224mg和原儿茶酸0.193mg的对照品溶液。
2.2.2 供试品溶液的制备 取木瓜供试品0.1 g,精密称定,精密加入50%甲醇25ml,称质量,超声(功率:250 W,频率:40 kHz)处理30min,冷却,用50%甲醇补足减失的质量,摇匀,滤过,收集续滤液,即得。
2.2.3 检测波长和指标成分的选择 精密移取绿原酸、原儿茶酸和没食子酸对照品溶液及供试品溶液各适量,分别置于25ml量瓶中,加Folin-Ciocalteau试液1.0ml,超纯水10ml,用7.5%Na2CO3溶液稀释至刻度,摇匀,室温放置2 h,以空白试液为参照,在300~800nm波长范围内扫描,记录紫外吸收光谱,详见图3。结果表明,各对照品和供试品溶液显色后,吸收光谱相似,最大吸收均在763nm波长处;其中,没食子酸是2010年版《中国药典》(一部)总酚测量的指标成分[1],课题组在对木瓜酚类成分预试验中,检出了原儿茶酸和绿原酸,较少检出没食子酸;考虑原儿茶酸较绿原酸易得,故选择原儿茶酸为木瓜总酚测量的指标成分。

图3 吸收光谱图1.没食子酸;2.原儿茶酸;3.木瓜供试品(编号 3);4.绿原酸Fig 3 Absorption spectra1.gallic acid;2.protocatechuic acid;3.test sample of C.sinensis(No.3);4.chlorogenic acid
2.2.4 线性关系考察 精密移取“2.2.1”项下原儿茶酸对照品溶液 0.1、0.2、0.4、0.6、0.8、1.0ml,置于 25ml量瓶中,加Folin-Ciocalteau试液1.0ml,超纯水 10ml,用 7.5%Na2CO3溶液稀释至刻度,摇匀,室温放置2 h,以空白试液为参照,在763nm波长处测定吸光度。以对照品进样量(x,mg)为横坐标,吸光度(y)为纵坐标,绘制标准曲线,得原儿茶酸的回归方程为 y=4.49x+0.0727(r=0.9991),表明原儿茶酸进样量在0.0193~0.193mg范围内与吸光度线性关系良好。
2.2.5 精密度试验 精密移取对照品溶液1.0ml,按上述方法测量吸光度,平行6次。结果,吸光度的RSD为0.45%,表明仪器精密度良好。
2.2.6 稳定性试验 精密移取供试品(编号3)溶液1.0ml,按上述方法操作,显色后分别于放置0、2、3、3.5、4 h时测定。结果,吸光度的RSD为0.89%,表明供试品溶液在4 h内稳定。
2.2.7 重复性试验 取同一木瓜供试品(编号3)0.1 g,按“2.2.2”项下方法制备供试品溶液,再按上述方法操作,平行测定6次,计算总酚含量。结果,RSD为1.50%,表明本方法重复性较好。
2.2.8 加样回收率试验 取同一批已知含量的木瓜供试品(编号3)约50mg,精密称定,准确加入适量原儿茶酸对照品,按“2.2.2”项下方法制备供试品溶液,再按上述方法操作,计算加样回收率,结果详见表3。
2.2.9 总酚含量测定 取木瓜供试品,按“2.2.2”项下方法制备供试品溶液;精密移取续滤液1.0ml,置于25ml量瓶中,加Folin-Ciocalteau试液1.0ml,超纯水 10ml,用 7.5%Na2CO3溶液稀释至刻度,摇匀,室温放置2 h,以空白试液为参照,在763nm处测定吸光度,按标准曲线法计算供试品中总酚含量。
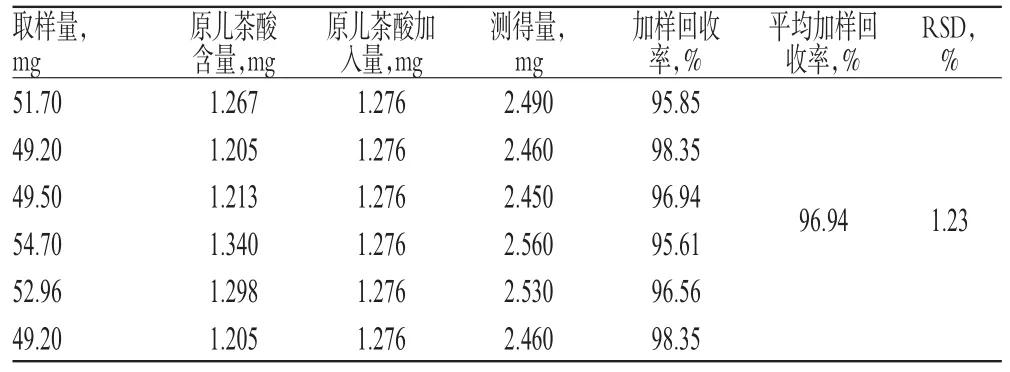
表3 总酚的加样回收率试验结果(n=6)Tab 3 Result of recovery test of total phenolics(n=6)
2.3 不同产地木瓜中总酚、绿原酸和原儿茶酸的含量测定结果
取不同产地木瓜供试品各适量,按“2.1.10”项下方法测定原儿茶酸和绿原酸含量,再按“2.2.9”项下方法测定总酚含量,结果详见表4。
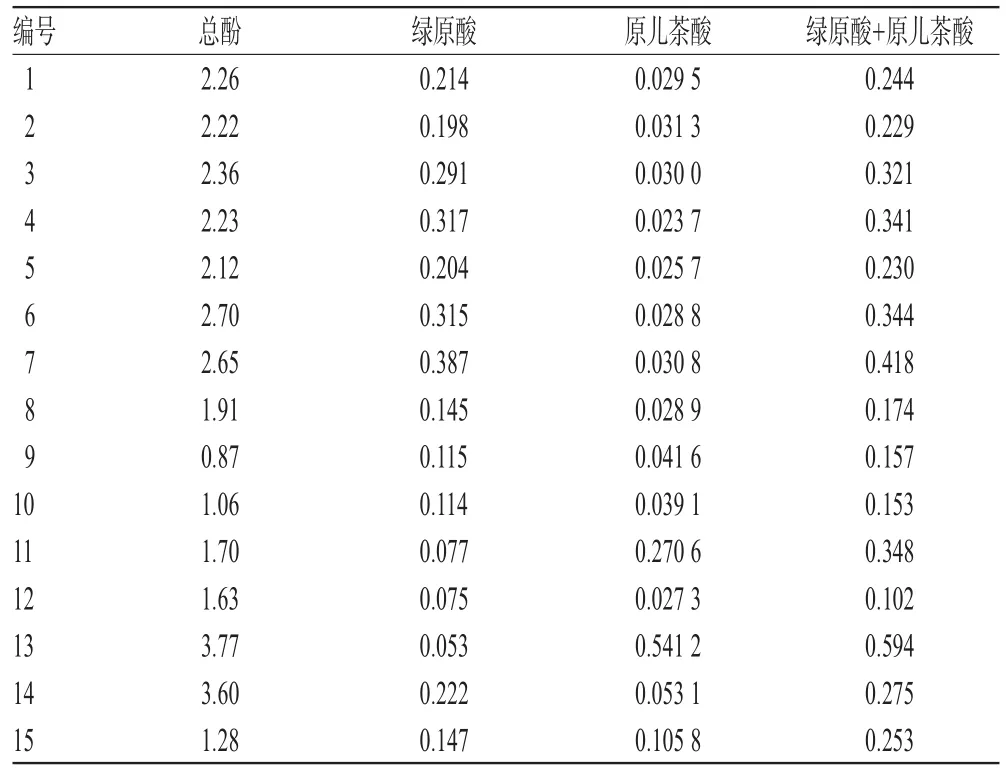
表4 不同产地木瓜中总酚、绿原酸和原儿茶酸的含量测定结果(n=2,%)Tab 4 Mass fractions of total phenolics,chlorogenic acid and protocatechuic acid in C.sinensis from different areas(n=2,%)
3 讨论
绿原酸和原儿茶酸属于酚酸类化合物,分子结构中都同时存在多酚和羧酸官能团,是目前发现的木瓜多酚的主要成分。李霞等[10]采用梯度洗脱分离和254nm检测分析木瓜中绿原酸和原儿茶酸的含量。本法在等度洗脱的条件下,通过波长切换在绿原酸和原儿茶酸各自最大吸收波长处检测,提高了分析效率和检测灵敏度。预试验中对流动相组成(甲醇、乙腈、磷酸溶液及其体积比)、流速和柱温等进行考察,最终确定为本研究中所用的分离条件。
总酚的含量测定常用Folin-Ciocalteau比色法[11]和三氯化铁-铁氰化钾比色法[12]。前期试验对两种方法进行了考察,发现在木瓜的总酚的含量测定中,后者显色后吸光度稳定时间较短,方法学考察项目的RSD较前者稍难以控制,故采用了Folin-Ciocalteau比色法。依据2010年版《中国药典》(一部)附录收载方法[1]并进行优化,对不同提取溶剂(10%、30%、50%、70%甲醇)进行了提取试验,对不同超声提取时间(10、30、60min)进行了试验,以及对Folin-Ciocalteau试液加入量、显色后暗处放置时间和Na2CO3溶液体积分数进行试验,最终确定了本研究中木瓜总酚的最佳测量条件。
木瓜具有舒筋活络、和胃化湿的功效,但目前对其功效的物质基础还不甚明了。本课题组基于对中药物质基础“具有三个层次多维结构”[13]的认识,对宣木瓜组分进行较为系统的分析检测,已开展宣木瓜总三萜和单体成分齐墩果酸熊果酸[14]、宣木瓜总有机酸和单体有机酸、宣木瓜总多糖和单体多糖的含量分析研究。从本研究结果看,不同产地木瓜均含有总酚、绿原酸和原儿茶酸;总酚质量分数为0.87%~3.77%,平均值2.16%;绿原酸质量分数为0.053%~0.387%,平均值0.192%;原儿茶酸质量分数为0.024%~0.541%,平均值0.087%;不同产地总酚含量高低顺序为:云南木瓜>宣木瓜>川木瓜>湖北木瓜;绿原酸和原儿茶酸总量的产地高低顺序与总酚相同。Pearson相关系数为0.719(P<0.01),表明总酚含量与绿原酸和原儿茶酸总量之间存在一定正相关性。在对绿原酸与原儿茶酸含量比例分析中发现,所测样品中宣木瓜均处于较高的比值水平,且绿原酸和原儿茶酸总量占总酚含量比例也处于较高值,数值相对稳定,这一现象是否附有产地特征尚需进一步研究。
综上所述,本文所建方法简便、准确、重复性好,可综合用于木瓜的质量分析。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:57、附录62.
[2]尹凯,高慧媛,李行诺,等.皱皮木瓜的化学成分[J].沈阳药科大学学报,2006,23(12):760.
[3]陶君彦,张晓昱,黄志军,等.HPLC法同时测定木瓜中绿原酸、咖啡酸的含量[J].中国药房,2007,18(12):912.
[4]刘捷,王文,卢奎,等.皱皮木瓜多糖的提取及其抗氧化活性研究[J].河南工业大学学报:自然科学版,2011,32(1):48.
[5]Okuda T,Kimura Y,Yoshida T,et al.Studies on the activities of tannins and related compounds from medicinal plants and drugs.Inhibitory effects on lipid peroxidation in mitochondria and microsomes of liver[J].Chem Pharm Bull(Tokyo),1983,31(5):1625.
[6]Reiss R,Johnston J,Tucker K,et al.Estimation of cancer risks and benefits associated with a potential increased consumption of fruits and vegetables[J].Food Chem Toxicol,2012,50(12):4421.
[7]Ferrazzano GF,Amato I,Ingenito A,et al.Plant polyphenols and their anti-cariogenic properties:a review[J].Molecules,2011,16(2):1486.
[8]Uysal U,Seremet S,Lamping JW,et al.Consumption of polyphenol plants may slow aging and associated diseases[J].Curr Pharm Des,2013,19(34):6094.
[9]鲁玉妙,马惠玲.植物多酚SCI文献计量及生物活性研究热点分析[J].食品科学,2013,34(23):375.
[10]李霞,杨颖博,李君丽,等.HPLC法同时测定皱皮木瓜中原儿茶酸和绿原酸的含量[J].中国医药导报,2012,9(34):110.
[11]Padda MS,Picha DH.Methodology optimization for quantification of total phenolics and individual phenolic acids in Sweetpotato(Ipomoea batatas L.)roots[J].J Food Sci,2007,72(7):412.
[12]徐佳佳,陆兔林,王云峰,等.不同产地通关藤饮片中绿原酸及总酚酸的含量比较[J].中国药业,2008,17(23):21.
[13]贾晓斌,陈彦,李霞,等.中药复方物质基础研究新思路和方法[J].中华中医药杂志,2008,23(5):420.
[14]杨沫,吴茜,程菁菁,等.宣木瓜总三萜、齐墩果酸和熊果酸的含量测定[J].安徽中医学院学报,2013,32(4):83.
