131株耐多药结核分枝杆菌对利福布丁与利福平交叉耐药的研究
2015-05-20沈静赵雁林逄宇张舜杜昌廷刘洁
沈静 赵雁林 逄宇 张舜 杜昌廷 刘洁
·论著·
131株耐多药结核分枝杆菌对利福布丁与利福平交叉耐药的研究
沈静 赵雁林 逄宇 张舜 杜昌廷 刘洁
目的 观察利福布丁对MDR-TB菌株的抑菌效力及其与利福平的交叉耐药性,了解对利福布丁与利福平交叉耐药菌株rpoB基因突变特征。 方法 采用间隔抽样法,从2007—2008年全国结核病耐药基线调查的401株MDR-TB菌株中抽样,传代后获得131株MDR-TB菌株。用微孔板Alamar blue法测定利福平和利福布丁对MDR-TB菌株的最低抑菌浓度(MIC),采用直接测序法检测MDR-TB菌株rpoB基因突变,分析rpoB基因突变对两者交叉耐药性的影响。采用SPSS 11.0软件进行统计分析,交叉耐药率比较采用χ2检验,P<0.05为差异有统计学意义。结果 在131株MDR-TB菌株中,利福平MIC中位数值为256 μg/ml,利福布丁MIC中位数值为2 μg/ml。通过测定MIC的方法,利福平与利福布丁交叉耐药率为76.47%(91/119)。在MDR-TB菌株中,发生rpoB基因突变113株(86.26%,113/131),包括531、526、516、513、511、522、533等7种单位点突变,其中以密码子531(56.50%,74/131)、526(16.03%,21/131)突变最为常见。不同rpoB基因突变的MDR-TB菌株,526、531位点突变出现利福平与利福布丁交叉耐药的比例最高,分别占90.48%(19/21)、78.38%(58/74),与无突变组(44.44%,8/18)比较,差异均有统计学意义(χ2值分别为9.641、8.223,P值均<0.05)。 结论 利福布丁与利福平存在交叉耐药性,但利福布丁有更强的抑菌能力。MDR-TB菌株不同rpoB突变类型,利福平与利福布丁交叉耐药性不同。
结核分枝杆菌; 抗药性, 多种, 细菌; 利福布丁; 利福平; 微生物敏感性试验; 细菌蛋白质类
我国耐药结核病疫情严重,MDR-TB已成为结核病控制中亟待解决的问题。根据2007—2008年全国结核病耐药基线调查报告显示:我国涂阳肺结核耐多药率为8.32%,其中初治耐多药率5.71%,复治耐多药率25.64%,据此估算,我国每年新发耐多药肺结核患者约12万例[1]。
利福平是主要的抗结核药物之一。rpoB基因突变的结核分枝杆菌常会对利福平耐药,该基因利福平耐药决定区(rifampin resistance-determining region, RRDR)不同位点突变的菌株最低抑菌浓度(minimum inhibitory concentration,MIC)存在较大差别[2-5]。利福布丁是利福霉素类新药,其作用机制与利福平一样;与利福平相比较,利福布丁诱导细胞色素P-450CYP3A异构酶可能性较低[6],胃肠吸收少,大部分随血液分布至全身各部位。利福布丁与利福平存在交叉耐药性。为此本研究通过测定利福平、利福布丁对MDR-TB菌株的MIC,对两药的抑菌效力进行比较;并根据MDR-TB菌株rpoB基因测序结果,对利福布丁与利福平交叉耐药进行分析。
材料和方法
一、材料和试剂
1. 菌株来源:从2007—2008年全国结核病耐药基线调查菌株库401株MDR-TB菌株中采用间隔抽样法,间隔抽取134株。具体抽样方法为:MDR-TB菌株按编号递增顺序排序,随机选择其中的一株,向后间隔2个编号抽取菌株,抽到编号尾部再接着从编号前部按序间隔2个编号抽取。抽取菌株经转种,其中3株污染,转种后得到131株MDR-TB菌株。MDR-TB菌株的筛选采用传统固体药敏试验比例法。
2. 试剂:采用美国BD公司生产的7H9干粉、OADC营养添加剂,配制为含10%OADC营养添加剂的7H9液体培养基;采用美国Sigma公司生产的利福布丁和利福平药粉,分别配制浓度为640 μg/ml、5120 μg/ml,-80 ℃保存备用。使用北京康为世纪生物科技有限公司的2×Taq Master Mix,扩增引物由北京天一辉远生物科技有限公司合成。
二、实验室检查方法
1. MDR-TB菌株的筛选[传统固体药物敏感性试验(简称“药敏试验”)比例法]:含药培养基药物浓度为异烟肼0.2 μg/ml、利福平40 μg/ml、乙胺丁醇2 μg/ml、链霉素4 μg/ml、卡那霉素30 μg/ml、氧氟沙星2 μg/ml[7]。
2. MDR-TB菌株对利福布丁和利福平MIC检测:采用微孔板Alamar blue法,7H9液体培养基,操作步骤参照文献[8]。利福平MIC浓度梯度设置为:0.5、1、2、4、8、16、32、64、128、256、512 μg/ml,利福布丁浓度梯度设置为:0.0625、0.125、0.25、0.5、1、2、4、8、16、32、64 μg/ml。耐药临界浓度根据预实验并参照文献[9]的标准设置:利福布丁为0.5 μg/ml,利福平为1 μg/ml。
3. MDR-TB菌株rpoB基因测序:采用序列为5′-ACCGACGACATCGACCACTT-3′F和5′-GTACGGCGTTTCGATGAACC-3′R的2条引物扩增rpoB基因,扩增产物大小为450 bp,含81 bp的RRDR区。扩增体系(50 μl):25 μl 2×Taq Master Mix,引物各1 μl、4 μl DNA样品及19 μl H2O。反应条件:94 ℃ 5 min;94 ℃ 1 min,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。PCR产物送北京擎科新业生物技术有限公司用ABI3730测序仪进行测序。测序结果使用BioEdit软件与标准敏感株H37Rv(标准菌株由国家结核病参比实验室提供)基因序列进行比对。
三、质量控制
检测H37Rv菌株MIC作为药物质量的控制。对MIC法药物耐药表型与基因突变结果不符的菌株,则重复测定MIC。
四、统计学分析
所有资料录入Excel建立数据库,采用SPSS 11.0软件进行分析。利福平与利福布丁MIC比较采用相关样本Wilcoxon带符号秩和检验,P<0.05为差异有统计学意义;rpoB基因不同突变位点交叉耐药频率的比较采用R×2表χ2检验,P<0.05为差异有统计学意义,如果组间总的差异有统计学意义,再进一步做两两比较。
结 果
一、利福布丁、利福平对MDR-TB菌株的MIC值及交叉耐药情况
微信小程序[1-6]是一种不需要下载安装即可使用的应用,它实现了应用“触手可及”的梦想,用户扫一扫或者搜一下即可打开应用。也体现了“用完即走”的理念,用户不用关心是否安装太多应用的问题。应用将无处不在,随时可用,但又无需安装卸载。对于开发者而言,小程序开发门槛相对较低,难度不及APP,能够满足简单的基础应用,适合生活服务类线下商铺以及非刚需低频应用的转换。小程序能够实现消息通知、线下扫码、公众号关联等七大功能。其中,由于小程序不存在入口,通过公众号关联,用户可以实现公众号与小程序之间相互跳转。
利福平对MDR-TB菌株的MIC中位数值为256 μg/ml,利福布丁的MIC中位数值为2 μg/ml,利福布丁与利福平两药的MIC梯度分布不同,差异有统计学意义(Z=-9.886,P<0.05);参照耐药临界浓度,131株MDR-TB菌株对利福平敏感12株,耐药119株,对利福布丁敏感40株,耐药91株。在119株耐利福平菌株中,有91株对利福布丁耐药,利福布丁与利福平的交叉耐药率为76.47%(91/119)(表1,2)。
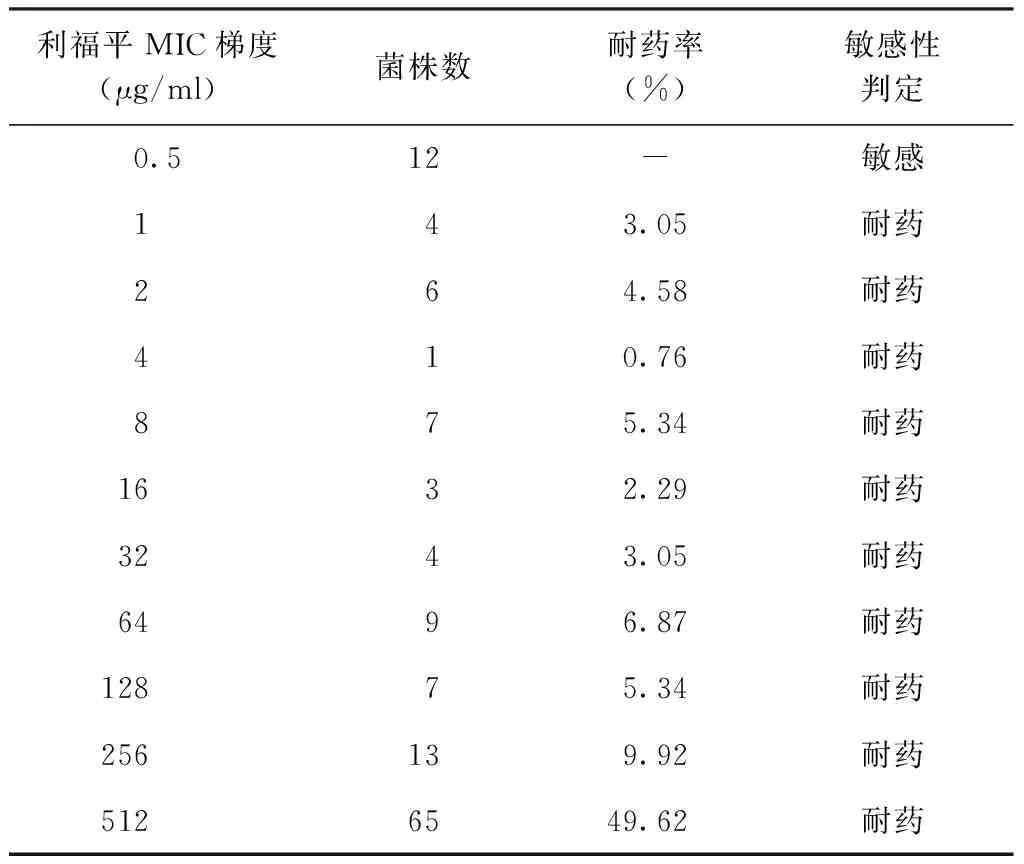
表1 不同利福平MIC梯度下131株MDR-TB菌株耐药情况统计
注 -:因药敏试验结果为敏感,此处无意义

表2 不同利福布丁MIC梯度下131株MDR-TB菌株耐药情况统计
注 -:因药敏试验结果为敏感,此处无意义
二、MDR-TB菌株rpoB基因测序结果
119株利福平耐药株中,有103株rpoB基因发生突变(占86.55%,103/119);在所有131株MDR-TB菌株中,共有113株rpoB基因发生突变,突变率86.26%(113/131),其中单位点突变110株(83.97%,110/131),包括7种位点,按突变率递减顺序排列依次为531、526、516、511和522(并列)、513和533(并列),其中以密码子531、526、516突变最为常见,两位点联合突变3株(2.29%,3/131)(表3)。

表3 131株MDR-TB菌株的rpoB基因测序结果
注 -:因rpoB基因测序无突变,此处无意义
三、MDR-TB菌株不同rpoB基因突变类型对利福布丁和利福平MIC的影响
统计不同MDR-TB菌株rpoB基因突变类型菌株对利福布丁和利福平的敏感性情况(表4),Ser531Leu、Ser531Phe、His526Tyr、His526Asp、His526Asn、His526Arg、His526Leu利福平与利福布丁交叉耐药的株数最多,共77株(占突变68.14%,77/113)。表5显示,MDR-TB菌株不同rpoB基因位点突变,出现利福平与利福布丁的交叉耐药的比例也不同,差异有统计学意义(χ2=23.344,P<0.05)。531、526位点突变利福平与利福布丁交叉耐药率最高,分别为48.74%(58/119)、15.97%(19/119),在同类型突变菌株中出现交叉耐药的比例也是最高的,分别为78.38%(58/74)、90.48%(19/21)。18株MDR-TB菌株rpoB基因未突变,其中16株对利福平耐药,8株对利福布丁耐药。
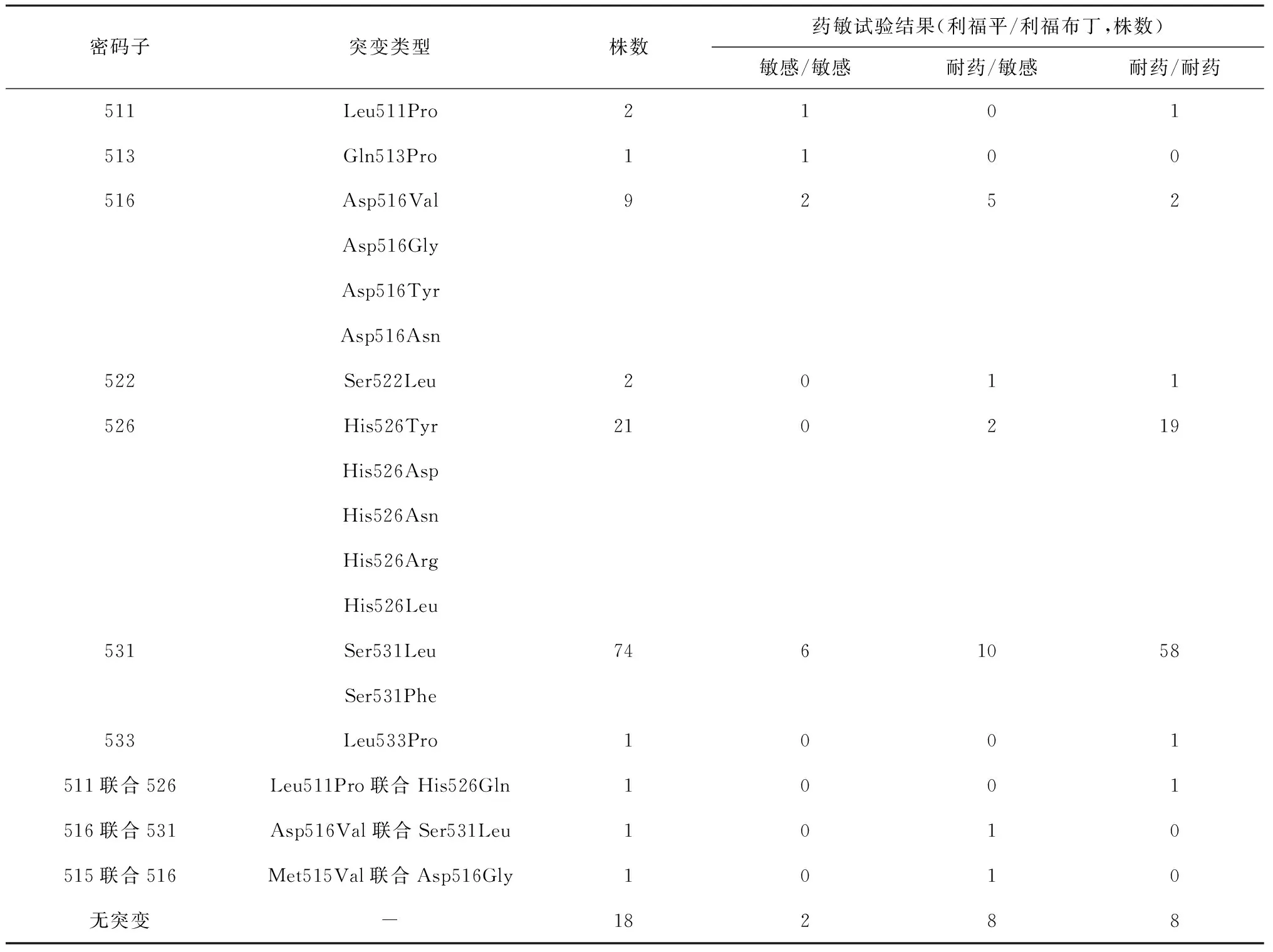
表4 131株MDR-TB菌株不同rpoB基因突变类型对利福布丁和利福平的药敏试验结果
注 -:因rpoB基因测序无突变,此处无意义

表5 131株MDR-TB菌株不同rpoB基因突变类型对利福布丁和利福平的交叉耐药情况
注 交叉耐药率=交叉耐药株数/利福平耐药总株数(119株)×100%;比率=某类型交叉耐药株数/某类型株数×100%;a:比率与无突变组比较,χ2值分别为8.223、9.641,P值均<0.05,差异有统计学意义;b:比率与无突变组比较,Fisher确切概率法,P值均>0.05,差异无统计学意义
讨 论
一、利福布丁与利福平对MDR-TB菌株的MIC
利福布丁是一种新的半合成药物,为利福霉素类的衍生物之一,与利福平之间存在交叉耐药性,近年来国内外已有许多关于利福布丁与利福平交叉耐药性的研究和报道,不同的报道之间可能由于选例地区、流行株遗传背景、样本量等差异,两药交叉耐药率差别较大。本研究结果显示所有对利福平敏感的菌株,对利福布丁也是敏感的,MDR-TB菌株对利福平与利福布丁两药间存在交叉耐药性(交叉耐药率76.47%),与韩喜琴等[9]报道的72.5%接近,但低于高丽等[10]报道的85.9%。
利福平与利福布丁对MDR-TB菌株的MIC梯度分布显示,利福布丁有较强的抑菌能力,对耐利福平尤其是MDR-TB患者,在进行利福布丁药敏试验基础上,可酌情使用利福布丁。
二、不同rpoB基因突变的MDR-TB菌株耐药情况
在所有检测到rpoB基因突变的MDR-TB菌株中,531、526位点突变率总和72.52% (95/131),这2个位点的突变率最高,这与梁庆福等[11]报道的福建地区75例MDR-TB菌株531、526位点突变率总和72.1%几乎相同,但苏雯婕等[12]报道的广东地区95例MDR-TB菌株rpoB基因2种位点以上基因突变率更高,达83.91%。531、526位点突变率总和与后者有较大差异,这可能是由于研究地域不同、样本量不同,并且本研究样本是来自全国性的菌株库,菌株来自全国各耐药监测哨点,具有广泛的代表性。
在检测到rpoB基因突变的MDR-TB菌株中,531、526位点突变株数最多,在同类型突变菌株中出现交叉耐药的比例也是最高的。结核分枝杆菌rpoB基因526、531位点突变,强烈提示对利福平耐药,并且对利福平与利福布丁交叉耐药的可能性较大,不建议使用利福布丁;而516位点突变,对利福平与利福布丁交叉耐药的可能性较小[13-14]。
rpoB基因未突变的MDR-TB菌株中,部分利福平的MIC微孔板Alamar blue法结果为耐药,这可能是因为本研究扩增产物大小为450 bp,含81 bp的RRDR区(密码子507-533),测序主要能检出RRDR区突变,RRDR以外两侧区域的突变不能完全检出。并且结核分枝杆菌耐药不仅与耐药相关基因突变有关,还与其药物外排泵的作用机制有关。大量研究结果表明,结核分枝杆菌对利福霉素类药物的耐药与rpoB基因突变有关,近年来也有文献报道在rpoB未突变的单耐利福平的结核分枝杆菌中,Rv2936和Rv0783可能是与利福平耐药相关的药物外排泵基因[15]。下一步工作,可以对直接测序未检出rpoB基因突变的18例MDR-TB菌株进行全基因测序,了解其RRDR以外两侧区域的突变情况[16]。全基因测序后对rpoB基因未突变株进一步做利福平耐药相关的药物外排泵基因的检测,再结合药物MIC结果进行交叉耐药性的分析。
三、MIC法与传统药敏试验比例法比较
关于受试菌株药敏试验结果的差异,通过测定MIC的方法,在131株MDR-TB菌株中有12株对利福平敏感,与传统的药敏试验结果存在差异。这是由于研究对象(131株MDR-TB菌株)均采用传统固体药敏试验比例法进行筛选,其含药培养基药物浓度为利福平40 μg/ml,判定标准为药物培养基生长菌落数/对照培养基生长菌落数≥1%则判定耐药[8]。Kim[17]报道结核分枝杆菌传统药敏试验存在与临床表型不一致的情况,在众多抗结核药物中,对利福平的药敏试验结果是最可靠的,即使这样对利福平的传统比例法药敏试验也只能区分85.6%对利福平可能敏感的菌株(来自从未使用抗结核药物的患者)和可能耐药的菌株(来自按规程抗结核治疗失败的患者)。本研究使用测定MIC的方法,利福平MIC≥临界浓度(1 μg/ml)则判定为耐药,存在2种方法判定标准不一、药物含量不同、使用培养基不同(固体与液体介质分子通量不同)、培养时间不同等差异。这可能是造成本研究中这12株菌株出现对利福平药敏试验结果差异的原因。
MIC微孔板Alamar blue法较传统固体药敏试验方法用时短,一般7~14 d可判读结果,不需要任何仪器,较采用全自动培养仪(如Bactec MGIT 960、BacT/Alert 3D)价格便宜,更有利于患者的诊断和治疗。微孔板Alamar blue法测定MIC所用试剂都是自行配置,暂无成品化试剂,因此不同的操作时间、不同的试剂配置批次(尤其是药物配置批次)、操作熟练度等因素对结果会出现一定影响。如果通过多中心大规模的实验验证微孔板Alamar blue法,通过评估后,可确立其为快速药敏试验方法。
四、本研究的不足
MDR-TB菌株的传统药敏试验是由国家结核病参比实验室在2007—2008年完成和复核的,本研究对其中抽取的131株进行了微孔板Alamar blue法测定。微孔板Alamar blue法不是传统的方法,部分试剂需自行配置,不同的时间、地点和操作者所获得结果可能会出现差异,因此应对关键性的检测条件、耐药临界值进行研究,本研究对以上方面的研究较少。
本研究中2种方法药敏试验结果不符的菌株虽然进行了MIC的复核,但未采用第3种标准方法对药敏试验结果再进行客观评价。并且结核分枝杆菌耐药不仅与耐药相关基因突变有关,还与其药物外排泵的作用机制有关,本研究中菌株全部为MDR-TB菌株,较普通菌株其各种耐药风险更高,但是本研究主要着眼于不同的MDR-TB菌株rpoB基因突变类型对交叉耐药性的影响,没有对其他耐药机制进行探讨,可能存在耐药表型和耐药基因突变不符的情况。
[1] 中华人民共和国卫生部. 全国结核病耐药性基线调查报告(2007—2008年). 北京:人民卫生出版社,2010.
[2] Williams DL, Waguespack C, Eisenach K, et al. Characterization of rifampin-resistance in pathogenic mycobacteria. Antimicrob Agents Chemother, 1994, 38(10): 2380-2386.
[3] Chaves F, Alonso-Sanz M, Rebollo MJ, et al.rpoBmutations as an epidemiologic marker in rifampin-resistantMycobacteriumtuberculosis. Int J Tuberc Lung Dis, 2000, 4(8): 765-770.
[4] 黄海荣,金奇,马玙,等. 中国耐利福平结核分枝杆菌rpoB基因突变特点. 中华结核和呼吸杂志,2001,24(4):231-235.
[5] Williams DL, Spring L, Collins L, et al. Contribution ofrpoBmutations to development of rifamycin cross-resistance inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 1998, 42(7):1853-1857.
[6] Burman WJ, Gallicano K, Peloquin C. Comparative pharmacokinetics and pharmacodynamics of the rifamycin antibacterials. Clin Pharmacokinet, 2001, 40(5):327-341.
[7] 赵雁林.结核病实验室诊断技术培训教程.北京:人民卫生出版社,2014.
[8] Leonard B, Coronel J, Siedner M, et al. Inter- and intra-assay reproducibility of microplate Alamar blue assay results for isoniazid, rifampicin, ethambutol, streptomycin, ciprofloxacin, and capreomycin drug susceptibility testing ofMycobacteriumtuberculosis. J Clin Microbiol, 2008, 46(10): 3526-3529.
[9] 韩喜琴,黄海荣,李艳静,等. 利福平和利福布丁对结核分枝杆菌交叉耐药率的初步探讨. 中国防痨杂志,2010,32(11):740-743.
[10] 高丽,肖和平,胡忠义,等. 耐多药结核分枝杆菌对利福布丁和利福平的交叉耐药性分析. 中华结核和呼吸杂志,2012,35(5):333-335.
[11] 梁庆福,陈求扬,林淑芳,等.福建省耐多药结核分枝杆菌利福平耐药rpoB基因突变特征.中国卫生检疫杂志,23(7):1649-1651.
[12] 苏雯婕,苏政军,孟繁荣,等.95例耐多药结核菌株rpoB基因突变的分子特征.实用医学杂志,2012,28(14):2333-2335.
[13] Schön T, Juréen P, Chryssanthou E, et al. Rifampicin-resis-tant and rifabutin-susceptibleMycobacteriumtuberculosisstrains: a breakpoint artefact? J Antimicrob Chemother, 2013, 68(9):2074-2077.
[14] Chikamtsu K, Mizuno K, Yamada H, et al. Cross-resistance between rifampicin and rifabutin among multi-drug resistantMycobacteriumtuberculosisstrains. Kekkaku, 2009, 84(9):631-633.
[15] Pang Y, Lu J, Wang Y, et al. Study of the rifampin monoresistance mechanism inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2013, 57(2): 893-900.
[16] 胡族琼,谭耀驹,罗春明,等. 广东地区结核分枝杆菌利福布丁耐药株rpoB全基因序列突变特征. 中国人兽共患病学报,2011,27(11):980-982.
[17] Kim SJ. Drug-susceptibility testing in tuberculosis: methods and reliability of results. Eur Respir J, 2005, 25(3):564-569.
(本文编辑:郭萌)
Investigation of cross-resistance between rifampin and rifabutin in multidrug-resistantM.tuberculosisstrains
SHENJing*,ZHAOYan-lin,PANGYu,ZHANGShun,DUChang-ting,LIUJie.
*TuberculosisReferenceLaboratory,ChongqingInstitutionofTuberculosisControlandPrevention,Chongqing400050,China
ZHANGShun,Email:ZS52077@sina.com
Objective To investigate the antibacterial effect of rifabutin and the cross-resistance between rifabutin and rifampin in multidrug-resistantMycobacteriumtuberculosis(MDR-TB)strains, to understand the mutation characteristics ofrpoBgene among the strains with rifampin and rifabutin cross-resistance. Methods Using interval sampling method, 131 MDR-TB clinical strains were obtained from 401 MDR-TB isolates of National Drug Resistance Tuberculosis Baseline Survey in 2007—2008. Minimum inhibitory concentrations (MICs) of rifampin and rifabutin for these MDR-TB isolates were determined by microplate Alamar blue assay method.The mutations ofrpoBgene were determined by DNA sequencing, and analyzed the effect of therpoBgene mutations on rifabutin and rifampin cross resistance. Using SPSS 11.0 statistical analysis software, the cross-resistance was compared with Chi-square test. The difference was considered as statistical significance whenP<0.05. Results Of 131 MDR-TB strains, the median of rifampin MICs was 256 μg/ml, and the median of rifabutin MICs was 2 μg/ml. The cross resistant rate between rifampin and rifabutin was 76.47%(91/119). In addition, 113 isolates(86.26%, 113/131) harboredrpoBmutations, in which there were 7 types of single mutations, including codon 531, 526, 516, 513, 511, 522, and 533, codon 531(56.50%, 74/131) and codon 526(16.03%, 21/131) were the most frequently observed. Besides, the mutations at codon 526 and 531 were associated with cross-resistance between rifampin and rifabutin, their cross-resistance rates were 90.48%(19/21) and 78.38%(58/74) respectively, which had no statistically significant difference(χ2were 9.641 and 8.223,P<0.05). Conclusion Rifabutin has cross-resistance with rifampin, but rifabutin showed better antimicrobial ability. TheM.tuberculosisisolates with differentrpoBmutations showed different cross-resistance between rifabutin and rifampin.
Mycobacteriumtuberculosis; Drug resistance, multiple, bacterial; Rifabutin; Rifampin; Microbial sensitivity tests; Bacterial proteins
10.3969/j.issn.1000-6621.2015.04.010
400050 重庆市结核病防治所 结核病参比实验室(沈静、张舜、杜昌廷、刘洁);中国疾病预防控制中心国家结核病参比实验室(赵雁林、逄宇)
张舜,Email:ZS52077@sina.com
2014-06-23)
