色氨酸-犬尿氨酸代谢中间产物对结核病患者T细胞免疫的影响
2015-05-20张荧朱慧梁倩赵立平黄海荣黄娟孙照刚
张荧 朱慧 梁倩 赵立平 黄海荣 黄娟 孙照刚
·论著·
色氨酸-犬尿氨酸代谢中间产物对结核病患者T细胞免疫的影响
张荧 朱慧 梁倩 赵立平 黄海荣 黄娟 孙照刚
结核/免疫学; T淋巴细胞亚群; 色氨酸; 犬尿氨酸
色氨酸(TRP)是人体必需氨基酸。TRP-犬尿氨酸(KYN)代谢途径会因为某些疾病的发生而改变,从而影响机体免疫作用的发挥。机体免疫状态是决定结核病发生、发展和转归的决定性因素,而TRP代谢中间产物,如KYN、喹啉酸(QA)、吡啶酸(PA)、邻氨基苯甲酸(AA)等,对机体的免疫系统产生全面而又深远的影响,如细胞分化、细胞凋亡和炎性反应等[1-2]。因此,研究TRP-KYN代谢途径有助于阐明结核分枝杆菌感染与发病的生物学机制。本研究在明确结核病患者体内TRP-KYN代谢中间产物含量的基础上[3],进一步通过体外试验分析代谢中间产物对免疫细胞凋亡和分化的影响。
材料和方法
一、研究对象
试验组来源于我院2012年9—12月期间经细菌学、病理学和影像学检查明确诊断为肺结核且无肿瘤、艾滋病、糖尿病等合并疾病的结核病患者,共104例;其中男76例,女28例;经数字表法随机抽样选取45例作为试验组,年龄20~65岁,平均(47.32±14.13)岁。所有患者HIV检测均为阴性,均无免疫抑制剂和免疫增强剂使用史。健康对照组为同期北京市昌平区结核病防治所的健康体检志愿者,经细菌学、病理学和影像学检查明确无结核病,且无结核病病史,无慢性病病史,无呼吸疾病,共100名;其中男63名,女37名;经数字表法随机选取其中39例作为健康对照组,年龄16~60岁,平均(39±18.62)岁。本研究经首都医科大学附属北京胸科医院伦理委员会审核并通过[批件号:(2012)年KY临审第(11)号],征得受试对象同意,签署了知情同意书。
二、试验仪器和试剂
血细胞的流式细胞分析主要采用美国BD公司FACSCalibur型流式细胞仪。除细胞凋亡试剂盒购自美国BioVision公司外,其余所用荧光标记抗体、含抗凝剂的采血管和淋巴细胞分离液均购自美国BD公司。
三、试验方法
1. 全血中人淋巴细胞的分离、抗体染色与流式分析:用抗凝采血管取5 ml全血后,采用人淋巴细胞分离液分离外周血单核淋巴细胞(PBMCs);调整细胞浓度为5×106个/ml,用于调节性T细胞(Treg)和T辅助细胞17(Th17)及代谢中间产物的刺激试验。Th17和Treg细胞的染色参考文献[4]的方法。BD公司FACSCalibur型流式细胞仪进行检测,结果用WinMDI 2.9软件分析。本试验以CD4+IL-17A+标记Th17细胞,以CD4+CDhigh 25FoxP3+标记Treg细胞,并设立空白对照(未染色)、FITC单色对照、PE单色对照、APC单色对照、Alexa Flour647单色对照、Alexa Flour647-IgG同型对照、PE-IgG同型对照,以便进行荧光标记效果的质量控制。上述荧光标记抗体均购自BD公司。
2. TRP及其代谢中间产物对CD4+T淋巴细胞和CD8+T淋巴细胞的体外刺激:住院次日凌晨空腹抽静脉血5 ml,肝素抗凝,用标准的Ficoll-Hypaque密度梯度离心方法分离得到PBMCs,经磷酸盐缓冲液洗涤后,用含10%胎牛血清(FBS)的杜尔伯科极限必需培养基(DMEM)培养液调整细胞浓度为1×106个/ml,并以每孔500 μl接种细胞于24孔培养板,培养24 h;试验组分别单独加入TRP、KYN、QA 3种化合物,终浓度分别为0.2 mmol/L和2 mmol/L,每种化合物的每个浓度分别设立3个重复试验;空白对照加入同体积的DMEM培养基,共培养24 h。之后进行细胞的染色和流式分析。本实验采用随机数字表法选取其中的6例患者作为试验组进行了PBMCs的分离和化合物体外刺激实验。其中5例患者获得的5 ml全血分离的PBMCs数量达到107左右,而且流式细胞分析方法的染色效果符合流式标准,满足本研究需要;另外1例因PBMCs总数不足而未满足实验要求。试验组是化合物刺激组,空白组未加化合物刺激。
3. 细胞凋亡的检测:采用Annexin V-FITC Apoptosis Detection Kit试剂盒(美国BioVision公司)进行细胞凋亡的染色分析。按试剂盒说明书进行检测及结果判定。
四、统计学分析
结 果
一、 外周血Treg细胞和Th17细胞与年龄、性别的相关性分析
健康对照组和试验组的组间性别构成经卡方检验(χ2=0.163,P=0.330),结果显示差异无统计学意义;采用方差检验分析两组之间平均年龄(t=2.001,P=0.152),差异无统计学意义。多因素相关性分析的结果显示,本研究所测定Treg细胞和Th17细胞与性别、年龄两因素并无相关性(表1)。因此,组间性别、年龄因素差异对试验结果不造成偏倚影响。
二、试验组和健康对照组外周血Treg细胞和Th17细胞水平的比较
试验组PBMCs中Treg细胞占CD4+T细胞的比率为(1.49±0.82)%,健康对照组为(0.41±0.26)%,两组间相比较,试验组外周血中Treg细胞含量显著高于健康对照组(t=33.64,P=0.000);试验组外周血PBMCs中Th17细胞占CD4+T细胞的比率为(1.04±0.72)%,而健康对照组的Th17细胞占CD4+T细胞的比率为(0.73±0.43)%(图1,2),两者之间差异无统计学意义(t=44.46,P=0.071)(表2)。

表1 入组人群年龄、性别与外周血中Treg细胞和Th17细胞的相关性分析

表2 试验组外周血和健康对照组外周血Treg细胞和Th17细胞水平
Treg细胞具有免疫抑制的功能,而Th17细胞分泌细胞因子IL-17是促进炎症反应的细胞,研究两者的比例在结核病免疫学中具有潜在意义。本研究中试验组外周血PBMCs中Treg细胞和Th17细胞的比值为2.39±2.241,健康对照组的比值为0.77±0.767,两者比较差异有统计学意义(t=34.25,P=0.001)。
三、TRP、KYN和QA对T细胞的影响
结核病患者体内TRP、KYN和QA的含量显著增加提示:TRP及其代谢中间产物可能会对免疫细胞的含量产生影响,从而影响机体的免疫平衡状态;为此笔者在体外条件下对CD4+T和CD8+T细胞用这3种化合物进行了体外刺激试验。空白对照组表示未加化合物刺激。
1. TRP、KYN和QA对CD4+T细胞凋亡的影响:流式细胞分析结果显示,KYN刺激试验组外周血中经植物血凝素(PHA)活化的CD4+T细胞,共培养24 h后细胞凋亡率增高,在0.2 mmol/L和2.0 mmol/L浓度的刺激下其凋亡率分别为(14.47±0.18)%和(30.07±7.37)%;而空白对照组为(8.40±3.28)%。体外2.0 mmol/L的KYN刺激结核病患者CD4+T细胞平均凋亡率[(30.07±7.37)%]显著高于空白对照组[(8.40±3.28)%]的CD4+T细胞凋亡率,两组之间CD4+T细胞凋亡率差异有统计学意义(t=7.49,P=0.000),甚至在0.2 mmol/L低浓度的KYN环境中CD4+T细胞凋亡率[(14.47±0.18)%]和空白对照组[(8.40±3.28)%]之间也显示差异有统计学意义(t=5.16,P=0.045)。0.2 mmol/L和2.0 mmol/L的QA刺激CD4+T细胞产生的凋亡率分别为(6.83±1.66)%和(6.85±0.43)%,两种浓度的QA对CD4+T细胞的凋亡率差异无统计学意义(t=4.13,P=0.112;t=8.21,P=0.107)。0.2 mmol/L和2.0 mmol/L的TRP刺激CD4+T细胞产生的凋亡率分别为(6.93±0.52)%和(6.66±0.96)%,两种浓度的QA对CD4+T细胞的凋亡率差异无统计学意义(t=6.32,P=0.102;t=6.42,P=0.189)(表3)。
注 KYN:犬尿氨酸;TRP:色氨酸; QA:喹啉酸。左侧表示各代谢中间产物所用的浓度,低浓度为0.2 mmol/L,高浓度为2.0 mmol/L,0.0 mmol/L表示不加入任何代谢中间产物。KYN、TRP、QA在0.2 mmol/L与0.0 mmol/L浓度刺激下的凋亡率进行统计学处理,t值分别为5.16、6.32、4.13;P值分别为0.045、0.102、0.112;在2.0 mmol/L与0.0 mmol/L浓度刺激下的凋亡率进行统计学处理,t值分别为7.49、6.42、8.21;P值分别为0.000、0.189、0.107
2. TRP、KYN和QA对CD8+T细胞凋亡的影响:流式细胞分析结果显示,0.2 mmol/L和2.0 mmol/L的KYN刺激T细胞后引起CD8+T细胞亚群的细胞凋亡率分别为(19.41±2.94)%和(26.36±1.09)%,高于未添加任何化合物的空白对照组产生的凋亡率[(15.31±1.88)%](t=5.42,P=0.041;t=4.89,P=0.003);低浓度(0.2 mmol/L)和高浓度(2.0 mmol/L)的QA诱导CD8+T细胞产生的凋亡率分别是(14.94±3.24)%和(17.18±2.07)%,与未添加任何化合物的空白对照组[(15.31±1.88)%]比较差异无统计学意义(t=8.13,P=0.214;t=8.02,P=0.121)。低浓度(0.2 mmol/L)和高浓度(2.0 mmol/L)的TRP诱导CD8+T细胞产生的凋亡率分别是(16.28±2.28)%和(16.48±4.75)%,与未添加任何化合物的空白对照组[(15.31±1.88)%]比较,差异无统计学意义(t=5.33,P=0.411;t=7.41,P=0.238)(表4)。
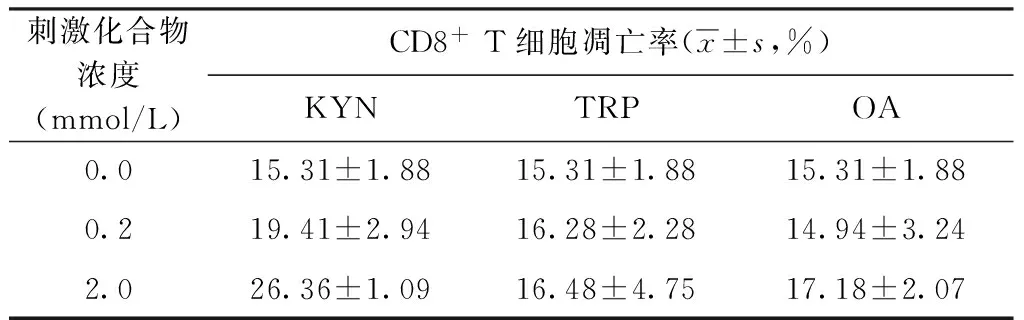
表4 不同浓度KYN、TRP和QA化合物刺激结核病患者致CD8+ T细胞凋亡情况分析
注 KYN:犬尿氨酸;TRP:色氨酸; QA:喹啉酸。左侧表示各代谢中间产物所用的浓度,低浓度为0.2 mmol/L,高浓度为2.0 mmol/L,0.0 mmol/L表示不加入任何代谢中间产物。KYN、TRP、QA在0.2 mmol/L与0.0 mmol/L浓度刺激下的凋亡率进行统计学处理,t值分别为5.42、5.33、8.13;P值分别为0.041、0.411、0.214;在2.0 mmol/L与0.0 mmol/L浓度刺激下的凋亡率进行统计学处理,t值分别为4.89、7.41、8.02;P值分别为0.003、0.238、0.121
讨 论
一、TRP-KYN代谢中间产物参与结核病免疫
目前,对结核病患者代谢的研究主要集中在抗结核药物的影响方面[5-6]。TRP-KYN代谢路径中吲哚胺-2,3-双加氧酶(IDO)是关键限速酶,KYN、QA等中间代谢产物具有重要的免疫调节作用。表达IDO的细胞在体内、外均能抑制T细胞的增殖[1-2,7],主要的机制在于TRP的被降解,造成局部蛋白合成受阻;或者代谢产物抑制免疫细胞的增殖或促进凋亡[8]。这其中Th17和Treg 细胞起了重要作用[9-10]。结核病患者体内的TRP-KYN代谢途径被活化提高,提示TRP代谢途径会因为结核分枝杆菌的感染而增强,其代谢中间产物含量变化的生物学意义需要进一步认识。
二、TRP-KYN代谢中间产物促进了T细胞的分化
先前的研究发现,与健康对照组相比,结核病患者体内KYN和QA的含量会增加,而TRP的含量降低,而PA和AA的含量不变[3]。KYN不仅抑制T细胞分化和功能[11],还能通过活性氧(ROS)作用诱导NK细胞的凋亡[12]。TRP的减少及KYN的增加促进了结核病患者体内Treg细胞比例的增加[13]。而Treg细胞的增加促进了TRP的利用,从而使T细胞的增殖因TRP的缺乏受到抑制。T细胞增殖受抑制的原因也与Treg细胞表面的CD25分子与效应T细胞的白细胞介素2竞争结合,使效应T细胞因无法获得生长信号而受抑制有关[1-2, 7-8]。高浓度的QA刺激能够促进产生促炎细胞分子和趋化因子,提高趋化因子受体表达水平[14]。由此推测结核分枝杆菌感染机体后,血清或血浆中的QA含量升高可能增强炎症反应、促进免疫反应,从而消除感染细菌,但是这一过程受Treg细胞的调节。笔者的研究结果证明,结核病患者体内Treg细胞明显增加(t=33.64,P=0.000),Th17细胞虽有增加但差异无统计学意义(t=44.46,P=0.071)。试验组PBMCs中Treg细胞和Th17细胞的比值与健康对照组相比,差异有统计学意义(t=34.25,P=0.001),揭示结核病患者存在重要的免疫再平衡过程。为了避免免疫病理损伤,结核病患者发病时其免疫系统处于一定程度的抑制状态。本试验结果中Treg细胞与Th17细胞比值的标准差与比值的均值接近,显示了利用比值来反应结核病患者的免疫学状态的可行性存在较大的不确定性,Treg细胞与Th17细胞比值的临床意义需要进一步验证。
三、TRP-KYN代谢中间产物影响T细胞的凋亡
已有的研究发现结核病患者的CD4+T和CD8+T细胞较健康对照组明显下降[15],除了细胞增殖受到抑制的因素外,细胞凋亡的诱发和中枢免疫器官功能受损等成为解释该现象的主要原因[15]。细胞凋亡机制是细胞产生分化的一种途径方式。本研究发现:在结核病患者CD4+T细胞亚群中,Treg和Th17的比例上升[试验组和健康对照组分别为:(1.49±0.83)%和(0.42±0.27)%;(1.04±0.77)%和(0.73±0.43)%]。通过体外实验,本研究发现KYN对CD4+和CD8+T细胞都具有显著的凋亡诱导作用[分别由(8.40±3.28)%上升至(30.07±7.37)%和由(15.31±1.88)%上升至(26.36±1.09)%]。Frumento等[16]认为QA能选择性地抑制CD4+和CD8+T淋巴细胞的增殖并且激活NK细胞,在TRP缺乏的情况下这种现象会更加显著。本研究没有观察到QA刺激结核病患者外周血中CD4+或者CD8+T细胞而产生的凋亡现象(P值分别为0.107、0.121),由此推测QA仅具有抑制CD4+和CD8+T细胞增殖的作用,但是并没有激活其凋亡机制的作用。
总之,结核病患者体内高水平的KYN、QA及低水平的TRP在结核病免疫中起了重要作用,这主要表现在Treg细胞的比例增加。KYN在诱导T细胞分化和产生Treg细胞中起了重要作用,该作用的发挥主要靠细胞凋亡实现。QA在结核病免疫中的作用可能与炎症反应和抑制增殖有关,而与细胞分化无关。
志谢 中国疾病预防控制中心结核病防治临床中心姜晓颖博士在统计学方面给予了极大的帮助!
[1] Terness P, Bauer TM, Röse L, et al. Inhibition of allogeneic T cell proliferation by indoleamine 2,3-dioxygenase-expressing dendritic cells: mediation of suppression by tryptophan meta-bolites. J Exp Med, 2002, 196 (4): 447-457.
[2] Mellor AL, Munn D, Chandler P, et al. Tryptophan catabolism and T cell responses. Adv Exp Med Biol, 2003, 527: 27-35.
[3] 张荧,朱慧,任卫聪,等. 液相色谱-质谱联用技术同时定量检测结核病患者中多种色氨酸代谢产物及其临床意义. 中华临床医师杂志(电子版),2013,7(9):3866-3870.
[4] Lim HW, Lee J, Hillsamer P, et al. Human Th17 cells share major trafficking receptors with both polarized effector T cells and FoxP3+regulatory T cells. J Immunol, 2008, 180(1): 122-129.
[5] 肖和平,唐神结. 二线抗结核药物的临床应用. 中国防痨杂志,2009,31(10): 612-616.
[6] 闫世明,孙秀娟,邹志艳,等. 吡嗪酰胺对老年肺结核病人血尿酸代谢的影响. 中国防痨杂志,1993,15(1):96-99.
[7] Takikawa O. Biochemical and medical aspects of the indolea-mine 2,3-dioxygenase-initiated L-tryptophan metabolism. Biochem Biophys Res Commun, 2005, 338(1): 12-19.
[8] Hwu P, Du MX, Lapointe R, et al. Indoleamine 2,3-dioxygenase production by human dendritic cells results in the inhibition of T cell proliferation. J Immunol, 2000, 164(7): 3596-3599.
[9] Sojka DK, Huang YH, Fowell DJ. Mechanisms of regulatory T-cell suppression—a diverse arsenal for a moving target. Immunology, 2008, 124(1): 13-22.
[10] McGovern JL, Nguyen DX, Notley CA, et al. Th17 cells are restrained by Treg cells via the inhibition of interleukin-6 in patients with rheumatoid arthritis responding to anti-tumor necrosis factor antibody therapy. Arthritis Rheum, 2012, 64(10): 3129-3138.
[11] Kwidzinski E, Bechmann I. IDO expression in the brain: a double-edged sword. J Mol Med (Berl), 2007, 85(12): 1351-1359.
[12] Song H, Park H, Kim YS, et al. L-kynurenine-induced apoptosis in human NK cells is mediated by reactive oxygen species. Int Immunopharmacol, 2011, 11(8): 932-938.
[13] Kaper T, Looger LL, Takanaga H, et al. Nanosensor detection of an immunoregulatory tryptophan influx/kynurenine efflux cycle. PLoS Biol, 2007, 5(10): e257.
[14] 石莲,张丽华,孟萍,等.肺结核患者外周血T淋巴细胞亚群测定的临床研究. 中国防痨杂志,2009,31(11):673-675.
[15] Rodrigues DS, Medeiros EA, Weckx LY, et al. Immunophenotypic characterization of peripheral T lymphocytes inMycobacteriumtuberculosisinfection and disease. Clin Exp Immunol, 2002, 128(1): 149-154.
[16] Frumento G, Rotondo R, Tonetti M, et al. Tryptophan-derived catabolites are responsible for inhibition of T and natural killer cell proliferation induced by indoleamine 2,3-dioxyge-nase. J Exp Med, 2002, 196(4): 459-468.
(本文编辑:郭萌)
Effect of the metabolites in the tryptophan-kynurinine pathway on T-cell immunity among patients with tuberculosis
ZHANGYing,ZHUHui,LIANGQian,ZHAOLi-ping,HUANGHai-rong,HUANGJuan,SUNZhao-gang.
NationalTuberculosisClinicalLaboratory,BeijingChestHospital,CapitalMedicalUniversity,BeijingkeyLaboratoryinDrugResistantTuberculosisResearch,BeijingTuberculosis&ThoracicTumorResearchInstitute,Beijing101149,China
SUNZhao-gang,Email:sunzg75@hotmail.com;HUANGJuan,Email:happyhj888@163.com
Tuberculosis/immunology; T-lymphocyte subsets; Tryptophan; Kynurenine
10.3969/j.issn.1000-6621.2015.04.001
“十二五”国家科技重大专项(2013ZX10003009);北京市高层次卫生技术人才培养项目(2011-3-069);北京市医院管理局临床医学发展专项(ZYLX201304)
101149 首都医科大学附属北京胸科医院 国家结核病临床实验室 北京市结核病胸部肿瘤研究所 耐药结核病研究北京市重点实验室[张荧(研究生)、梁倩、赵立平、黄海荣、孙照刚],药物研究室(朱慧);青岛农业大学 山东省预防兽医学重点实验室[张荧、黄娟]
孙照刚,Email:sunzg75@hotmail.com;黄娟,Email:happyhj888@163.com
2014-11-03)
