苏合香对大鼠急性局灶性脑缺血损伤的作用初探*
2015-05-16朱金墙王晓英张伯礼
周 敏 ,赵 培 ,朱金墙 ,王晓英 ,张 萌 ,张伯礼
(1.天津中医药大学,天津 300193;2.中国中医科学院,北京 100700;3.哈佛医学院,麻省总医院,神经保护研究实验室,马萨诸塞州查尔斯镇 02129)
苏合香对大鼠急性局灶性脑缺血损伤的作用初探*
周 敏1,2,赵 培1,朱金墙1,王晓英3,张 萌1,张伯礼1,2
(1.天津中医药大学,天津 300193;2.中国中医科学院,北京 100700;3.哈佛医学院,麻省总医院,神经保护研究实验室,马萨诸塞州查尔斯镇 02129)
[目的]研究苏合香预处理对健康大鼠生理状态下的安全性及急性局灶性脑缺血病理损伤状态下的反应性,初步探索苏合香药理预适应对急性脑缺血损伤的影响,为阐明苏合香“开窍”作用提供部分实验依据。[方法]将健康雄性SD大鼠随机分为假手术组(Sham)、对照组(Vehicle)及苏合香各剂量组[Storax 0.1、0.2、0.4、0.8、1.6 g/(kg·d)]。监测预给药期间各组大鼠体质量及肝肾功能以确保用药安全性。预给药5 d后,线栓法建立大鼠大脑中动脉阻塞(MCAO)模型,激光多普勒血流检测仪(LDF)监测脑血流以评价、筛选模型,于缺血24 h时评价药效:改进的ZeaLonga神经功能评分评价神经功能缺损,2,3,5-氯化三苯基四氮唑(TTC)染色评价脑梗死体积、半球水肿率,并计算总死亡率,同时检测凝血四项以观察大鼠脑缺血急性期凝血功能。[结果]Storax 1.6 g/(kg·d)组连续灌胃给药数日后,大鼠体质量较同时同点其他各组体质量明显降低(P<0.05),血浆谷丙转氨酶(ALT)、尿素(CREA)水平显著升高(P<0.05),故于后续实验中取消该组以确保用药安全;与对照组比较,Storax 0.1、0.2、0.4、0.8 g/(kg·d)各组能显著降低大鼠脑缺血后半球水肿率及神经功能评分(P<0.05),Storax 0.2、0.4、0.8 g/(kg·d)各组能显著降低脑梗死体积比(P<0.05),并有降低死亡率的趋势;Storax 0.2、0.4、0.8 g/(kg·d)各组能显著延长血浆凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)并降低纤维蛋白原(FIB)含量(P<0.05)。[结论]苏合香药理预适应可使大鼠急性局灶性脑缺血后病理损伤程度减轻,显示其潜在的抗脑缺血作用前景,其抗脑缺血损伤作用可能与苏合香通过改善缺血后血液高凝状态而改善脑血流有关,或为苏合香“开窍”机制之一;Storax 0.8 g/(kg·d)组同时具有药理作用及部分毒理作用,Storax 0.1、0.2、0.4 g/(kg·d)组所用剂量可视为相对安全、有效。
苏合香;药理预适应;局灶性脑缺血;安全评价;药效评价
苏合香(Storax)为金缕梅科植物苏合香(LiquidambarorientalisMill.)树干渗出的香树脂经加工精制而成,属芳香开窍类中药,临床常与冰片、麝香等同类开窍药及具有益气、活血等作用的中药合用以治疗中风昏迷证属“寒邪、痰浊内闭”者,常获奇效。尽管近年来中药以其多途径、多靶点优势成为国内外防治中风药理研究的热点,但多集中在益气活血方剂[1-3],芳香开窍药抗脑缺血的研究方兴未艾,对单味苏合香的研究也几近空白[4]。苏合香在复方中的作用定位尚不清楚,其“开窍醒神”、“急救复苏”作用对应作用于中风病的具体病生理环节也仍未知。本研究通过预给药使实验动物达到药理预适应以使药效最大化的方式,对苏合香抗急性脑缺血损伤的作用进行初步探索,同时对其用药安全进行初步监测,以为后续研究及可能的临床转化研究提供实验参考。
1 动物与给药
1.1 实验动物 健康雄性SD大鼠,体质量250~300 g(SPF级,购自北京维通利华生物技术有限公司,许可证号 SCXK(京)2012-0001),饲养于天津中医药大学第一附属医院普通环境动物房(笼中饲养,温度25℃,湿度65%,12 h白昼循环),自由进食进水,术前12 h禁食不禁水。
1.2 药物与分组 精制苏合香油由中新药业达仁堂制药厂提供,经鉴定符合《中国药典》2010版一部标准。吐温80购自Sigma公司(P8074,BioXtra级别)。依据《中国药典》成人(60 kg)每日最大计量(1 g)经体表面积比换算,大鼠(250 g)的每日给药剂量为0.093 2 g/kg≈0.1 g,各组给药剂量分别约为临床剂量的 1、2、4、8、16 倍。精密称取苏合香,按最高浓度计算溶液体积及吐温80用量(0.25%吐温80作为乳化剂、增溶剂),将苏合香与吐温80充分研磨后,分次加入纯水研磨混匀,再分别稀释至各组所需浓度,药物一次性配出以保证各实验批次用药均一性,于棕色广口瓶中4℃保存,临用前取适量放置常温并摇匀。
大鼠适应性饲养1周后,根据动物起始体质量随机分笼分组并顺序编号,由助手从每组中随机各取一只大鼠交予施术者,并尽力保证各组动物实验条件均等,图像分析处理完成后按事先记录的数字与分组信息进行分组合并统计。将动物分为假手术组(Sham)、对照组(Vehicle)、苏合香0.1 g/(kg·d)(Storax 0.1)、苏合香0.2 g/(kg·d)(Storax 0.2)、苏合香0.4 g/(kg·d)(Storax 0.4)、苏合香0.8 g/(kg·d)(Storax 0.8)、苏合香1.6 g/(kg·d)(Storax 1.6)各组(注:本课题组预实验结果及已有文献显示,0.25%吐温灌胃给药对脑缺血大鼠不具有明显药理活性,同时为避免不可预料的动物死亡,未单独设立生理盐水对照组)。各组大鼠造模前5 d开始灌胃,1次/日,术前1.5 h加给药1次,给药量分别为0.1、0.2、0.4、0.8、1.6 g/(kg·d),Vehicle组给予0.25%吐温溶液,Sham组予纯水。所有大鼠均按10mL/kg灌胃给药。
1.3 主要试剂 2,3,5-氯化三苯基四氮唑(TTC,Sigma公司,T8877):生理盐水配成2%wt/vol TTC溶液,现配现用、避光保存。0.1mol/LPB(pH 7.2):磷酸氢二钠30.8 g和磷酸二氢钠2.8 g,加水800mL,调pH至7.2,定容至1 000mL;4%多聚甲醛:多聚甲醛40 g加入800mL 0.1mol/LPB中,60℃加热过夜待其充分溶解,冷却后定容至1 000mL,室温保存。
2 方法
2.1 大鼠体质量及肝肾功能监测 给药期间监测大鼠体质量,并于造模前眼眶取血1mL于肝素钠抗凝管中,静置约30min,3 000 r/min、10min离心分离上层血浆,检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、尿素(UREA)、肌酐(CREA)(全自动生化分析仪,罗氏7600)对苏合香用药安全进行初步监测。
2.2 模型制备 参照Longa、Kuga等的方法采用线栓法建立大鼠大脑中动脉阻塞(MCAO)模型[6-7],激光多普勒血流监测仪(LDF)监测皮质脑血流以评价模型,以大脑中动脉支配皮质局部血流下降为血流基值的25%以下视为造模成功,并连续监测至术后血流值稳定为止。阻塞2 h后缓慢将线栓抽出。假手术组仅离断右颈外动脉,不予栓塞。小动物加热板维持大鼠术中肛温37℃,术后30℃保温,并予5mL生理盐水腹腔注射以防止脱水,大鼠苏醒后放回笼中。
2.3 神经功能缺损评价 于缺血24 h时,采用Longa神经病学评分评定神经功能缺损[6]:0分,正常,无神经功能缺损症状;1分,轻微神经功能缺损,提尾悬空缺血对侧前爪不能完全伸展;2分,中度局灶性神经功能缺损,行走向缺血对侧转圈;3分,中度局灶性神经功能缺损,行走困难,向缺血对侧倾倒;4分,不能自发行走,意识水平下降。
2.4 半球水肿率、脑梗死体积比评价 脑缺血24 h时,大鼠深麻醉状态下断头,取脑置于脑切片模具中(去除嗅球、小脑),行2mm冠状切片,2%TTC溶液中染色15min(37℃),并以4%多聚甲醛固定后拍照,用image J图像分析软件进行分析。半球水肿率(%)=(缺血同侧半球面积-缺血对侧半球面积)÷缺血对侧半球面积×100。为排除脑水肿影响,参考Lo等[8]以修正后的公式计算脑梗死体积,即脑梗死体积比(%)=[梗死面积×(1-半球水肿率)×2mm]÷(缺血对侧半球面积×2mm)×100。
2.5 死亡率评价 记录缺血24 h内因缺血原因导致的死亡数,其他非缺血原因导致的死亡(灌胃操作不当、颅底出血、麻醉死亡等)予以排除,分别统计各组大鼠死亡率。
2.6 凝血四项检测 大鼠处死取材前,麻醉状态下于腹主动脉取血约5mL,至枸橼酸钠抗凝管中迅速颠倒混匀后静置,3 000 r/min,10min,4 ℃离心,取上层血浆,光学比浊法检测凝血4项:凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)(全自动凝血分析仪,ACC,TOP700)。
2.7 统计学分析 采用SPSS 18.0软件进行统计学分析。计量资料以均值±标准差(±s)表示,正态分布计量资料采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK法,若方差不齐采用Dunnett’sT3法。均以P<0.05为差异有统计学意义。
3 结果
3.1 苏合香灌胃给药对大鼠体质量增长及肝肾功能的影响 Storax 1.6组连续灌胃给药3 d后,体质量较同时间点其他组显著下降(P<0.05)(见图1),灌胃 5 d后血浆 ALT、TBIL、CREA水平显著升高(P<0.05),UREA 水平及 UREA/CREA 比值显著降低(P<0.05),呈现出毒性反应;Storax 0.8组UREA水平较Vehicle组显著升高(P<0.05),UREA/CREA比值较Vehicle组显著降低(P<0.05);其他各组体质量增长及肝肾功能检测未见明显异常(见表1)。故于后续实验中取消Storax 1.6组以确保用药安全,苏合香其他组剂量视为安全剂量以进行后续实验。
表1 苏合香灌胃给药对健康大鼠肝肾功能主要指标的影响(±s)Tab.1 Hepatic-renal function of healthy ratsafter Storax pretreatment( ±s)
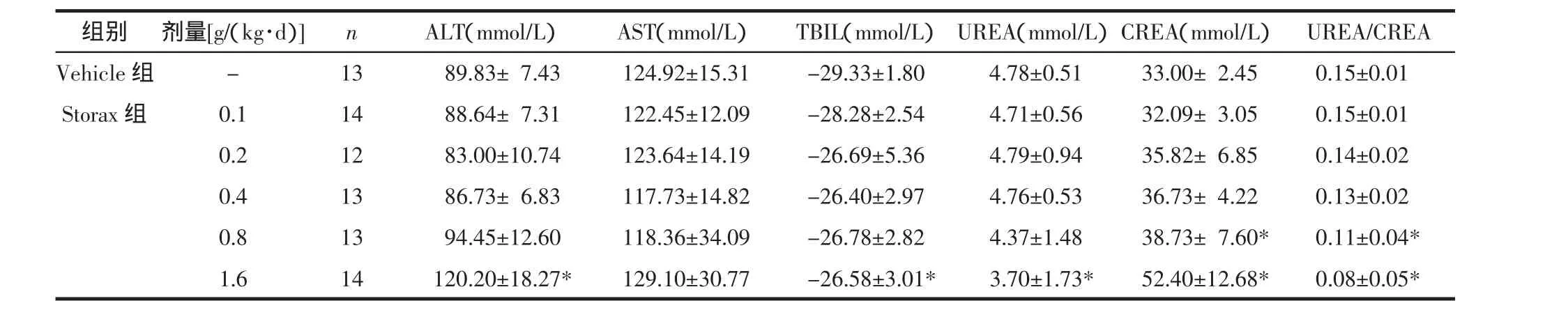
表1 苏合香灌胃给药对健康大鼠肝肾功能主要指标的影响(±s)Tab.1 Hepatic-renal function of healthy ratsafter Storax pretreatment( ±s)
组别剂量[g/(kg·d)]n ALT(mmol/L)AST(mmol/L)TBIL(mmol/L)UREA(mmol/L)CREA(mmol/L)UREA/CREA Vehicle组 - 13 089.83±07.43 124.92±15.31 -29.33±1.80 4.78±0.51 33.00±02.45 0.15±0.01 Storax 组 0.1 14 088.64±07.31 122.45±12.09 -28.28±2.54 4.71±0.56 32.09±03.05 0.15±0.01 0.2 12 083.00±10.74 123.64±14.19 -26.69±5.36 4.79±0.94 35.82±06.85 0.14±0.02 0.4 13 086.73±06.83 117.73±14.82 -26.40±2.97 4.76±0.53 36.73±04.22 0.13±0.02 0.8 13 094.45±12.60 118.36±34.09 -26.78±2.82 4.37±1.48 38.73±07.60* 0.11±0.04*1.6 14 120.20±18.27* 129.10±30.77 -26.58±3.01* 3.70±1.73* 52.40±12.68* 0.08±0.05*
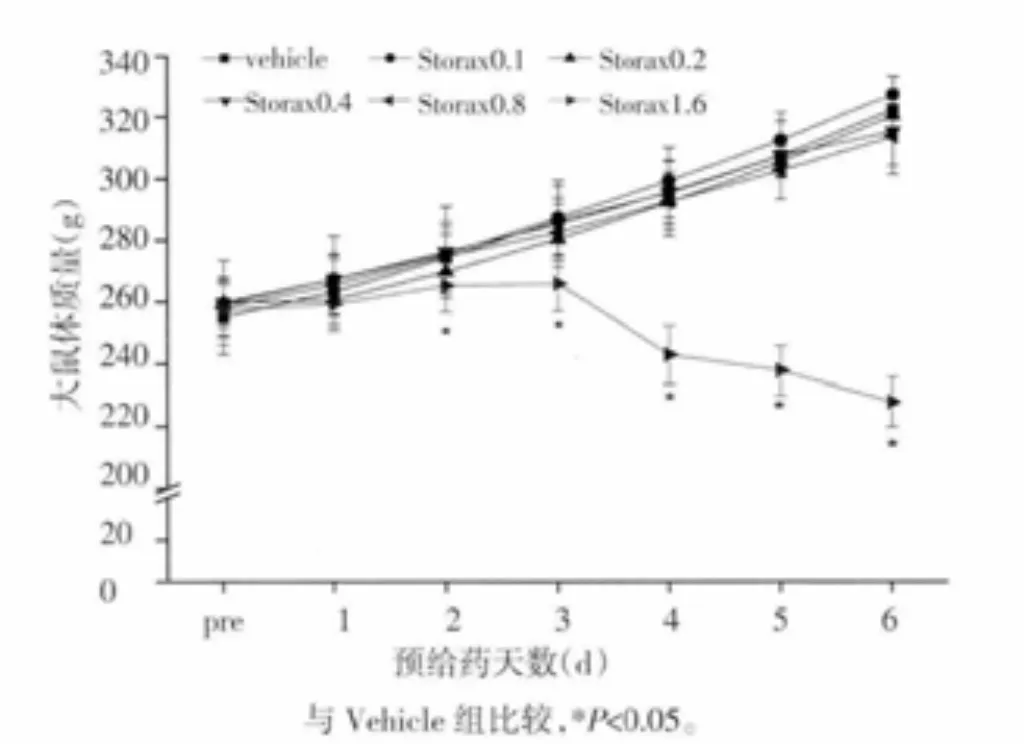
图1 健康大鼠灌胃给药期间体质量增长趋势图(±s,n=12~14)Fig.1 Body weightofhealthy rats during pretreatment(±s,n=12~14)
3.2 苏合香预处理对急性局灶性脑缺血大鼠脑组织损伤(梗死体积比、半球水肿率)的影响 TTC是脂溶性光敏感复合物,是线粒体呼吸链质子受体,正常脑组织中的脱氢酶与TTC反应而呈红色,缺血脑组织因细胞膜线粒体脱氢酶活性下降而不能与TTC反应,呈白色拒染区域。各组大鼠脑组织经TTC染色后,Sham组脑组织均匀红染,左右半球对称一致,Vehicle组缺血半球脑组织纹状体、海马、皮质等区域可见白色拒染区域(梗死灶),且缺血半球脑组织明显肿胀,说明模型制作成功;与Vehicle组比较,Storax 0.1、0.2、0.4、0.8 各组能显著降低缺血半球水肿率(P<0.05),Storax 0.2、0.4、0.8 各组能显著降低缺血半球梗死体积比(P<0.05),详见图2、表2。

图2 各组TTC染色典型图片Fig.2 Representative images for TTC stained ischem ic brain infarctions
表2 苏合香预处理对急性局灶性脑缺血大鼠脑梗死体积、水肿率的影响( ±s)Tab.2 Effectsof Storax pretreatmenton infarctvolumes and hem ispheric swelling ratesof cerebral ischem iareperfusion injury in rats( ±s)
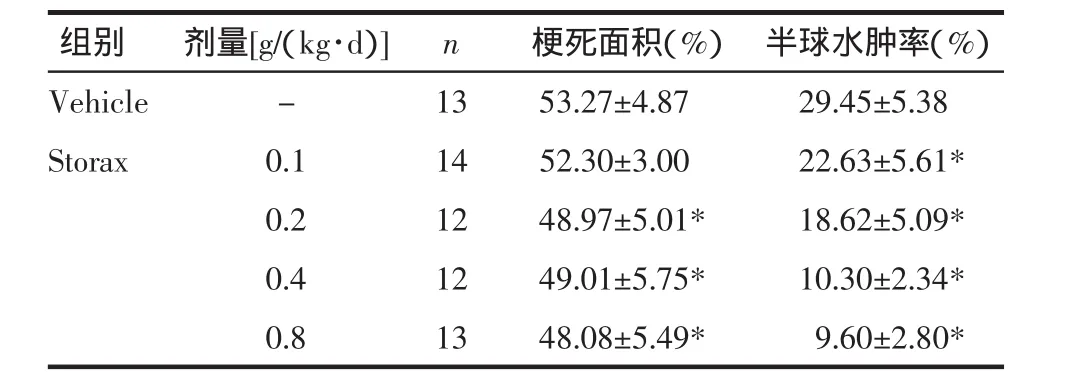
表2 苏合香预处理对急性局灶性脑缺血大鼠脑梗死体积、水肿率的影响( ±s)Tab.2 Effectsof Storax pretreatmenton infarctvolumes and hem ispheric swelling ratesof cerebral ischem iareperfusion injury in rats( ±s)
注:与 Vehicle组比较,*P<0.05。
组别剂量[g/(kg·d)]n梗死面积(%)半球水肿率(%)Vehicle - 13 53.27±4.87 29.45±5.38 Storax 0.1 14 52.30±3.00 22.63±5.61*0.2 12 48.97±5.01* 18.62±5.09*0.4 12 49.01±5.75* 10.30±2.34*0.8 13 48.08±5.49* 09.60±2.80*
3.3 苏合香预处理对脑缺血损伤大鼠急性期神经功能评分及死亡率的影响 Vehicle组大鼠较Sham组大鼠呈现出明显的神经功能缺陷(P<0.05),Storax 0.1、0.2、0.4、0.8各组能显著降低大鼠神经功能评分(P<0.05);本次实验受试动物共137只,其中因蛛网膜下腔出血、麻醉意外死亡等排除14只,共纳入123只,缺血24 h时实际存活74只。Storax 0.1、0.2、0.4、0.8各组有降低大鼠死亡率的趋势,但与模型组比较差异无统计学意义,见表3。

表3 苏合香预处理对急性局灶性脑缺血大鼠神经功能评分、死亡率的影响Tab.3 Effectsof Storax pretreatmenton neurological scoresand death ratesof focal cerebral ischem ia rats
3.4 苏合香预处理对急性局灶性脑缺血损伤大鼠凝血功能的影响 脑缺血后,大鼠凝血功能异常,与Sham组比较,Vehicle组PT、APTT、TT显著缩短(P<0.05),FIB 含量显著升高(P<0.05)。前期结果显示Storax 0.1组药理活性较弱,故未予检测,Storax 0.2、0.4、0.8 组可显著延长 PT、APTT(P<0.05),并有延长TT的趋势,Storax 0.4、0.8组可显著降低血浆FIB 含量(P<0.05),见表 4。
4 讨论
脑卒中是世界三大致死性疾病之一,也是世界范围内导致成人永久性残疾最常见的原因,其中缺血性脑卒中约占80%,急性期是缺血性中风治疗、康复的黄金时期[9-11]。本实验采用预给药的方式使药效最大化,观察苏合香对大鼠生理状态下的安全性及病理状态下的反应性,结果表明,本实验条件下,苏合香0.1、0.2、0.4组所用剂量相对安全、有效,苏合香药理预适应可减轻大鼠急性局灶性脑缺血的病理损伤,体现在对脑梗死体积、脑水肿、神经功能评分及死亡率的改善等方面,其中以对脑水肿的改善最显著,或为苏合香“开窍”作用的药效基础之一,提示苏合香潜在的抗脑缺血损伤应用前景,值得进一步研究苏合香对脑缺血后的治疗作用及机制,这将是本课题组下一步的研究工作。
脑梗死的发病因素及病理机制较为复杂[12],主要有血栓形成、动脉栓塞、血流动力学障碍所致低灌注三种机制参与脑梗死的形成,这其中包括血管内膜的损伤、血液流变学改变、血小板活性改变、纤溶及凝血活性改变等诸多环节[13]。缺血缺氧病理状态下,机体内外凝血系统激活,凝血功能亢进,微血栓形成,进一步加重组织缺血缺氧[14],故临床上通过监测血液流变学的变化来预测缺血性脑卒中的进展及预后,其中凝血4项是判断凝血功能、指导溶栓及临床用药的重要指标。PT、APTT分别反映内源性和外源性凝血系统状况,血浆FIB为急性期反应蛋白,是促进血小板聚集的最主要的血液蛋白,引起血液黏度和血液流变学改变。TT则反映FIB转为纤维蛋白的时间。研究发现,脑梗死患者急性期血浆FIB水平显著升高,且升高程度与脑梗死体积成正相关,与发病1 a内脑梗死复发或死亡事件及发病1 a时的预后呈负相关[15-16],由此可见,脑缺血急性期血浆FIB水平是评价病情及预后的重要指标。本实验结果表明,与Sham组比较,大鼠脑缺血后凝血时间缩短,血浆FIB水平升高,与之前报道一致;苏合香可显著延长模型大鼠PT、APTT,并有延长TT的趋势,表明苏合香能同时抑制内源性和外源性凝血因子的活化,同时,苏合香可显著降低急性局灶性脑缺血大鼠血浆FIB含量,抑制血栓形成。早期亦有离体实验研究表明,苏合香具有抗血栓形成和抗血小板聚集的作用[17-18]。综上,苏合香可改善急性脑缺血后高凝状态、抑制血栓形成,从而改善脑缺血后血流动力学及微循环障碍,发挥抗脑缺血损伤的作用。
表4 苏合香预处理对急性局灶性脑缺血大鼠凝血功能的影响(±s)Tab.4 Effectsof Storax pretreatmenton coagulation function of cerebral ischem ia-reperfusion injury in rats( ±s)

表4 苏合香预处理对急性局灶性脑缺血大鼠凝血功能的影响(±s)Tab.4 Effectsof Storax pretreatmenton coagulation function of cerebral ischem ia-reperfusion injury in rats( ±s)
注:与 Sham 组比较,*P<0.05,与 Vehicle组比较,#P<0.05。
组别剂量[g/(kg·d)]n PT(s)APTT(s)TT(s)FIB(g/L)Sham - 10 14.52±0.54 31.67±3.95 39.41±0.97 1.79±0.03 Vehicle - 13 10.32±0.73* 25.71±3.76* 26.36±2.36* 2.27±0.21*Storax 0.2 12 11.13±0.89*# 29.37±1.66*# 25.13±0.99* 2.16±0.23*0.4 12 11.50±1.05*# 29.66±0.63# 25.63±1.70* 2.06±0.18*#0.8 12 11.68±0.65*# 29.83±1.26# 25.63±4.88* 2.01±0.27*#
[1]陈玉兰,胡国强.益肾补气活血法对脑缺血及再灌注大鼠脑水肿、自由基的影响[J].天津中医药,2006,23(3):240-241.
[2]杨 勇,任长虹,吴晓丹.参附注射液对大鼠局灶性脑缺血再灌注损伤的保护作用及其机制研究[J].天津中医药,2014,31(7):436-439
[3]赵 旭,范英昌,杜 云.丹酚酸B对局灶性脑缺血/再灌注大鼠血清超氧化物歧化酶活力和丙二醛含量的影响[J].天津中医药,2008,25(1):63-65.
[4]周 敏,朱金墙,康立源.苏合香化学成分及抗脑损伤作用实验研究进展[J].中国中药杂志,2013,38(22):3825-3828.
[5]方积乾.生物医学研究的统计方法[M].北京:高等教育出版社,2007:65.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralartery occlusionwithoutcraniectomy in rats[J].Stroke,1989,20(1):84.
[7]Kuge Y,Minematsu K,YamaguchiT,etal.Nylonmono-filament for intraluminal middle cerebral artey occlusion in rats[J].Stroke,1995,26(9):1655.
[8]Lee ST,Chu K,Jung KH,et al.Granulocyte colony-stimulating factor enhances angiogenesis after focal cerebral ischemia[J].Neurosurqery,2005,1058(1-2):120-128.
[9]闫 晨,马德邻,朱金强.脑缺血再灌注神经元损伤机制研究进展[J].天津中医药,2012,29(5):510-512.
[10]Lo EH,Dalkara T,Moskowitz MA.Mechanisms,challenges and opportunities in stroke[J].NatRev Neurosci,2003,4:399-415.
[11]中华医学会神经病学会分会脑血管病学组缺血性脑卒中二级预防指南撰写组.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南(2010)[J].中国临床医生,2011,39(11):68-74.
[12]Hachinski V,Donnan GA,Gorelick PB,et al.Stroke:Working toward a prioritized world agenda[J].International Journalof Stroke,2010,5(4):238-256.
[13]高 山,黄家星,黄一宁,等.动脉粥样硬化性大脑中动脉狭窄梗死的发病机制[J].中华神经科杂志,2003,36(2):155-157.
[14]Tohgi H,Kawashima,Tamura K,et al.Coagulation-fibrinolysis abnorma1ities in acute and chronic phases of cerebral thrombosis embolism[J].Stroke,1990,21(12):1663-1667.
[15]李运刚,巩法莲,潘旭东.脑梗死急性期脂蛋白α和纤维蛋白原的变化[J].神经疾病与精神卫生,2002,2(2):105-106.
[16]朱以诚,崔丽英,华宝来,等.脑梗死急性期血浆纤维蛋白原水平与预后的随诊观察[J].中风与神经疾病杂志,2006,23(2):223-225.[17]张文惠.苏合香抗血小板聚集活性成分的研究 [J].中草药,1985,16(3):16.
[18]朱 亮,冷文红,谭立伟.苏合香抗血栓作用[J].中成药,1990,12(9):31.
Effectsof Storax on focalcerebral ischem ia in rats
ZHOUMin1,2,ZHAOPei1,ZHU Jin-qiang1,WANGXiao-ying3,ZHENGMeng1,ZHANGBo-li1,2
(1.Tianjin University of TraditionalChineseMedicine,Tianjin 300193,China;2.Graduate SchoolofChina Academy ofChineseMedical Science,Beijing 10070,China;3.Neuroprotection Research Laboratory,MassachusettsGeneralHospital,Harvard Medical School,Charlestown,Massachusetts02129,USA)
[Objective]To investigate effectsof Storax on acute focal cerebral ischemia in rats.[Methods]Healthymale SD ratswere administered intragastrically with Storax at the dose of 0.1,0.2,0.4,0.8 and 1.6 g/kg in each day,for 5 days,and then induced with occlusion of middle cerebral artery (MCAO)with suture embolus.Body weight and hepatic-renal function of healthy rats during pretreatmentweremeasured before stroke,and ischemic infarct volumes and hemispheric swelling rateswere quantified on TTC-stained brain slicesat24 h,after stroke,also,neurologicalscores,death ratesand the contentof Fib,PT,APTT,TTwereevaluated 24 hoursafter stroke.[Results]Rats treated with storax at the dose of1.6 g/kg in each day presented signsof toxicity,weightgrowthwere decreased and ALT,CREA were increased compared with other groups(P<0.05),and 0.1,0.2,0.4,0.8 g/kg in each daywere chosen as the relatively safety doses to proceed the subsequentexperiment.24 hoursafter stroke,the infarctvolumes,hemispheric swelling ratesand neurological deficitsof rats in the vehicle group were significantcompared with the sham group (P<0.05),and Storax significantly attenuates the brain damage of cerebral ischemia(P<0.05).Compared with the sham group,the concentration of Fib significantly increased(P<0.05)and PT,APTT,and TT significantly shortened in the model group (P<0.05);however,compared with the vehicle group,Storax significantly decreased Fib content(P<0.05)and prolonged PT,APTT(P<0.05).[Conclusion]Storax can attenuate the brain damage and regulate the coagulation function in acute focal cerebral ischemia in rats.
Storax;pharmacologic preconditioning;focal cerebral ischemia;safety evaluation;efficacy evaluation
R743
A
1672-1519(2015)08-0496-05
10.11656/j.issn.1672-1519.2015.08.14
国家自然科学基金项目(81273815)。
周 敏(1986-),女,博士研究生,研究方向为中西医结合治疗心脑血管疾病。
张伯礼,E-mail:zhangbolipr@163.com。
2015-03-15)
p
