胸腺瘤组织中c-myc和PTEN基因的表达
2015-05-16石锋
石锋
胸腺瘤是常见的纵隔肿瘤,一般位于前上纵隔,被认为是胸腺上皮肿瘤。胸腺瘤具有局部浸润、远处转移等特性,但其属于低度恶性或者潜在恶性肿瘤[1]。由于其发病率低且经常伴随自身免疫疾病以及其他系统病变,发病机制复杂,故在其病因、病理分类、临床分期、治疗方案等诸多方面一直存在争议。本研究应用免疫组织化学SP法探讨癌基因c-myc及抑癌基因PTEN在胸腺瘤组织中的表达,结合Masaoka分期以及WHO分型,研究其在胸腺瘤发生发展过程中的作用、其与胸腺瘤临床病理学特征的关系以及二者在胸腺瘤组织中表达的相关性,期望为临床诊断和治疗胸腺瘤提供理论依据,现具体报道如下。
1 资料与方法
1.1 一般资料 选择2001年1月-2012年1月本院45例患者的胸腺瘤切除标本存档蜡块作为研究材料,所选患者中男26例,女l9例,年龄20~72岁,平均43.4岁。非侵袭性胸腺瘤(I期)17例(非侵袭性组);侵袭性胸腺瘤28例(侵袭性组),其中Ⅱ期11例,Ⅲ期14例,Ⅳ期3例。良性或低度恶性胸腺瘤14例(良性组),其中A型5例,AB型9例;恶性胸腺瘤31例(恶性组),其中B1型8例,B2型11例,B3型12例。取同期16例非肿瘤胸腺组织作为对照组。
1.2 分期及分型标准 按Masaoka临床分期标准[2],非侵袭性胸腺瘤为Masaoka临床分期I期,侵袭性胸腺瘤为Masaoka临床分期Ⅱ~Ⅳ期。按世界卫生组织(WHO)病历分型标准[3],A型、AB型为WHO分型之良性或低度恶性胸腺瘤,B1~B3为WHO分型之恶性胸腺瘤。
1.3 方法 全部标本均经10%中性甲醛固定,常规石蜡包埋,所有蜡块制成4 μm厚的连续切片3张,2张行免疫组化染色,1张行HE染色复核诊断。试验用鼠抗人c-myc单克隆抗体、SP试剂盒均购买于福州迈新公司。鼠抗人PTEN单克隆抗体购买于北京中山公司。应用免疫组织化学SP法,检测c-myc及PTEN基因在胸腺瘤中的表达。
1.4 结果判断标准
1.4.1 c-myc基因 光镜分析,在排除非特异性染色等干扰的前提下,细胞核或细胞浆中出现棕褐色、棕黄色、黄色颗粒的标记为阳性。在400倍视野下连续选择10个视野,每个视野计数100个细胞,肿瘤细胞无阳性反应为(-),阳性细胞数占1%~25%为(+),26%~50%为(++),>50%为(+++)。
1.4.2 PTEN基因 阳性染色指在排除非特异性染色等干扰的前提下,光镜下观察细胞核或细胞浆内出现棕褐色、棕黄色、黄色颗粒,而且背景清晰。PTEN蛋白定位于细胞核或细胞浆。每张切片在400倍视野下连续选择10个视野,每个视野计数100个细胞。根据Wang等[4]和Simmons等[5]的方法,规定无明确阳性细胞或阳性细胞百分比<10%为阴性(-),阳性细胞百分比在10%~25%为弱阳性(+),阳性细胞百分比在26%~50%为阳性(++),阳性细胞百分比>50%为强阳性(+++)。
1.5 统计学处理 所得数据应用SPSS 13.0软件进行统计学处理,计数资料以率(%)表示,比较采用 字2检验,相关性分析采用Pearson相关分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 胸腺瘤组与对照组c-myc及PTEN基因表达比较 胸腺瘤组c-myc基因阳性表达率高于对照组,PTEN基因阳性表达率低于对照组,比较差异均有统计学意义(P<0.01),见表1。
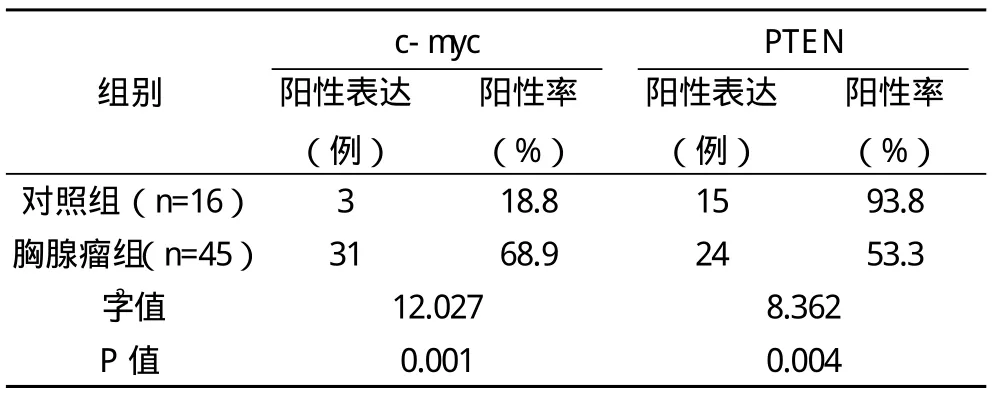
表1 胸腺瘤组与对照组c-myc及PTEN基因表达比较
2.2 不同恶性程度胸腺瘤c-myc及PTEN基因表达比较 恶性组c-myc基因阳性表达率高于良性组,PTEN基因阳性表达率低于良性组,比较差异均有统计学意义(P<0.05),见表2。

表2 不同恶性程度胸腺瘤c-myc及PTEN基因表达比较
2.3 不同侵袭性胸腺瘤c-myc及PTEN基因表达比较 侵袭性组c-myc基因阳性表达率高于非侵袭性组,PTEN基因阳性表达率低于非侵袭性组,比较差异均有统计学意义(P<0.01),见表3。
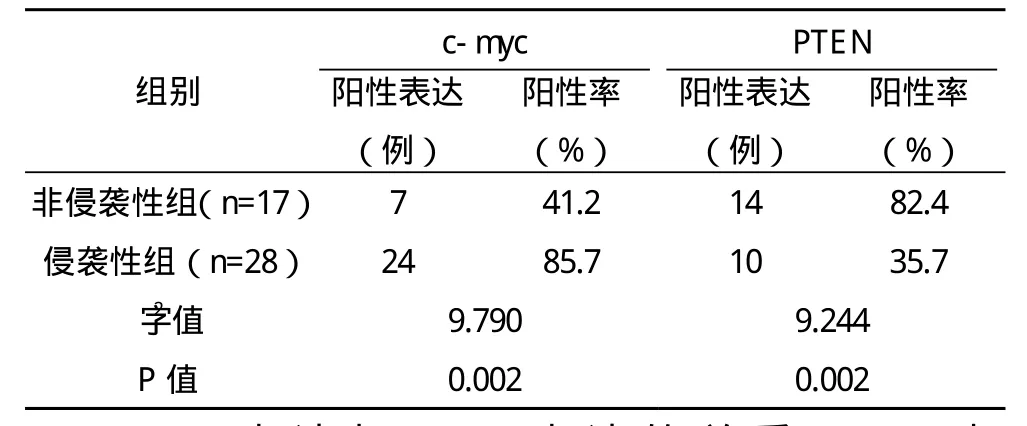
表3 不同侵袭性胸腺瘤c-myc及PTEN基因表达比较
2.4 PTEN表达与c-myc表达的关系 c-myc与PTEN 关 联 性 检 验 字2=8.562,P=0.003<0.01, 显 示PTEN基因表达与c-myc表达呈负相关,Pearson列联系数P=-0.436,见表4。

表4 PTEN表达与c-myc表达的关系 例
3 讨论
c-myc于1982年首先被发现,是髓细胞性白血病病毒癌基因V-myc的细胞同系物,随后被发现它的“癌基因化”在人类Burkit's淋巴瘤及多种动物和人类肿瘤中起着关键作用[6]。人类c-myc基因定位于染色体8q24(8号染色体长臂的2区4带),由3个外显子和2个内含子组成。c-myc是一个重要的癌基因,与细胞的持续增殖关系密切,在肿瘤发生过程中起重要作用,近来研究表明,c-myc基因作为一个经典的促癌蛋白参与细胞增殖、分化、衰老、凋亡和转化[7]。胡茜等[8]研究发现c-myc蛋白在宫颈癌组织中的阳性率56.9%,而在正常宫颈组织中的阳性率为25.0%,两者差异有统计学意义(P<0.05);Hirano等[9]用鼠白血病病毒A8感染小鼠7周,发现小鼠被诱导形成胸腺瘤,采用DNA印迹的方法检测出小鼠体内存在过表达的c-myc mRNA,说明上调的c-myc在胸腺瘤的形成中发挥重要作用。c-myc在人胸腺瘤中的表达国内已有报道:黄壮士等[10]研究显示c-myc在胸腺瘤中表达的阳性率为63.4%,而在非瘤胸腺组织中的表达16.7%,二者比较差异有统计学意义(P<0.01)。本研究显示,c-myc在胸腺瘤中的阳性表达率为68.9%(31/45),而在对照组中的表达率为18.8%(3/16),比较差异有统计学意义(P<0.01),结果表明过表达的c-myc基因参与了胸腺瘤的发生、发展。c-myc在Masaoka Ⅰ期胸腺瘤组织中的阳性表达率为41.2%(7/17),而在具有侵袭性的Ⅱ~Ⅳ期胸腺瘤组织中的表达率为85.7%(24/28),比较差异有统计学意义(P<0.01),表明c-myc的表达与胸腺瘤的侵袭性有关。c-myc在恶性胸腺瘤中阳性表达率为80.6%(25/31),在A型和AB型胸腺瘤中的阳性表达率为42.9%(6/14),比较差异有统计学意义(P<0.05),提示c-myc表达与胸腺瘤的恶性程度有关,检测c-myc将有助于胸腺瘤良恶性及侵袭性的判断。
PTEN基因位于染色体10q23.3(10号染色体长臂的2区3带3亚带),包括9个外显子,8个内含子,全长200 kb,含1209个核苷酸。PTEN基因是迄今发现的第一个具有磷酸酶活性的抑癌基因,它对细胞内信号传导通路的调控起关键作用,PTEN蛋白具有诱导细胞凋亡,抑制细胞周期进展,抑制细胞迁移、铺展和局部粘附等多种生理功能。大量实验资料证明PTEN与细胞增殖呈负相关,PTEN基因突变或缺失可导致细胞过度增殖,导致组织的恶变。国外已有研究表明,PTEN的缺失和突变与人类的许多肿瘤有关[11-13]。李冰[14]研究发现PTEN基因与肝癌的发生和发展以及进展有密切的联系,且组织的分化程度越高,PTEN的表达率也就越高,提示肝癌的发生可能与PTEN基因失活有关;管建云等[15]在研究PTEN与膀胱尿路肿瘤关系时发现:PTEN在膀胱尿路上皮细胞癌组织和正常膀胱黏膜组织中的阳性表达率分别是46.77%和100%,比较差异有统计学意义(P<0.05);且膀胱癌细胞分化程度越差,临床分期越高,PTEN阳性表达率就越低,比较差异有显著性(P<0.05)。提示膀胱尿路上皮细胞癌的发生、发展与PTEN的表达缺失有关。本研究显示,PTEN在对照组(非瘤胸腺组织)中阳性表达率为93.8%(15/16),在胸腺瘤中的阳性表达率为53.3%(24/45),两者比较差异有统计学意义(P<0.01)。说明PTEN的突变或缺失参与了胸腺瘤的发生。PTEN在恶性胸腺瘤中阳性表达率为41.9%,在良性胸腺瘤中的阳性表达率为78.6%,二者比较差异有统计学意义(P<0.05),提示PTEN表达与胸腺瘤的恶性程度有关。在具有侵袭性的Ⅱ~Ⅳ期胸腺瘤中PTEN阳性表达率为35.7%,而PTEN在非侵袭性胸腺瘤中的阳性表达率为82.4%,二者比较差异有统计学意义(P<0.01),提示PTEN表达与胸腺瘤的侵袭性有关。与国内相关研究结果一致[16-17]。Lilja等[18]研究发现,PTEN基因在鼠胚胎的成纤维细胞中能通过调节ras和c-myc基因从而抑制肿瘤的恶性行为。相关性分析显示,c-myc与PTEN在胸腺瘤中的表达呈负相关(P<0.01),Pearson列联系数为P=-0.436,提示癌基因c-myc及抑癌基因PTEN可能共同参与胸腺瘤的发生、发展,二者存在协同作用。
综上所述,人类肿瘤的发生是多种癌基因、抑癌基因协同作用的结果,包括癌基因的激活和抑癌基因的失活或突变等;本组资料显示,在胸腺瘤组织中存在c-myc基因过表达及PTEN基因失活,且c-myc基因与PTEN基因在胸腺瘤组织中的表达呈负相关。提示c-myc和PTEN基因在胸腺上皮细胞恶变过程中起协同作用,可能共同影响着胸腺瘤的发生、发展过程。二者的联合检测将有助于胸腺瘤良恶性及侵袭性的判断,并将为开发新的抗瘤药物和寻找新的基因治疗的靶基因提供线索和思路。
[1]伍建国,曹勇,陈恩碧,等.胸腺瘤中VEGF的表达与PI3K/AKT通路的相关性研究[J].中外医学研究,2013,11(17):5-7.
[2] Masaoka A,Monden Y,Nakahara K,et al.Follow-up study of thymomas with special reference to their clinical stages[J].Cancer,1981,48(11):2485-2492.
[3] Rosai J,Sobin L H.Histological typing of tumours of the thymus[M].Berlin:Spinger-Verlag,1999:65.
[4] Wang L Q,Ignat A,Axiotis C A.Differential expression of the PTEN tumor suppressor protein in fetal and adult neuroendocrine tissues and tumors:progressive loss of PTEN expression in poorly differentiated neuroendocrine neoplasms[J].Applied Immunohistochemistry&Molecular Morphology,2002,10(2):139-146.
[5] Simmons M L,Lamborn K R,Takahashi M,et al.Analysis of complex relationships between age,p53,epidermal growth factor receptor,and survival in glioblastoma patients[J].Cancer Res,2001,61(3):1122-1128.
[6] Spencer C A,Groudine M.Control of c-myc regulation in normal and neoplastic cells[J].Adv Cancer Res,1991,56(8):1-48.
[7] Li T,Tang L,Bian D,et al.Detection of hTERC and c-myc genes in cervical epithelial exfoliated cells for cervical cancer screening[J].Int J Mol Med,2014,3(5):1289-1297.
[8]胡茜,刘昆.CIP2A及c-myc在宫颈癌组织中的表达及相关性分析[J].重庆医学,2015,44(8):1072-1074.
[9] Hirano T,Watanabe R,Takase-Yoden S.Increased expression of c-myc is associated with thymoma in rats infected with murine leukemia virus A8[J].Microbiol Immunol,2005,49(12):1069-1074.
[10]黄壮士,张艳峰,曾涟乾,等.胸腺瘤组织中c-myc基因的表达及其意义[J].肿瘤防治研究,2006,33(12):865-867.
[11] Frisk T,Foukakis T,Dwinght T,et al.Silencing of the PTEN tumor-suppressor gene in anaplastic thyroid cancer[J]Genes Chromosomes Cancer,2003,35(1):74-80.
[12] Cordes I,Kluth M,Zygis D,et al.PTEN deletions are related to disease progression and unfavourable prognosis in early bladder cancer[J].Histopathology,2013,63(5):670-677.
[13]薛月梅,王志发.PTEN在消化道肿瘤中的研究进展[J].中国医学创新,2012,9(10):157-158.
[14]李冰.探究PTEN基因在肝癌组织中的表达[J].中外医学研究,2013,11(27):30.
[15]管建云,李军扩.PTEN在膀胱尿路上皮细胞癌中的表达及其临床意义[J].中国医学创新,2014,11(19):133-135.
[16]蔡彦力,黄杰,黄进启.PTEN表皮生长因子受体和Ki-67在胸腺瘤中的表达及其临床意义[J].中国胸心血管外科临床杂志,2008,15(2):108-112.
[17]黄壮士,石锋,付东宏,等.胸腺瘤组织中PTEN基因基质金属蛋白酶-2和基质金属蛋白酶-9的表达[J].中华肿瘤杂志,2010,32(1):37-39.
[18] Lilja J F,Wu D,Reynold R K,et al.Growth suppression activity of the PTEN tumor suppressor gene in human endometrial cancer cells[J].Anticancer Res,2001,21(3B):1969-1974.
