肿瘤抗原PIWIL2的HLA-A2限制性CTL表位鉴定*
2015-05-16时冉冉李伯和付陈增王建国漯河医学高等专科学校分子生物学实验室河南漯河462002
时冉冉,李伯和,袁 磊,付陈增,陈 娇,王建国(漯河医学高等专科学校分子生物学实验室,河南漯河 462002)
肿瘤抗原PIWIL2的HLA-A2限制性CTL表位鉴定*
时冉冉,李伯和,袁磊,付陈增,陈娇,王建国△
(漯河医学高等专科学校分子生物学实验室,河南漯河462002)
[摘要]目的:鉴定肿瘤抗原PIWIL2的人类白细胞抗原A2( HLA-A2)限制性细胞毒性T淋巴细胞( CTL)表位。方法:首先运用RT-PCR、Western blot方法检测PIWIL2在肿瘤细胞系MCF-7、SW480和HT-29中的表达情况,然后通过BIMAS、RankPep、NetMHC、NetCTL1. 2及IEDB软件预测打分来选取PIWIL2的HLA-A2限制性的表位。候选表位肽通过标准的Fmoc化学合成法合成,结合力实验用于检测候选表位与T2A2细胞表面HLA-A2分子的结合能力,ELISPOT实验检测候选表位肽诱导CTL分泌IFN-γ的能力,体外细胞毒性实验检测候选肽诱导CTL的能力。结果: PIWIL2在肿瘤细胞系MCF-7、SW480和HT-29中均有表达。候选肽P485、P493、P965具有中等结合力。ELISPOT实验结果显示表位肽P485和P965诱导的CTL具有分泌IFN-γ的能力。细胞毒性实验结果显示表位肽P485和P965对MCF-7细胞均有一定的杀伤作用。结论:表位肽P485和P965是优秀的PIWIL2抗原HLAA2限制性CTL候选表位,可能成为新的抗肿瘤多肽免疫治疗疫苗的候选表位。
[关键词]PIWIL2;人类白细胞抗原A2;细胞毒性T淋巴细胞
肿瘤的免疫治疗被认为是治疗肿瘤患者的一种理想选择,在所有免疫治疗的方法中,肿瘤特异性抗原表位诱导的细胞毒性T淋巴细胞( cytotoxic T lymphocyte,CTL)能够杀死表达抗原的肿瘤细胞[1]。诱发体内细胞毒性T淋巴细胞发挥抗肿瘤作用的并不是整个肿瘤抗原分子,而是与主要组织相容性复合物( major histocompability complex,MHC)分子结合的短肽即CTL表位,因此,寻找特异性肿瘤抗原及其相应的CTL表位成为肿瘤治疗的关键。在过去的20年里,肿瘤免疫治疗有着很大的进展,鉴定了许多肿瘤抗原的表位[2-3]。目前已经有多种抗原肽疫苗进入了临床试验,对来自于HER-2/neu、MAGE-A3、MART-1、TRP-2、gp100和NY-ESO-1等抗原的单个或混合表位肽疫苗均有较多的研究[4]。除此之外,bcr-abl多肽疫苗已开始Ⅱ期临床试验。对引发bcrabl肽特异CTL的多肽报道有17肽、16肽、12肽和9肽等多肽。肽作为肿瘤疫苗进行临床试验,研究较多的是恶性黑色素瘤。总的来讲,在转移性黑色素瘤患者中,有效率约在10%~30%之间,没有严重的不良反应发生。不同种类的肿瘤抗原CTL表位的鉴定推动了肿瘤治疗性疫苗的发展[5]。研究发现很多癌前干细胞表达PIWIL2,它属于癌睾抗原家族,PIWIL2广泛地表达于各种人类和小鼠肿瘤细胞中,在正常组织中仅存在于睾丸组织中,且特异性表达在生殖细胞的精原细胞和精母细胞期,PIWIL2直接参与了精细胞的形成和精母细胞的分化[6]。在中国的人群中,HLA-A2超型超过50%[7],所以鉴定PIWIL2 的HLA-A2限制性CTL表位对肿瘤的免疫治疗意义重大[8]。
材料和方法
1材料
T2A2细胞系、MCF-7( HLA-A2+)、SW480( HLAA2+)以及HT-29( HLA-A2-)由漯河医学高等专科学校分子医学实验室常规保存,采用37℃、5% CO2、饱和湿度培养条件下常规培养。外周血单个核细胞( peripheral blood mononuclear cells,PBMCs)由HLAA2+健康供者捐赠。
2方法
2.1PIWIL2在肿瘤细胞中的表达采用RT-PCR、Western blot法检测PIWIL2在肿瘤细胞MCF-7、SW480和HT-29的表达情况。PIWIL2的上游引物序列为5’-CCCAGGTTGTCAATGTTCG-3’,下游引物序列为5’-CAGGCTGTCCACAATCTCC-3’,产物大小278 bp,由上海生工生物工程技术服务有限公司合成。
2.2HLA-A2限制性CTL表位肽的预测结合BIMAS、RankPep、NetMHC、NetCTL1. 2及IEDB软件对PIWIL2氨基酸序列的预测打分。本次研究以A2超型为主,参数设定为CTL表位限制性MHC类型( HLA-A*0201),预测抗原肽长度。根据各个预测软件所推选的前30个优势表位进行综合选择,选出在各种软件打分较好的HLA-A2限制性表位。
2.3HLA-A2限制性CTL表位肽的合成、纯化、分析及质谱鉴定候选表位肽采用标准Fmoc方法合成,经HPLC分析纯化后,其纯度大于95%,质谱分析其相对分子质量符合理论值。
2.4表位肽与HLA-A2分子的结合力检测收集T2A2细胞,用无血清1640培养基洗3次,调整细胞浓度至1×109/L,每孔1 mL,每实验孔加入待测肽50 mg/L,β2微球蛋白(β2-microglobulin,β2-M) 2. 5 mg/L,37℃、5% CO2共孵育18 h后,冷PBS洗涤3次,加入500 μL稀释度为1∶100的单克隆抗体BB7. 2,4℃避光静置30 min。之后冷PBS洗涤3次,加入50 μL稀释度为1∶50的FITC-羊抗鼠溶液,4℃静置40 min,PBS洗涤1次后上流式细胞仪检测。其结果用荧光系数表示:荧光系数( FI) (表位肽平均荧光强度-背景平均荧光强度) /背景平均荧光强度。FI>1. 0表示高等结合力,1. 0>FI>0. 5表示中等结合力,FI<0. 5表示低结合力[9]。
2.5CTL的体外诱导抽取HLA-A2+健康供者的外周血,经常规聚蔗糖-泛影葡胺分层液梯度离心,获取PBMCs,用含10%胎牛血清的IMDM培养基调整细胞浓度为1. 5×109/L。第2天分别加入10 mg/L的候选肽共培养,第3天加入5×104U/L的rIL-2继续培养。每周收集细胞,1 000 r/min离心10 min,除去上清,加入新鲜的10%胎牛血清的IMDM培养基,同时加入上述条件的候选肽和rIL-2。刺激3轮后于最后一次刺激的第3天收集细胞。调整细胞浓度作为效应细胞。用无血清IMDM培养基调整细胞浓度作为靶细胞[10]。
2.6IFN-γ分泌水平检测取出ELISPOT板条,加200 μL无血清的IMDM培养基进行封闭,静置10 min;诱导的CTL作为效应细胞,荷肽的T2A2作为刺激细胞,细胞浓度均调整为2×109/L;设立对照孔、实验孔; 37℃、5% CO2孵育18 h;弃孔中培养基,每孔加入200 μL无菌的去离子水,4℃裂解细胞10 min;弃孔内液体,加入200 μL washing buffer进行洗涤,洗涤6次,每次停留60 s;加入100 μL生物素标记的抗体,37℃孵育1 h;弃孔内液体,加入200 μL washing buffer进行洗涤,洗涤方法同上,在吸水纸上拍干;加入100 μL酶联亲和素,37℃孵育1 h;每孔加入200 μL washing buffer进行洗涤,洗涤方法同上;加入100 μL现配的AEC显色液,25℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用ELISPOT图像分析仪计数96孔板中每孔的斑点数[11]。
2.7细胞毒活性检测调整CTL细胞浓度为5× 109/L;调整靶细胞MCF-7细胞浓度为1×108/L;按50∶1、25∶1和12. 5∶1的不同效靶比铺于96孔板中,同时设立效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、体积校正组和背景对照组,每孔终体积为100 μL。37℃、5% CO2培养4 h。于孵育结束前45 min,在靶细胞最大释放组及体积校正组中加入10 μL裂解液。1 000 r/min离心4 min,转移50 μL上清至另一干净96孔板中,每孔加入50 μL底物混合液,室温避光孵育30 min;再加入50 μL/孔终止液。用酶标仪检测其在490 nm波长处的吸光度值。杀伤率= (实验孔值-效应细胞自发释放值-CTL自发释放值) /(靶细胞值-效应细胞自发释放值)×100%[12]。
3统计学处理
用Graphpad Prism 5. 0统计软件进行分析。数据均采用均数±标准差( mean±SD )表示。2组间采用单因素方差分析( one-way ANOVA),以P<0. 05为差异有统计学意义。
结果
1 PIWIL2在肿瘤细胞系中的表达
分别使用RT-PCR以及Western blot的方法检测PIWIL2在肿瘤细胞系中的表达。从图1中可以看出,PIWIL2 mRNA及蛋白在MCF-7、SW480和HT-29 这3种肿瘤细胞系中均有表达。

Figure 1.Expression of PIWIL2 mRNA( A) and protein( B) in cancer cell lines.图1 肿瘤细胞系中PIWIL2的表达
2 PIWIL2 HLA-A2限制性CTL表位的预测结果
依据BIMAS、RankPep、NetMHC、NetCTL1. 2及IEDB共5个预测软件的结果,选取在各个预测软件中分值排名靠前的表位肽,根据这5个预测软件进行综合打分,筛选出分值在各个软件中打分较好的CTL表位肽,共8条,见表1。
3表位肽/HLA-A2分子结合力的实验结果
使用流式细胞术进行检测,对所得到的数据进行处理,结果表明P376、P555、P756和P767具有弱结合力( FI<0. 5) ; P485、P493和P965具有中等结合力( FI>0. 5),见表1。

表1 PIWIL2 HLA-A2限制性CTL表位预测和结合力实验结果Table 1.Prediction scores of the peptide derived from PIWIL2 and the data of the binding affinity
4 IFN-γ分泌的水平
从健康供者外周血中分离得到PBMCs,体外用多肽作为刺激物对PBMCs进行刺激,经过一系列处理,并且体外培养11 d后,用ELISPOT法通过特异性抗体对刺激后的PBMCs所分泌的IFN-γ进行检测。以空载T2A2和荷肽T2A2作为靶细胞,通过计数板中的细胞斑点数目,来检测分泌IFN-γ CTL的细胞数,以此来判断多肽诱导的特异性CTL分泌IFN-γ的能力。根据结合力的实验结果,我们选择了3条具有中等结合力的多肽进行实验,即P485、P493 和P965。结果显示P485和P965多肽疫苗能检测到特异性T细胞免疫,能分泌较多的IFN-γ,见图2。
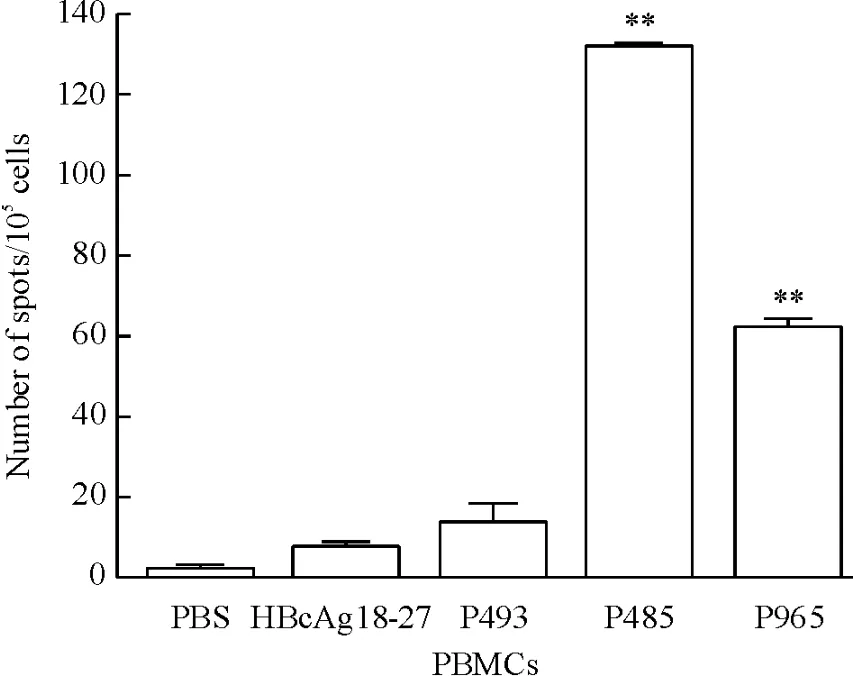
Figure 2.IFN-γ release was measured by ELISPOT assay in CTLs induced PBMCs of healthy donors.CTL-induced by PBS and irrelevant peptide HBcAg 18~27 were taken as negative control.Means±SD.n = 3.**P<0. 05 vs HBcAg 18-27.图2 ELISPOT法PIWIL2候选表位肽特异性CTL分泌IFN-γ的能力
5 细胞毒实验结果
根据IFN-γ分泌水平结果,我们将有效果的P485、P965行进一步的免疫活性检测,P485、P965两条候选肽诱导得到的CTL在不同效靶比( 12. 5∶1,25∶1,50∶1)时对PIWIL2表达阳性的乳腺癌细胞MCF-7( HLA-A2+)的杀伤情况。P485、P965两条候选肽诱导得到的CTL在效靶比为50∶1时对靶细胞的杀伤率分别是( 37. 5±3. 3) %和( 32. 9±3. 6) %,而对照组PBS和无关肽组HBcAg 18-27在效靶比为50∶1时对靶细胞的杀伤率分别为( 2. 8±1. 8) %和( 2. 2±1. 3) %。

Figure 3.The cytotoxic effects of the CTLs induced by P485 and P965 on the MCF-7 ( HLA-A2+) cells.Means±SD.n =3.**P<0. 01 vs HBcAg 18-27 group.图3 P485、P965候选肽诱导得到的CTL在不同效靶比时对靶细胞MCF-7的杀伤情况
讨论
肿瘤的免疫治疗目的是以提高病人自身的免疫力,诱发机体自身抗肿瘤免疫反应,杀伤或抑制肿瘤细胞,在肿瘤的预防与治疗当中发挥了重要的作用,制备高效的肿瘤疫苗已成为早期诊断和免疫治疗的热点[13-14]。利用细胞免疫治疗癌症中,T细胞表位发挥了重要的角色。许多临床试验已经获得了比较有前景的实验结果[8-10]。关于肿瘤诊断用的肿瘤标记分子近年来已有许多报道。细胞介导肿瘤免疫治疗的效果取决于免疫刺激的策略和有潜力的肿瘤抗原T细胞表位的筛选[1]。T细胞表位的鉴定不仅仅用于新疫苗的发展,也有助于理解肿瘤抗原的提呈方式[15-16]。然而,仍然有很多问题需要解决,例如表位低免疫原性和体内快速的蛋白降解。这些可以用化学改造的方式来提高其免疫原性和稳定性[17]。在蛋白疫苗的基础上,通过对肿瘤抗原编码基因的序列分析,分析其被CD8+识别的抗原表位,构建多肽疫苗,能够加强HLA和TCR的结合,而且还可以通过氨基酸替换、改变肽的构象以及修饰氨基酸残基等方法提高肽的免疫原性[18]。
有很多生物信息学的方法可进行T细胞表位的预测。在本次研究中,我们选择了5个预测软件BIMAS、RankPep、NetMHC、NetCTL1. 2及IEDB,综合这些预测软件的打分结果进行初步的表位预测筛选,BIMAS的预测侧重于表位肽与HLA分子结合的稳定性方面,IEDB是基于序列的线性表位预测工具,NetCTL1. 2综合了表位肽与HLA分子的结合力、蛋白酶体降解以及TAP呈递效率这些方面来预测表位。这些软件主要从MHC分子与表位肽的结合进行预测,从而筛选出亲和力较高的表位肽。使用生物信息学软件的初步筛选,排除打分较低的候选表位,避免不必要的实验,减轻了工作量,提高了科研效率。根据结合力实验结果筛选出3条具有中等结合力的表位肽,即P485、P493、P965。随后对这3条肽进行体外免疫活性检测,通过ELISPOT实验,我们可以检测出抗原特异性CTL的数量及IFN-γ的分泌量。结果显示P485、P965多肽疫苗能检测到特异性T细胞免疫,能分泌较多的IFN-γ。并且通过细胞毒性实验表明,这2条肽对靶细胞MCF-7具有杀伤作用。说明表位肽诱导的CTL对靶细胞MCF-7有杀伤作用。鉴定的优势表位为肿瘤的多表位疫苗设计和免疫治疗提供了新的候选表位,并且也有多表位疫苗在过继性免疫治疗和临床应用提供了支持[19]。
[参考文献]
[1]Kessler JH,Melief CJ.Identification of T-cell epitopes for cancer immunotherapy[J].Leukemia,2007,21 ( 9) : 1859-1874.
[2]Rosenberg SA,Restifo NP,Yang JC,et al.Adoptive cell transfer: a clinical path to effective cancer immunotherapy [J].Nat Rev Cancer,2008,8( 4) : 299-308.
[3]Blattman JN,Greenberg PD.Cancer immunotherapy: a treatment for the masses[J].Science,2004,305 ( 5681) : 200-205.
[4]Amadori D,Milandri C,Comella G,et al.A phase I/II trial of non-pegylated liposomal doxorubicin,docetaxel and trastuzumab as first-line treatment in HER-2-positive locally advanced or metastatic breast cancer[J].Eur J Cancer,2011,47( 14) : 2091-2098.
[5]Bredenbeck A,Losch FO,Sharav T,et al.Identification of noncanonical melanoma-associated T cell epitopes for cancer immunotherapy[J].J Immunol,2005,174( 11) : 6716-6724.
[6]Seto AG,Kingston RE,Lau NC.The coming of age for Piwi proteins[J].Mol Cell,2007,26( 5) : 603-609.
[7]Xue F,Wang J,Hu P,et al.Identification of spatial genetic boundaries using a multifractal model in human population genetics[J].Hum Biol,2005,77( 5) : 577-617.
[8]Uenaka A,Hirano Y,Hata H,et al.Cryptic CTL epitope on a murine sarcoma Meth A generated by exon extension as a novel mechanism[J].J Immunol,2003,170( 9) : 4862-4868.
[9]Zhu YH,Gao YF,Chen F,et al.Identification of novel T cell epitopes from efflux pumps of Mycobacterium tuberculosis[J].Immunol Lett,2011,140( 1-2) : 68-73.
[10]Wu ZY,Gao YF,Wu YH,et al.Identification of a novel CD8+T cell epitope derived from cancer-testis antigen MAGE-4 in oesophageal carcinoma[J].Scand J Immunol,2011,74( 6) : 561-567.
[11]Liu W,Zhai M,Wu Z,et al.Identification of a novel HLA-A2-restricted cytotoxic T lymphocyte epitope from cancer-testis antigen PLAC1 in breast cancer[J].Amino Acids,2012,42( 6) : 2257-2265.
[12]Zhu B,Chen Z,Cheng X,et al.Identification of HLAA*0201-restricted cytotoxic T lymphocyte epitope from TRAG-3 antigen[J].Clin Cancer Res,2003,9 ( 5) : 1850-1857.
[13]袁磊,陈旭东,范文娟,等.沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化[J].中国病理生理杂志,2013,29( 6) : 1014-1019.
[14]袁磊,左曙光,范文娟,等.IGFBP7对人乳腺癌MCF-7细胞增殖的影响及其机制[J].中国病理生理杂志,2012,28( 10) : 1835-1840.
[15]Goonetilleke N,Moore S,Dally L,et al.Induction of multifunctional human immunodeficiency virus type 1 ( HIV-1 ) -specific T cells capable of proliferation in healthy subjects by using a prime-boost regimen of DNA-and modified vaccinia virus Ankara-vectored vaccines expressing HIV-1 Gag coupled to CD8+T-cell epitopes[J].J Virol,2006,80( 10) : 4717-4728.
[16]Salmon-Ceron D,Durier C,Desaint C,et al.Immunogenicity and safety of an HIV-1 lipopeptide vaccine in healthy adults: a phase 2 placebo-controlled ANRS trial [J].AIDS,2010,24( 14) : 2211-2223.
[17]Shi RR,Liu J,Zou Z,et al.The immunogenicity of a novel cytotoxic T lymphocyte epitope from tumor antigen PL2L60 could be enhanced by 4-chlorophenylalanine substitution at position 1[J].Cancer Immunol Immunother,2013,62( 11) : 1723-1732.
[18]彭松,贝俊杰,胡厚源,等.融合蛋白TAP-SSLS对激活的血小板与人淋巴细胞结合的影响[J].中国病理生理杂志,2015,31( 1) : 23-27.
[19]Wu YH,Gao YF,He YJ,et al.A novel cytotoxic T lymphocyte epitope analogue with enhanced activity derived from cyclooxygenase-2[J].Scand J Immunol,2012,76 ( 3) : 278-285.
Identification of HLA-A2 restricted cytotoxic T lymphocyte epitopes from tumor antigen PIWIL2
SHI Ran-ran,LI Bo-he,YUAN Lei,FU Chen-zeng,CHEN Jiao,WANG Jian-guo
( Laboratory of Molecular Biology,Luohe Medical College,Luohe 462002,China.E-mail: ranranpeptide@163.com)
[ABSTRACT]AIM: To identify the human leucocyte antigen A2 ( HLA-A2) restricted cytotoxic T lymphocyte ( CTL) epitopes from tumor antigen PIWIL2.METHODS: RT-PCR and Western blot was used to determine the expression of PIWIL2 in cancer cell lines MCF-7,SW480 and HT-29.HLA-A2 epitopes from PIWIL2 protein were predicted by the software of BIMAS,RankPep,NetMHC,NetCTL1. 2 and IEDB.The peptides were synthesized by standard solid-phase methods.The binding affinity of the peptides to HLA-A2 molecules was evaluated by T2 cells binding assay.ELISPOT assay was used to investigate the levels of IFN-γ.The cytotoxicity assay in vitro was also used to determine the ability of inducing T cell response by the peptides.RESULTS: The expression of PIWIL2 was observed in MCF-7,SW480 and HT-29.The candidate peptide P485,P493 and P965 showed moderate affinity toward HLA-A2 molecule.ELISPOT assay showed P485 and P965 induced CTLs of IFN-γ release form CTLs.The CTLs induced by P485 and P965 lysed the MCF-7 cells.CONCLUSION: The peptides P485 and P965 are excellent HLA-A2 restricted cytotoxic T lymphocyte epitopes from the tumor antigen PIWIL2,which could serve as new candidates towards antitumor peptide vaccines.
[KEY WORDS]PIWIL2; Human leucocyte antigen A2; Cytotoxic T lymphocytes
通讯作者△Tel: 0395-2112681; E-mail: ranranpeptide@163.com
*[基金项目]河南省科技发展计划资助项目( No.142102310466) ;漯河医学高等专科学校科研基金资助项目( No.2014-SLMC09)
[收稿日期]2014-11-27[修回日期]2015-02-02
[文章编号]1000-4718( 2015)07-1315-05
[中图分类号]Q279
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.029
