酪酸梭菌预防小鼠幽门结扎型胃溃疡的机制研究*
2015-05-16林刻智孔咪咪曾静静黄珏伟王蕾蕾徐昌隆王方岩温州医科大学基础医学院第一临床学院检验医学院生命科学学院第二临床学院附属第二医院浙江温州000
林刻智,赵 娜,孔咪咪,章 壮,曾静静,黄珏伟,王蕾蕾,徐昌隆,王方岩(温州医科大学基础医学院,第一临床学院,检验医学院生命科学学院,第二临床学院,附属第二医院,浙江温州000)
酪酸梭菌预防小鼠幽门结扎型胃溃疡的机制研究*
林刻智1▲,赵娜2▲,孔咪咪3,章壮3,曾静静3,黄珏伟2,王蕾蕾4,徐昌隆5,王方岩1△
(温州医科大学1基础医学院,2第一临床学院,3检验医学院生命科学学院,4第二临床学院,5附属第二医院,浙江温州325000)
[摘要]目的:建立小鼠幽门结扎型胃溃疡( gastric ulcer,GU)模型,观测酪酸梭菌( C.butyricum)对GU的预防作用并探讨其机制。方法:将40只ICR小鼠随机分为假手术组、模型组、奥美拉唑预防给药组和C.butyricum预防给药组。采用小鼠胃幽门结扎的方法建立GU模型,测量各组胃游离黏液量、胃液的pH、胃蛋白酶活性,并做常规HE染色观察胃组织的病理形态学变化,糖原( PAS)染色法观察胃组织糖原含量的变化,采用免疫组化检测胃黏膜组织中Bax、Bcl-2蛋白表达水平。结果: HE及PAS染色结果表明,C.butyricum预防能够显著减轻胃粘膜的损伤,其效果与奥美拉唑相当。与模型组相比,C.butyricum组胃液的pH显著升高( P<0.01) ;胃蛋白酶活性下降( P<0.05),但其效果不如奥美拉唑组( P<0.01) ;胃游离黏液量升高( P<0.01),糖原染色加深,与奥美拉唑组相比明显增多; Bax蛋白表达量降低( P<0.01)但Bcl-2蛋白表达水平显著上调( P<0.01)。结论: C.butyricum对小鼠幽门结扎型GU具有较好的预防作用,其机制可能与抑制胃酸分泌、胃蛋白酶活化,尤其是增加胃游离黏液的产生以及诱导bcl-2、抑制bax基因表达有关。
[关键词]酪酸梭菌;幽门结扎;胃溃疡模型; Bax; Bcl-2
▲并列第1作者
胃溃疡( gastric ulcer,GU)属于最常见的一种消化性溃疡。世界上约有10%的人在一生中的某一阶段会患此病,约1%可转化为胃癌[1],故活动期的GU 被WHO列入癌前病变,严重威胁人类健康。因此,如何选择GU的治疗方法及预防措施至关重要。
GU形成的机制自1910年Schwartz提出“无酸无溃疡”学说开始到现在涌现了一些学说,但目前普遍被接受的是由Mark等[2]提出的攻击因子与防御因子失衡学说。其中,攻击因子主要指胃酸、胃蛋白酶等,防御因子主要指黏液-碳酸氢盐屏障、黏膜屏障等,但在溃疡发生中起主要作用的仍认为是胃酸。同时临床研究表明,GU患者普遍存在慢性幽门螺杆菌感染( helicobacter pylori,Hp)和非甾体抗炎药物( nonsteroidal anti-inflammatory drugs,NSAIDs)长期使用的情况[3]。根据上述GU的发病机理,目前临床上治疗GU的药物主要包括抑酸药、黏膜保护剂和抗Hp感染药物。但是,由于Hp耐药性的增强[4-5]、质子泵抑制剂的不良反应如肝损害、自身免疫性疾病[6-7]的逐渐发现及GU复发率的升高[8],使GU的治疗越来越困难。
酪酸梭菌( Clostridium butyricum,C.butyricum)是一种革兰阳性厌氧芽孢杆菌,广泛存在于人和动物的肠道与粪便、奶酪及天然酸奶中。它的生化反应活泼,抵抗力强,可耐胃酸的腐蚀、胆汁酸和消化液的消化。这些特性使它在腹泻、肠道其它疾病的预防或治疗中都得到广泛的应用。但是,C.butyricum在GU方面的研究较少。在2000年,Takahashi m等[9]证实了C.butyricum能拮抗Hp。这为我们研究C.butyricum对GU的预防作用提供了有利的理论基础。现在普遍认为导致GU的主要原因是胃酸的增多,所以本研究采用的是小鼠幽门结扎型GU模型,观察C.butyricum对小鼠胃黏膜的影响并检测相关的指标,以探讨C.butyricum对幽门结扎型GU的防治作用及其机制,为开发C.butyricum新的临床应用提供实验基础。
材料和方法
1动物
健康雄性ICR鼠( SPF级),体重25~30 g,由温州医科大学实验动物中心提供。
2药品与试剂
C.butyricum(本实验室保藏菌株CGMCC No.
8808) ; TPY液体培养基(青岛海博生物技术) ;注射用奥美拉唑钠(江苏奥赛康药业股份有限公司) ;阿利新蓝(上海化学试剂公司分装) ;伊红Y(上海索莱宝生物科技有限公司) ;糖原( PAS)染液试剂盒(南京建成生物工程研究所) ; Bcl-2抗体( Bioworld) ; Bax抗体( Biovision) ;山羊抗兔Ⅱ抗、Harris苏木素染液和DAB显色液(北京中杉金桥生物技术有限公司)。
3方法与步骤
3.1动物分组及模型复制将40只ICR雄性小鼠随机平均分为4组,即假手术组、模型组(培养基每只0.4 mL)、奥美拉唑组( 13 mg/kg)和C.butyricum 组(每只5×108cfu)。采用Shay’s幽门结扎法,每日灌胃给药1次,连续5 d,在末次给药后饥饿24 h,开始造模。麻醉小鼠,自剑突沿腹中线切开腹壁,切口约2~3 cm,在左侧肋缘部位,用手指轻轻往上推,使胃暴露在切口处,小心避开血管,在幽门下穿线将幽门结扎,剪线后送回,逐层缝合切口,消毒后,将小鼠放入37℃恒温箱里,直至小鼠苏醒后,将小鼠放回饲养笼,禁食禁水20 h。
3.2标本采集造模后取小鼠的胃,收集胃液于离心管中,以3 000 r/min离心10 min,取得上清液置于储存管中用于后续胃游离黏液量、pH值及胃蛋白酶活性的测定。小鼠的胃用冰生理盐水洗净后,浸入4%多聚甲醛中固定,制作石蜡切片,用于常规的病理染色与免疫组化。
3.3胃游离黏液量、胃液pH值和胃蛋白酶活性的检测在0.2 mL的胃液上清液中加入0.02 mL 10 g/L的阿利新蓝溶液和0.66 mL pH5.8的柠檬酸-磷酸二氢钠缓冲液,再加蒸馏水至1.0 mL,混匀后室温下静置24 h,2 500 r/min离心10 min,取上清液测量波长为615 nm处的吸光度( A)值。利用公式计算出游离黏液量:游离黏液量( g/L) = 1.0-样品管A 值/标准管A值[10]。取0.5 mL的胃液,用蒸馏水稀释成5 mL,用pH计测量其pH值,胃液的pH值为测得的pH值减1。使用Mett毛细玻管法[10]测定胃蛋白酶活性。精密量取胃液1 mL,置于50 mL三角烧瓶中,并加入0.05 mol/L盐酸溶液15 mL摇匀,放入长2 cm的蛋白管2根,密闭烧瓶口,37℃孵育。24 h后,测量蛋白管两端透明部分的长度( mm),求四端之值的平均值,按公式:蛋白酶的单位=平均值2×16,计算胃蛋白酶活性。
3.4HE和PAS染色取胃窦部胃组织固定后石蜡包埋后制作0.5 μm的切片,做常规的HE染色,光镜下观察各组胃黏膜及整体的改变。糖原染色即过碘酸雪夫氏染色,具体操作按试剂盒说明书进行。显紫红色即为PAS染色阳性。
3.5免疫组化实验将石蜡切片进行脱蜡、梯度乙醇复水、经H2O2阻断内源性过氧化物酶、抗原修复、羊血清封闭等步骤,然后滴加I抗工作液4℃静置过夜,最后滴加山羊抗兔Ⅱ抗、DAB显色、苏木素复染、脱水、透明、封片,于光学显微镜下观察目的蛋白的表达情况。
4统计学处理
各组的数据均采用SPSS 17.0处理,数据结果用均数±标准差( mean±SD)表示。方差齐性者采用LSD法分析,不齐者采用Tamhane’s T2分析,以P<0.05为差异有统计学意义。采用SigmaPlot 12.3进行作图分析。
结果
1 C.butyricum对胃的病理变化的影响
1.1HE染色假手术组的胃壁结构完整,腺体排列整齐,胃组织内未见异常的脱落细胞;模型组胃壁的4层结构被破坏,但损伤最严重的是胃黏膜层,黏膜层细胞脱落,上皮出现缺损及裂缝,有炎细胞的浸润,同时腺体被破坏,腺腔内出现坏死的上皮细胞碎片,黏膜细胞也发生了变化,胞浆染色异常;奥美拉唑组的胃壁结构基本完整,胃黏膜层尤其是上皮损伤较小,较完整,腺体排列较为整齐,总体损伤的程度低于模型组; C.butyricum组胃壁的结构基本完整,同奥美拉唑组相比,胃黏膜层的上皮损伤更小,腺体排列整齐,胃黏膜的损伤程度明显低于模型组,见图1。

Figure 1.Pathological changes of the gastric mucosa ( HE staining).S: sham operation group; M: model group; C: C.butyricum group; O: omeprazole group.图1 HE染色显示的胃黏膜的病理变化
1.2糖原染色与模型组相比,奥美拉唑组胃黏膜糖原的含量明显增多,而C.butyricum组胃黏膜糖原含量显著高于模型组,较奥美拉唑组的效果略好,见图2。结果表明,C.butyricum可能通过分泌胃游离黏液保护胃黏膜。

Figure 2.Pathological changes of gastric mucosa ( PAS staining).S: sham operation group; M: model group; C: C.butyricum group; O: omeprazole group.图2 糖原染色显示的胃黏膜的病理变化
2 C.butyricum对胃游离黏液量、胃液pH值及胃蛋白酶活性的影响
由表1可以看出,C.butyricum预处理后,胃液的pH值、胃游离黏液量较模型组明显升高而胃蛋白酶活性则显著降低( P<0.01)。奥美拉唑组的各项指标较模型组也有显著改善( P<0.05),尤其是pH值提高显著。与奥美拉唑组比,C.butyricum组的pH值更低而胃蛋白酶活性更高,但游离黏液却升高,差异均有统计学意义( P<0.01)。
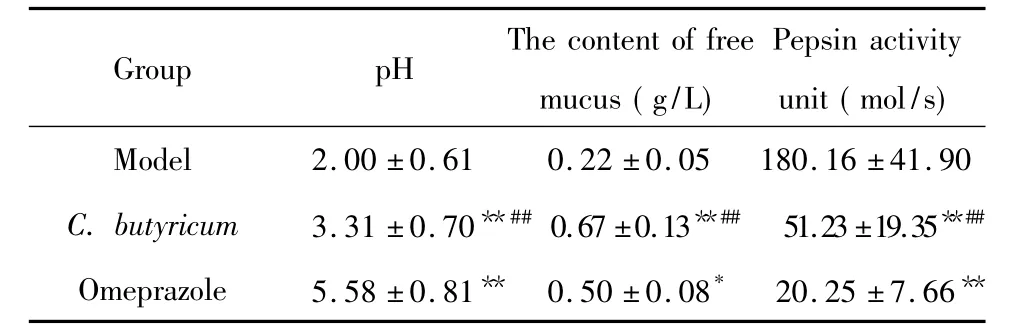
表1 C.butyricum对幽门结扎型GU胃液pH值、游离黏液量及胃蛋白酶活性的影响Table 1.The effect of C.butyricum on the gastric juice pH,the content of free mucus and the activity of pepsin in pylorus ligated gastric ulcer ( Mean±SD.n =10)
3 C.butyricum对小鼠胃黏膜Bax、Bcl-2表达的影响
3.1Bax蛋白的表达情况免疫组化染色可见假手术组Bax呈阴性表达,模型组胃黏膜固有层细胞胞浆可见高表达的Bax蛋白,呈深棕色。与模型组相比,奥美拉唑组的Bax蛋白的表达明显降低( P<0. 01),C.butyricum组Bax蛋白的表达量也明显下降( P<0.01),且下降程度强于奥美拉唑组( P<0. 01),见图3。
3.2Bcl-2蛋白的表达情况假手术组Bcl-2呈阴性,模型组可见低表达的Bcl-2蛋白,主要位于破损的黏膜上层细胞胞浆,呈棕色;同样,奥美拉唑组Bcl-2蛋白也低,与模型组相比差异无统计学意义,而C.butyricum组Bcl-2蛋白的表达水平同模型组和奥美拉唑组相比显著升高( P<0.01),见图4。
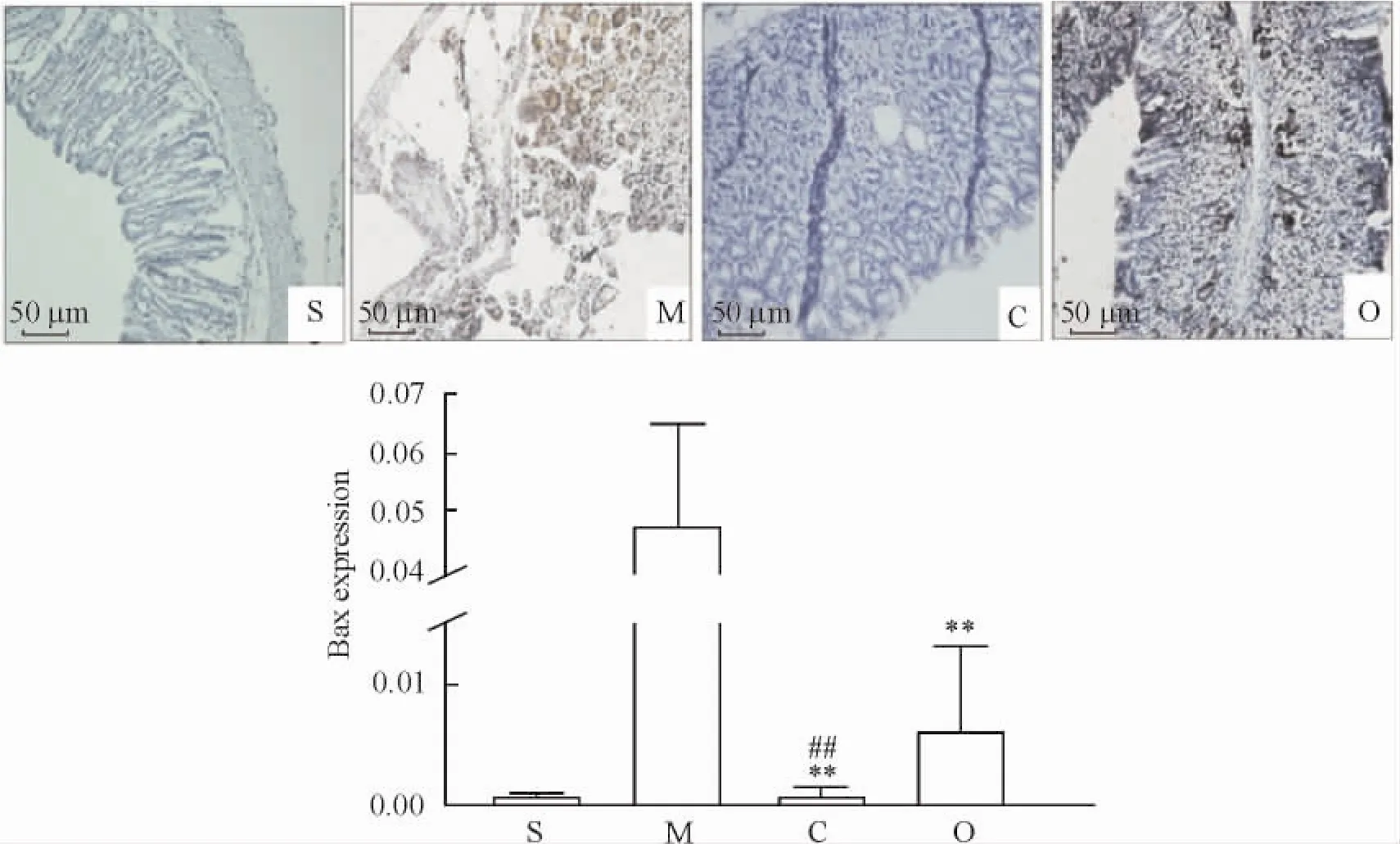
Figure 3.The protein expression of Bax in the gastric mucosa detected by immunohistochemical staining.S: sham operation group; M: model group; C: C.butyricum group; O: omeprazole group.Mean±SD.n =10.**P<0.01 vs model group;##P<0.01 vs omeprazole group.图3 免疫组化分析胃黏膜Bax蛋白的表达
讨论
幽门结扎型GU,通过胃的幽门部结扎,致使胃酸与胃蛋白酶在胃内潴留,胃的攻击因子作用加强而防御机制减弱,易被胃酸腐蚀、胃蛋白酶消化,最终导致溃疡的形成[11]。本实验通过HE染色和PAS染色对胃黏膜的损伤进行评价,发现C.butyricum对小鼠幽门结扎型GU有明显的保护作用。我们通过对胃液中的pH、胃蛋白酶活性测定发现,C.butyricum能够抑制胃酸、胃蛋白酶的分泌,但其活性显著弱于奥美拉唑。该结果提示C.butyricum的胃黏膜保护作用,不同于奥美拉唑等抑酸剂。为了深入探究该菌的抗GU机制,我们检测了胃液内的游离黏液含量,发现较奥美拉唑相比,C.butyricum能够更明显地促进胃游离黏液的生成。游离黏液的量能够提示胃黏膜细胞的功能,间接反应胃黏膜屏障的功能。该结果提示增强胃黏膜的屏障功能是C.butyricum预防效应的重要机制。目前临床上,在胃黏膜损伤防治方面过度地依赖抑酸剂,而加强屏障功能方面较为薄弱,能够促进黏膜屏障功能修复的手段更少。C.butyricum在增强黏膜屏障方面的作用正是临床上急需的。
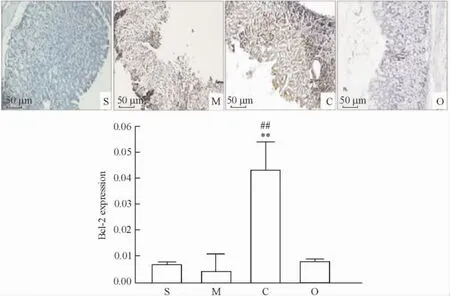
Figure 4.The protein expression of Bcl-2 in the gastric mucosa detected by immunohistochemical staining.S: sham operation group; M: model group; C: C.butyricum group; O: omeprazole group.Mean±SD.n =10.**P<0.01 vs model group;##P<0.01 vs omeprazole group.图4 免疫组化分析胃黏膜Bcl-2蛋白的表达
bcl-2与bax是最具代表性的细胞凋亡相关基因,多项研究证实,bcl-2基因的产物Bcl-2蛋白是一种重要的抗凋亡蛋白,bax基因的产物Bax蛋白是一种重要的促凋亡蛋白。2种蛋白在GU的发生与愈合过程中的表达水平会发生变化。在GU发生时,Bax蛋白表达量增加,Bcl-2与Bax蛋白的比值下降;而溃疡愈合时,Bcl-2蛋白表达水平升高,Bcl-2与Bax蛋白的比值则上升[12]。为更深入地研究C.butyricum的黏膜屏障保护机制,本研究检测了胃黏膜bcl-2和bax基因的表达情况。结果发现,奥美拉唑组的Bax表达量较低,表明奥美拉唑的抗损伤作用,而Bcl-2的量较正常组则未有大的改变,该结果说明奥美拉唑对Bcl-2的表达没有调控作用,而这与奥美拉唑的通过抑酸发挥保护作用的机制相匹配。与模型组相比,C.butyricum组的Bax蛋白的表达量较模型组显著降低,而Bcl-2蛋白的表达明显上调。该结果说明C.butyricum可能通过激活bcl-2基因的表达,抑制bax基因的表达,调控Bcl-2与Bax蛋白的比值,从而抑制胃黏膜细胞凋亡。C.butyricum作为益生菌能够通过多重的机制发挥保护效应,是一种非常有趣而具有实际应用价值的GU防治手段。我们分析C.butyricum可能通过最主要的代谢产物丁酸实现对GU的预防作用。丁酸是一种具有强大组蛋白去乙酰化酶抑制功能的短链脂肪酸[13],能够调控蛋白的表达。该菌对Bcl-2和Bax表达的调控可能与丁酸有关,但仍需实验证实。
综上,C.butyricum通过对胃酸、胃蛋白酶的抑制减轻损伤因素;通过促进胃黏液分泌以及调控Bcl-2和Bax的表达,增强黏膜上皮的抗损伤能力,增加胃的黏膜屏障功能,实现对GU的预防作用。C.butyricum已广泛用于临床,如治疗多种原因引起的腹泻、肠道炎症等疾病[14]。C.butyricum对幽门螺旋杆菌的抑制效应结合本文发现的对幽门结扎型GU的预防效应,将使得该菌在临床上防治GU成为可能。
[参考文献]
[1]廖威.中西医对消化性溃疡发病的认识与治疗研究进展[J].辽宁中医杂志,2009,36( 11) : 1868-1870.
[2]Mark IN,Shay H.Observations on the pathogenesis of gastric ulcer[J].Lancet,1959,1( 7083) : 1107-1111.
[3]Wallace JL.Prostaglandins,NSAIDs,and gastric mucosal protection: why doesn't the stomach digest itself[J].Physiol Rev,2008,88( 4) : 1547-1565.
[4]胡伏莲.中国幽门螺杆菌耐药研究现状[J].胃肠病学和肝病学杂志,2008,17( 7) : 517-518.
[5]Graham DY,Fischbach L.Helicobacter pylori treatment in the era of increasing antibiotic resistance[J].Gut,2010,59( 8) : 1143-1153.
[6]陈翠.常用质子泵抑制剂的不良反应综述[J].黑龙江医学,2013,37( 4) : 301-303.
[7]任晓琴,杜宏国,陈霞玲.质子泵抑制剂的研究进展[J].甘肃科技,2014,30( 2) : 26-28.
[8]刘文忠.难治性和复发性消化性溃疡的处理[J].胃肠病学,2011,16( 4) : 193-195.
[9]Takahashi M,Taguchi H,Yamaguchi H,et al.Studies of the effect of Clostridium butyricum on Helicobacter pylori in several test models including gnotobiotic mice[J].J Med Microbiol,2000,49( 7) : 635-642.
[10]徐静华,赵宇庆.姜辣素对动物实验性胃溃疡的影响[J].沈阳医科大学学报,2011,28( 3) : 221-225.
[11]Young OT,Ok AB,Jung JE,et al.Accelerated ulcer healing and resistance to ulcer recurrence with gastroprotectants in rat model of acetic acid-induced gastric ulcer [J].J Clin Biochem Nutr,2008,42( 3) : 204-214.
[12]Halabi MF,Shakir RM,Bardi DA,et al.Gastroprotective activity of ethyl-4-[( 3,5-di-tert-butyl-2 -hydroxybenzylidene) amino]benzoate against ethanol-induced gastric mucosal ulcer in rats[J].PLoS One,2014,9 ( 5) : e95908.
[13]Rada-Iglesias A,Enroth S,Ameur A,et al.Butyrate mediates decrease of histone acetylation centered on transcription start sites and down-regulation of associated genes [J].Genome Res,2007,17( 6) : 708-719.
[14]李碧云,傅思武,王金丰.酪酸梭菌的研究进展[J].中国微生态学杂志,2013,25( 1) :112-114.
Preventive effects of Clostridium butyricum on gastric ulceration induced by pylorus ligature in mice
LIN Ke-zhi1,ZHAO Na2,KONG Mi-mi3,ZHANG Zhuang3,ZENG Jing-jing3,HUANG Jue-wei2,WANG Lei-lei4,XU CHang-long5,WANG Fang-yan1
(1School of Basic Medical Sciences,2The First Clinical Medical College,3School of Medical Laboratory Science and Life Science,4The Second Clinical Medical College,5The Second Affiliated Hospital,Wenzhou Medical University,Wenzhou 325000,China.E-mail: wzyxywfy@126.com)
[ABSTRACT]AIM: To investigate the preventive effects of Clostridium butyricum ( C.butyricum) on the type of pylorus ligated gastric ulcer ( GU) in mice and the underlying mechanisms.METHODS: ICR mice were randomly divided into 4 groups: sham operation group,model group,C.butyricum pretreatment group and omeprazole pretreatment group.Gastric pyloric ligation was adopted to establish GU model in mice.The gastric juice was collected to measure the content of gastric free mucus,the pH of gastric juice and the activity of pepsin.The gastric tissues were collected for routine HE staining to observe the pathological changes.The content of glycogen was detected by PAS staining.The protein expression of Bax and Bcl-2 in the gastric mucosa was also assessed by immunohistochemical staining.RESULTS: The HE and PAS staining showed that the C.butyricum pretreatment obviously attenuated the mucosa lesion induced by ligation.Compared with model group,the pH of gastric juice was significantly raised.The activity of pepsin fell off in C.butyricum group,which was lower than that in omeprazole group.In comparison with model group,the content of gastric free mucus was dramatically increased and PAS staining showed a significant rise in C.butyricum group,but not in omeprazole group.The protein expression of Bax was decreased and the protein expression of Bcl-2 was upgraded in C.butyricum group than those in model group.CONCLUSION: C.butyricum protects gastric mucosa against the challenge of pylorus ligation in mice and its mechanism may be related to inhibiting gastric acid secretion and the activation of pepsin,increasing the production of gastric free mucus,strengthening the expression of bcl-2 gene and inhibiting the expression of bax gene.
[KEY WORDS]Clostridium butyricum; Pyloric ligation; Gastric ulcer model; Bax; Bcl-2
通讯作者△Tel: 0577-86689817; E-mail: wzyxywfy@126.com
*[基金项目]温州市科技局( No.Y20130215; No.Y20110132) ;浙江省新苗计划项目( No.2014R413032)
[收稿日期]2014-12-22[修回日期]2015-04-30
[文章编号]1000-4718( 2015)07-1309-06
[中图分类号]R573. 1; R363. 2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.028
