糖尿病胃轻瘫大鼠胃平滑肌细胞BKCa通道的变化*
2015-05-16胥建辉侯晓钰赵宏贤成都医学院体温与炎症四川省高校重点实验室第一附属医院产科四川成都60500泸州医学院基础医学院组织学与胚胎学教研室四川泸州646000
胥建辉,侯晓钰,赵宏贤(成都医学院体温与炎症四川省高校重点实验室,第一附属医院产科,四川成都60500;泸州医学院基础医学院组织学与胚胎学教研室,四川泸州646000)
糖尿病胃轻瘫大鼠胃平滑肌细胞BKCa通道的变化*
胥建辉1,侯晓钰2,赵宏贤3△
(成都医学院1体温与炎症四川省高校重点实验室,2第一附属医院产科,四川成都610500;3泸州医学院基础医学院组织学与胚胎学教研室,四川泸州646000)
[摘要]目的:探讨糖尿病胃轻瘫( DGP)的发病机制与胃平滑肌细胞大电导钙激活钾通道( BK(Ca))变化之间的关系。方法:将大鼠分为对照组和糖尿病胃轻瘫模型组。应用木瓜蛋白酶液急性酶分离大鼠胃平滑肌细胞,采用单通道膜片钳技术记录大鼠胃平滑肌细胞BK(Ca)电流,免疫组织化学技术测定BK(Ca)蛋白KCNMA和KCNMB1的表达。结果:大鼠胃平滑肌细胞BK(Ca)电流的开放具有电压依赖性和胞内钙离子浓度依赖性,可被钾离子通道阻滞剂IbTX阻断;模型组大鼠胃平滑肌细胞BK(Ca)开放概率及开放幅度增加( P<0.05),平均开放时间及平均关闭时间减少( P<0.01) ;模型组大鼠胃平滑肌细胞KCNMB1蛋白表达增加( P<0.01),KCNMA蛋白表达无明显变化。结论: DGP发病与胃平滑肌细胞BK(Ca)β1亚基蛋白表达上调及通道功能活动增强有关,β1亚基蛋白可能通过调节BK(Ca)功能活动参与DGP的发生。
[关键词]糖尿病胃轻瘫;大电导钙激活钾通道;胃平滑肌细胞
平滑肌的收缩和舒张是胃肠道运动的基础。平滑肌细胞膜电位去极化与细胞膜上钙通道开放引起的钙离子内流可导致平滑肌收缩;钾通道开放,钾离子外流可导致细胞膜电位超极化,钙离子内流减少,平滑肌舒张。大电导钙激活钾通道( large-conductance calcium-activated potassium channels,BKCa)是平滑肌上重要的钾离子通道,在平滑肌细胞中分布广泛;其电导值大,相对少的通道激活即可对平滑肌细胞的膜电位产生较大的影响;它接受细胞膜电位与胞内钙离子浓度的双重调节,在平滑肌收缩-舒张调节中起着重要作用。文献报道小鼠胃和结肠平滑肌细胞膜上的BKCa表达高于十二指肠、回肠部位,胃和结肠具有的容受性舒张特点可能与BKCa有关[1],可见BKCa与胃的动力特性有着密切的关系。
糖尿病胃轻瘫( disbetic gastroparesis,DGP)是糖尿病常见慢性并发症,主要特点为胃动力下降、排空延迟、节律紊乱;见于Ⅰ型、Ⅱ型糖尿病,发病率约50%[2]。文献报道,DGP发病与胃肠激素及胃肠道神经系统的变化有相关性[3];胃肠激素及胃肠道神经系统可直接影响胃肠道平滑肌细胞BKCa的功能状态[4-6];而且研究发现,糖尿病可直接导致大鼠冠状动脉平滑肌细胞上BKCa电流活动和其β1亚基蛋白表达异常[7]。因此,我们推测DGP发生时,BKCa结构与功能状态可能发生异常,进而影响胃平滑肌的生理功能,BKCa可能在DGP发病中起了一定的作用。
材料和方法
1动物
健康纯系雄性SD大鼠50只,体重250 g左右,由泸州医学院动物科提供。
2主要试剂
链脲菌素( streptozotocin,STZ)、木瓜蛋白酶、DTT、白蛋白、免抗BKCaβ1和α亚基蛋白( KCNMB1 和KCNMA)抗体均购自Sigma。
3实验方法
3.1动物分组及造模采用以往研究报道的方法[8]。健康纯系雄性SD大鼠50只,随机分为对照组( n =20)和模型组( n =30)。模型组用0.1 mmol/ L柠檬酸缓冲液配制的2% STZ 60 mg/kg一次性腹腔内注射,3 d后,禁食不禁水6 h,采尾血测空腹血糖,选取血糖≥16.9 mmol/L大鼠继续进行实验;对照组用0.1 mmol/L柠檬酸缓冲液2 mL/kg一次性腹腔内注射,2组均给予标准鼠饲料继续喂养。10周后测量大鼠空腹血糖及体重,1 g/L美蓝溶液0.4 mL灌胃,30 min后处死大鼠,将胃内残留物用生理盐水冲洗并收集冲洗液,离心取上清液,用722分光光度计在640 nm波长检测吸光度( A)值,测量胃内色素残留率。血糖浓度≥16.9 mmol/L、胃排空率(胃内色素残留率)显著下降表明大鼠DGP模型造模成功。
3.2实验溶液的配制低钙生理溶液( mmol/L) : NaCl 135,KCl 6,MgCl21.2,HEPES 10,CaCl20.05,用NaOH调pH至7.40,用于组织保存和酶分离。单通道电极液( mmol/L) : KCl 100,K-aspartate 40,HEPES 10,EGTA 2,用KOH调pH至7.20~7.40。单通道浴液( mmol/L) : KCl 40,K-aspartate 100,EGTA 1,HEPES 10,用KOH调pH至7.20~7.40。以上电极液与浴液为对称性高钾溶液([K+]o: [K+]i=140 mmol/L∶140 mmol/L,[Ca2 +]free=0)。3.3急性酶分离SD大鼠胃平滑肌细胞将大鼠禁食不禁水24 h后处死,开腹取胃,剪开胃部,用无钙生理溶液漂洗干净,体式显微镜下剥下肌层,沿肌条方向剪成1 mm×3 mm的组织条块,置于由2.0 g/L木瓜蛋白酶,2.0 g/L DTT,3.0 g/L白蛋白配置的低钙生理溶液中保存20 min后放入木瓜蛋白酶酶液,于37℃恒温水浴箱中振荡消化15 min,显微镜下观察控制消化时间,如镜下见到细胞膜完整光滑,折光性好,即可终止酶解。
3.4单通道膜片钳技术记录大鼠胃平滑肌细胞BKCa电流选择呈梭形、贴壁良好、胞膜完整和折光性好的平滑肌细胞进行实验。操纵膜片钳微推进器使电极尖端贴附在细胞表面,在示波器上可见应答电流下降,稍加负压即可见应答电流下降至零,此时阻抗可高达10 GΩ以上,表明高阻封接已经形成,这样就形成了细胞贴附式膜片( cell-attached patch)。高阻封接形成后,迅速将微管电极尖端拉出液气交界面2~3 s,再放回浴槽中,即形成内面向外式膜片( inside-out patch)。采样频率设置为10 kHz,采样方式为Gap Free,采样时间30 s。本实验采用细胞贴附式膜片和内面向外式膜片记录BKCa电流。
3.5免疫组织化学技术测定BKCa蛋白KCNMA和KCNMB1的表达按抗体说明书操作步骤进行免疫组织化学检测。采用OLYMPUS IX71光学照相系统拍照,Image-Pro-Plus 6.0软件进行图形数据分析。
4统计学处理
单通道膜片钳实验所得数据采用pCLamp 10.1软件自动测量开放概率( open probability,NPO)、平均开放时间( mean open time,TO)、平均关闭时间( mean close time,TC)、电流幅度( amplitude of current,Amp)。用Origin 8作直线拟合及图形处理。用Image-Pro-Plus 6.0分析软件对免疫组织化学检测结果进行半定量分析。实验数据以均数±标准差( mean ±SD)表示,采用SPSS 14.0统计软件对数据进行分析,数据统计采用t检验,以P<0.05为差异有统计学意义。
结果
1大鼠DGP模型造模情况
实验过程中模型组大鼠死亡10只,最终纳入实验的模型组大鼠16只,对照组大鼠16只。处死前,模型组大鼠的平均体重( 190. 00 g±23. 71 g)明显低于对照组( 428. 00 g±25. 05 g)。处死前,模型组大鼠平均血糖浓度为30. 26 mmol/L±2. 19 mmol/L,大于16. 9 mmol/L,且明显高于对照组( 4. 83 mmol/L± 1. 09 mmol/L)。模型组大鼠胃内美蓝残留率( 54. 50 mmol/L±3. 92 mmol/L)明显高于对照组( 40. 69 mmol/L±3. 55 mmol/L),胃排空率显著下降( P<0. 01)。大鼠血糖浓度及胃排空率情况提示大鼠DGP模型造模成功。
2急性酶分离胃平滑肌细胞形态学表现
急性酶分离的大鼠胃平滑肌细胞数量多,活性较强,形态大多呈长梭形,细胞膜完整,表面光滑,外周有光环,折光性好,立体感强,细胞质内无颗粒状物,见图1。
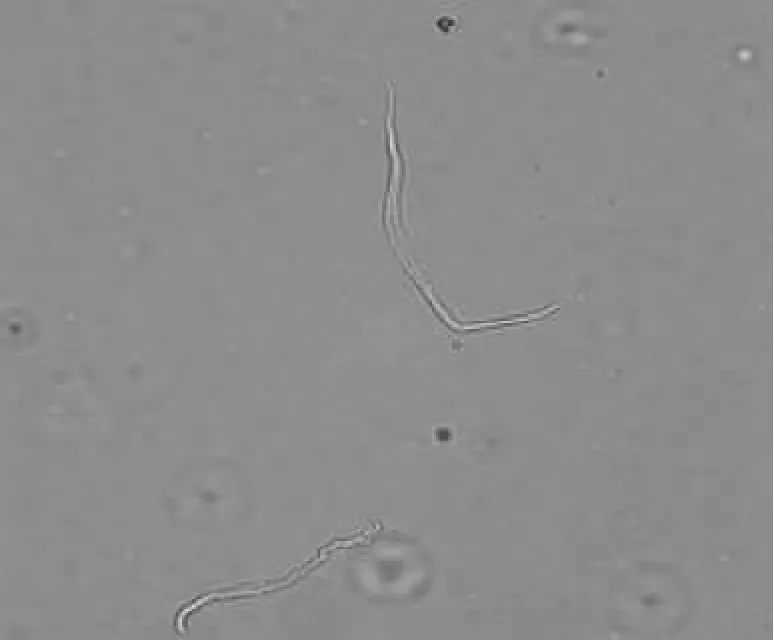
Figure 1.Photograph of a freshly isolated SD rat gastric smooth muscle cell under microscope(×400).图1 显微镜下刚分离的SD大鼠胃平滑肌细胞图像
3SD大鼠胃平滑肌细胞BKCa单通道特性与鉴别
3.1通道的电导在对称性高钾溶液中,钾离子的平衡电位Ek=0 mV,根据在不同钳制电压下的通道电流幅值和对应膜电位绘制电流-电压关系曲线(图2),用软件Origin 8对I-V曲线进行直线拟合,可见电流电压呈线性关系,反转电位接近0 mV,同时可以得到直线斜率为0.205,即该单通道电导值为205 pS。对11个膜片的BKCa单通道电流绘制I-V曲线并作统计学分析可得该通道的电导值为211.7 pS± 13.6 pS。
3.2通道的电压依赖性在内面向外式膜片下,随着钳制电压由0 mV逐渐上升至60 mV,通道的电流幅值、开放概率和开放时间均呈膜电压依赖性增加,见图3。
3.3通道活动的Ca2 +依赖性在内面向外式膜片下( Vm = +40 mV),浴液中游离Ca2 +浓度分别为0、1×10-7、5×10-7和1×10-6mol/L时,其NPo分别为0. 018±0. 004、0. 048±0. 007、0. 158±0. 020和 0. 500±0. 029,通道的开放概率随着钙离子浓度上升而逐渐增加,见图4。

Figure 2.The current-voltage relationship of BKCain SD rat gastric smooth muscle cells.Mean±SD.n =11.图2 SD大鼠胃平滑肌细胞BKCa的电流-电压关系

Figure 3.The voltage dependence of BKCain SD rat gastric smooth muscle cells.图3 SD大鼠胃平滑肌细胞BKCa的电压依赖性

Figure 4.The Ca2 +dependence of BKCain SD rat gastric smooth muscle cells( Vm = +40 mV).图4 SD大鼠胃平滑肌细胞BKCa的Ca2 +依赖性
3.4钾离子通道抑制剂IbTX对通道的作用在外面向外式膜片下( Vm = + 30 mV),浴液中加入200 nmol/L BKCa特异性阻断剂IbTX,膜片外向电流几乎完全被阻断,见图5。

Figure 5.The single channel current of BKCawas suppressed by 200 nmol/L IbTX.图5 BKCa通道的单通道电流被200 nmol/L IbTX阻断
4对照组与模型组SD大鼠BKCa通道电流比较
在细胞贴附式膜片下,游离钙离子浓度为1× 10-7mol/L,膜电位钳制在+ 40 mV,相比于对照组SD大鼠,模型组胃平滑肌BKCa单通道电流NP0值增加( P<0.01)、Amp值上升( P<0.05)、To值下降( P<0.01)、Tc值降低( P<0.01 ),见图6、表1。

Figure 6.Representative single channel currents traces of BKCain control group and model group in cell-attached patch ( Vm = +40 mV).图6 在细胞贴附式膜片下,具有代表性的对照组与模型组BKCa单通道电流图形

表1 对照组与模型组BKCa单通道电流特性的对比Table 1.Comparison of characteristics in single channel BKCacurrent between control group and model group ( Mean±SD.n =14)
5免疫组织化学检测KCNMA和KCNMB1蛋白表达水平
SD大鼠胃平滑肌上可检测到KCNMA和KCNMB1蛋白表达,蛋白表达水平用积分光密度( IA)值表示。经Image-Pro-Plus 6. 0分析软件分析,对照组KCNMA蛋白表达IA值为525 875. 5±65 718. 1,模型组KCNMA蛋白表达IA值为493 504. 6±27 916. 2,两者对比无明显差异( P<0. 05) ;对照组KCNMB1蛋白表达IA值为13 558. 2±2 216. 5,模型组为29 801. 6±3 123. 1,两者对比差异有统计学意义( P<0. 01),见图7、8。

Figure 7.Expression of KCNMA and KCNMB1 proteins was detected by immunohistochemical method in SD rat gastric smooth muscle cells (×200).图7 免疫组织化学法检测SD大鼠胃平滑肌细胞KCNMA 和KCNMB1蛋白表达
讨论
近年离子通道在胃肠道疾病的研究主要集中在平滑肌和神经系统。平滑肌是胃肠动力的来源,BKCa介导了胃肠道平滑肌的收缩-舒张,接受胃肠激素和胃肠道神经系统的调控,在胃肠道动力疾病中所起的作用逐渐被关注。本实验结果显示,DGP模型组胃平滑肌细胞BKCa单通道电流TO值和TC值均减少,NPO值显著增加,表明通道的功能活动加强。BKCa可通过负反馈系统调控平滑肌细胞张力[9-10],多项研究表明BKCa功能活动增强可引起平滑肌细胞的张力下降,肌条收缩受到抑制,舒张性增强[11-12]。在胃肠道也有相应的研究:郭力等[13]发现,内毒素/脂多糖和烧伤后豚鼠血清可增强豚鼠结肠平滑肌BKCa功能活动,提示烧伤后发生的内毒素血症通过增强结肠平滑肌细胞BKCa活动对豚鼠肠道的运动产生抑制作用,并由此引起了烧伤后肠道动力障碍。相反,BKCa功能活动减弱可引起平滑肌细胞的张力增强,肌条收缩性增强,舒张性减弱[14]。如肠易激综合征是临床常见胃肠道疾病,女性患者较多,多认为与胃肠动力亢进有关,徐龙等[15]发现,黄体酮可通过激活BKCa抑制豚鼠结肠环形肌收缩,提示肠易激综合征病人在月经、更年、绝经期肠易激综合征样症状发生率增高与BKCa相关。本实验与以上结肠平滑肌的研究类似,DGP大鼠胃平滑肌细胞BKCa功能活动增强可能通过降低胃平滑肌的收缩性、增加其舒张性,参与了胃排空延迟的发生,提示BKCa功能活动增强可
能与DGP发病有关。
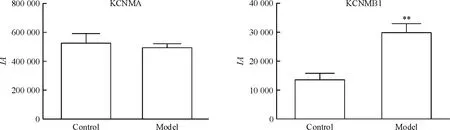
Figure 8.Expression level of KCNMA protein and KCNMB1 protein in SD rats gastric smooth muscle cells.Mean±SD.n =5.**P<0. 01 vs control group.图8 SD大鼠胃平滑肌细胞KCNMA和KCNMB1蛋白表达水平比较
BKCaα亚基由单基因KCNMA编码,是BKCa的基本结构功能部分。BKCa已知的β亚基由KCNMB 1~4 4种基因编码,组织特异性表达的β亚基和α亚基剪切变异体的相互结合是BKCa结构和功能多样性的基础[16]。β1亚基是BKCa的调节亚基,可通过修饰BKCa的电压依赖性和钙离子敏感性影响通道的动力学特性,它使通道的电压依赖性减低,电压感受器对通道的激活作用更加稳定,当通道激活时,电压处在更负的位置;它对通道的2个钙离子高亲和力结合位点( RCK1、Ca2 +bowl)的钙离子敏感性有修饰作用[17]。由于BKCa的β1亚基在平滑肌细胞中的表达占据主导地位,平滑肌细胞BKCa的钙离子敏感性高于脑和骨骼肌等其它组织[18],因此有关平滑肌BKCa功能活性的研究主要集中在β1亚基。本实验结果显示,SD大鼠胃平滑肌细胞均表达KCNMA蛋白和KCNMB1蛋白,DGP大鼠BKCaKCNMB1蛋白表达高于正常组大鼠,β1亚基表达上调。很多研究表明,β1亚基表达改变可引起BKCa动能活性发生改变,并可进一步影响平滑肌的收缩-舒张特性。如Semenov等[19]对平滑肌细胞KCNMB1基因的定向删除实验证明,β1亚基缺失的BKCa钙离子敏感性降低,钙火花和通道激活之间的偶联减少,通道开放概率下降,平滑肌张力增加。Sweet等[17]发现,β1亚基表达上调可引起BKCa通道钙离子敏感性增加,通道开放对电压的依赖性降低,通道开放概率上升,通道的电流活动加强。Hu等[20]发现,妊娠期妇女子宫动脉平滑肌张力下降与BKCaβ亚基表达上调,通道电流活动增强有关。本实验DGP大鼠胃平滑肌β1亚基表达上调可能引起BKCa功能活动增强,平滑肌张力下降,提示DGP大鼠胃平滑肌细胞BKCa功能活动增强可能与β1亚基表达上调有关。还有一些在胃肠道的研究发现,胃肠道平滑肌细胞β1亚基表达改变可能通过影响BKCa功能活动引起平滑肌收缩-舒张机制失调,胃肠道动力发生障碍。如杜滂等[21]发现,高胆固醇模型兔奥迪括约肌BKCaβ1亚基表达低于正常兔,提示高胆固醇血症通过下调奥迪括约肌BKCaβ1亚基表达,降低通道Ca2 +敏感性,引起通道开放异常,奥迪括约肌持续性收缩,胆汁淤积。France等[22]发现,BKCa阻断剂可导致正常大鼠近端结肠平滑肌细胞去极化且动作电位频率增加;与正常组相比,KCNMB1基因敲除大鼠食物残渣排出减少,实验用玻璃珠排出速度减慢,近端结肠平滑肌收缩性增强,细胞膜电位去极化幅度和频率增加,提示β1亚基缺陷导致BKCa功能障碍,并进一步引起便秘的发生。综上所述,本实验结果提示DGP大鼠胃平滑肌细胞β1亚基表达上调,BKCa功能活动增强,可能引起平滑肌张力下降,大鼠胃排空延迟,β1亚基可通过调节BKCa参与DGP的发生。在后期研究中我们将把BKCa作为靶点筛选兼具降血糖与降低BKCa通道活性的药物,为DGP的临床治疗提供新的实验依据。
[参考文献]
[1]Wang W,Huang H,Hou D,et al.Mechanosensitivity of STREX-lacking BKCachannels in the colonic smooth muscle of the mouse[J].Am J Physiol Gastrointest Liver Physiol,2010,299( 6) : G1231-G1240.
[2]Smith DS,Fenrris CD.Current concepts in diabetic gastroparesis[J].Drugs,2003,63( 13) : 1339-1358.
[3]刘云,孙岩,薛绮萍,等.糖尿病胃轻瘫的诊断及发病机制[J].世界华人消化杂志,2007,15( 3) : 290-293.
[4]Tanaka Y,Shinoda K,Sekiya S,et al.Beta1-adrenoceptor-mediated relaxation with isoprenaline and the role of MaxiK channels in guinea-pig esophageal smooth muscle [J].J Smooth Muscle Res,2004,40( 2) : 43-52.
[5]Ren J,Galligan JJ.A novel calcium-sensitive potassium conductance is coupled to P2X3 subunit containing receptors in myenteric neurons of guinea pig ileum[J].Neurogastroenterol Motil,2007,19( 11) : 912-922.
[6]Zhu J,Chen L,Xia H,et al.Mechanisms mediating CCK-8S-induced contraction of proximal colon in guinea pigs[J].World J Gastroenterol,2010,16 ( 9) : 1076-1085.
[7]王如兴,李肖蓉,羊镇宇,等.糖尿病对冠状动脉平滑肌细胞大电导钙激活钾通道的影响[J].中华心血管病杂志,2010,38( 12) : 1098-1101.
[8]陈霞,赵宏贤,徐富翠,等.Ⅰ型糖尿病胃轻瘫大鼠动物模型建立与优化[J].四川动物,2010,29( 5) : 630-632.
[9]Guia A,Wan X,Courtemanche M,et al.Local Ca2 +entry through L-type Ca2 +channels activates Ca2 +-dependent K+channels in rabbit coronary myocytes[J].Circ Res,1999,84( 9) : 1032-1042.
[10]仲维高,杨艳,曾晓荣,等.在inside-out膜片上caffeine对猪冠状动脉平滑肌细胞钙激活钾通道的调节作用及ryanodine的影响[J].中国病理生理杂志,2010,26( 1) : 53-58.
[11]Ponte CG,McManus OB,Schmalhofer WA,et al.Selective,direct activation of high-conductance,calcium-activated potassium channels causes smooth muscle relaxation [J].Mol Pharmacol,2012,81( 4) : 567-577.
[12]Xin W,Soder RP,Cheng Q,et al.Selective inhibition of phosphodiesterase 1 relaxes urinary bladder smooth muscle: role for ryanodine receptor-mediated BK channel activation[J].Am J Physiol Cell Physiol,2012,303( 10) : C1079-C1089.
[13]郭力,王熙斌,杨艳,等.内毒素/脂多糖及烧伤血清对豚鼠肠道平滑肌细胞离子通道的影响[J].中华烧伤杂志,2006,22( 3) : 184-186.
[14]Yang Y,Li PY,Cheng J,et al.Function of BKCachannels is reduced in human vascular smooth muscle cells from Han Chinese patients with hypertension[J].Hypertension,2013,61( 2) : 519-525.
[15]徐龙,余保平,陈明锴,等.黄体酮对豚鼠结肠平滑肌及细胞膜钙依赖的钾通道电流的影响[J].中国药理学通报,2003,19( 9) : 1043-1047.
[16]Berkefeld H,Fakler B,Schulte U.Ca2 +-activated K+channels: from protein complexes to function[J].Physiol Rev,2010,90( 4) : 1437-1459.
[17]Sweet TB,Cox DH.Measuring the influence of the BKCabeta1 subunit on Ca2 +binding to the BKCachannel[J].J Gen Physiol,2009,133( 2) : 139-150.
[18]Zhang XY,Wang S,Yan Z,et al.Molecular cloning,tissue distribution and bioinformatics analyses of the rabbit BK channel beta1 subunit gene[J].Mol Biol Rep,2008,35( 4) : 649-655.
[19]Semenov I,Wang B,Herlihy JT,et al.BK channel beta1-subunit regulation of calcium handling and constriction in tracheal smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2006,291( 4) : L802-L810.
[20]Hu XQ,Xiao D,Zhu R,et al.Pregnancy upregulates large-conductance Ca2 +-activated K+channel activity and attenuates myogenic tone in uterine arteries[J].Hypertension,2011,58( 6) : 1132-1139.
[21]杜滂,魏经国,崔光彬,等.高胆固醇对兔oddi括约肌BK通道β1亚基蛋白表达的影响[J].细胞与分子免疫学杂志,2006,22( 6) : 710-712.
[22]France M,Bhattarai Y,Galligan JJ,et al.Impaired propulsive motility in the distal but not proximal colon of BK channel β1-subunit knockout mice[J].Neurogastroenterol Motil,2012,24( 9) : e450-e459.
Changes of large-conductance calcium-activated potassium channel in gastric smooth muscle cells of diabetic gastroparesis rats
XU Jian-hui1,HOU Xiao-yu2,ZHAO Hong-xian3
(1Key Laboratory of Thermoregulation and Inflammation,Sichuan Higher Education Institutes,2Department of Obstetrics,First Affiliated Hospital,Chengdu Medical College,Chengdu 610500,China;3Department of Histology and Embryology,Luzhou Medical College,Luzhou 646000,China.E-mail: helloxjh@126.com)
[ABSTRACT]AIM: To discuss the relevance between the pathogenesis of diabetic gastroparesis and the largeconductance calcium-activated potassium channels ( BK(Ca)) in gastric smooth muscle cells.METHODS: The SD rats were randomly divided into control group and model group.The gastric smooth muscle cells of the SD rats were enzymatically isolated in a low calcium solution containing papain.The current was recorded by patch clamp single channel recording technique.The expression of KCNMA and KCNMB1 were observed by the method of immunohistochemistry.RESULTS: The value of BK(Ca)single channel conductance was ( 220.10±10.90) pS; the channels had distinct voltage dependent and calcium dependent characteristics.In outside-out patch ( Vm = +30 mV),the activation of BK(Ca)was blocked by 200 nmol/ L IbTX completely.Compared with control group,the open probability and amplitude of current in model group significantly increased,while the mean open time and mean close time significantly decreased.Compared with control group,the expression of KCNMB1 in model group was significantly increased.CONCLUSION: Up-regulation of β1-subunit and increase in BK(Ca)functional activities may be associated with diabetes gastroparesis in rats.
[KEY WORDS]Diabetes gastroparesis; Large-conductance calcium-activated potassium channel; Gastric smooth muscle cells
通讯作者△Tel: 0830-3160073; E-mail: helloxjh@126.com
*[基金项目]四川省卫生厅科研课题( No.100242)
[收稿日期]2014-09-05[修回日期]2015-05-11
[文章编号]1000-4718( 2015)07-1288-06
[中图分类号]R587. 1; R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.024
