清胰汤Ⅱ号冲剂对急性胰腺炎小鼠的保护作用及机制*
2015-05-16林思思张瑞琴兑丹华李永渝同济大学医学院病理生理教研室消化系统疾病研究所上海0009遵义医药高等专科学校生理教研室遵义56000同济大学医学院病原生物教研室上海0009遵义医学院附属医院肝胆胰外科遵义5600
李 敏,林思思,沈 利,张瑞琴,兑丹华,李永渝△(同济大学医学院病理生理教研室,消化系统疾病研究所,上海0009;遵义医药高等专科学校生理教研室,遵义56000;同济大学医学院病原生物教研室,上海0009;遵义医学院附属医院肝胆胰外科,遵义5600)
清胰汤Ⅱ号冲剂对急性胰腺炎小鼠的保护作用及机制*
李敏1,2,林思思1,沈利3,张瑞琴1,兑丹华4,李永渝1△
(1同济大学医学院病理生理教研室,消化系统疾病研究所,上海200092;2遵义医药高等专科学校生理教研室,遵义563000;3同济大学医学院病原生物教研室,上海200092;4遵义医学院附属医院肝胆胰外科,遵义563003)
[摘要]目的:探讨清胰汤Ⅱ号冲剂( QYT)对急性胰腺炎( acute pancreatitis,AP)小鼠的保护作用及机制。方法:成年C57BL/6小鼠24只,雌雄各半,随机均分为3组。AP组和AP + QYT组首先经腹腔注射雨蛙肽( 50 μg/kg)及脂多糖( 10 mg/kg)复制重症AP模型,AP组小鼠给予饮用水灌胃,AP + QYT组给予QYT灌胃;正常对照组小鼠给予等量生理盐水注射及饮用水灌胃。于末次注药后3 h麻醉处死动物。检测和分析胰腺组织的病理改变、肠道细菌总数和分类、Peyer’s结T淋巴细胞亚群的变化、血浆淀粉酶、白细胞介素6( IL-6)、单核细胞趋化蛋白1( MCP-1)水平以及胰腺和肺脏组织髓过氧化物酶( MPO)活性等。结果:与对照组相比,AP小鼠的胰腺组织病理学评分、肠道细菌数量、血浆淀粉酶活性、IL-6及MCP-1水平、胰和肺组织的MPO活性都有明显升高( P<0. 05) ; QYT可在一定程度上逆转AP时相关指标的变化( P<0. 05)。小肠Peyer’s结数量在各组无明显差异,但AP组的CD3+T淋巴细胞百分比较对照组明显降低( P<0. 05),而且,AP组和AP + QYT组,尤其是后者CD4+T淋巴细胞百分比和CD4+/ CD8+比值较对照组明显升高( P<0. 05)。结论:清胰汤II号冲剂对雨蛙肽和脂多糖诱导的小鼠急性胰腺炎具有明显的拮抗作用,其机制可能与其抑制炎症反应、促进肠内细菌的清除和调节肠道T淋巴细胞功能有关。
[关键词]清胰汤Ⅱ号冲剂;急性胰腺炎;炎症介质;肠道菌群; Peyer’s集合淋巴结
急性胰腺炎( acute pancreatitis,AP)是各种病因作用下发生在胰腺组织的急性炎症性疾病,常常继发胰外器官的损伤,是临床上危急重症中较难治疗的疾病之一[1]。目前对AP的诊断和治疗水平已有了很大的提高,然而对部分患者,尤其是重症急性胰腺炎( severe acute pancreatitis,SAP)患者,治疗效果尚不甚满意,死亡率仍高达30%~50%左右[2]。而急性肺损伤及多器官功能不全综合征( multiple organ dysfunction syndrome,MODS)是SAP早期死亡的主要原因。研究表明,SAP及其伴发的急性呼吸窘迫综合征( acute respiratory distress syndrome,ARDS)和MODS与白细胞介素6( interlukin 6,IL-6)及单核细胞趋化蛋白1 ( monocyte chemoattractant protein 1,MCP-1)等多种炎症介质的作用、T细胞免疫功能和肠道菌群紊乱有关[3]。因此,揭示AP的发病机制,积极有效地阻断AP的发生发展一直是相关领域研究的热点课题。
清胰汤( Qing Yi Tang,QYT)是我国治疗胰腺炎的常用药方,经全国大范围几十年的临床应用,已经证实清胰汤对各种原因引起的急性胰腺炎具有良好的效果,对重症胰腺炎的效果也已被肯定[2]。传统用的清胰汤是以大黄、丹皮、厚朴等8位中药组方的水煎剂,为了使其更标准化,同时利于患者携带和服用,我们经过多次实验,将传统的清胰汤Ⅱ号汤剂改型为冲剂。前期实验看到,该冲剂可明显逆转AP大鼠胰腺组织的损伤,同时可调整AP引发的胃肠运动紊乱,包括对胃肠平滑肌电活动及小肠排推运动的改善[4-5],效果与汤剂的作用相当。为了进一步证实该冲剂的疗效,阐明其作用的机制,本项目在前期工作的基础上,复制重型急性胰腺炎小鼠模型,应用清胰汤Ⅱ号冲剂干预,通过对组织学损伤评分、胰酶活性、炎症介质水平、肠道细菌数量以及小肠Peyer’s集合淋巴结中T淋巴细胞及其亚群水平的变化进行检测和分析,探讨清胰汤Ⅱ号颗粒冲剂治疗急性胰腺炎的作用和机制,以为临床应用提供有力的实验依据。
材料和方法
1材料
1.1动物成年C57BL/6小鼠24只,体重为20~26 g,雌雄不限,购自南京大学实验动物中心。动物在温度为( 25±2)℃、湿度( 55±5) %的环境下喂养,整个过程给予标准实验饮食。
1.2主要试剂及药物雨蛙肽及脂多糖购自Sigma;中药清胰汤Ⅱ号冲剂(成分、剂量、产地等见表1)为清胰汤Ⅱ号煎剂浓缩、蒸发而得颗粒冲剂,其质量以规范药物制备的每一流程、用高效液相色谱法( high-performance liquid chromatography,HPLC)测定每批次清胰汤Ⅱ号颗粒中大黄素和大黄酚的含量来控制。本实验所用产品由遵义医学院药学院提供。淀粉酶和髓过氧化物酶( myeloperoxidase,MPO)试剂盒购自南京建成生物试剂公司; ELISA试剂盒购自深圳达科为生物技术公司。

表1 清胰汤Ⅱ号冲剂成分、用量、药用部分和产地Table 1.Detailed information on the composition of Qing Yi TangⅡgranule,the used parts and the place of origin
1.3主要仪器Leica DM2500显微镜( Leica) ; ELx800酶标仪( BioTek) ; BD FACSVerse流式细胞仪( BD)。
2方法
2.1重型急性胰腺炎小鼠模型复制及分组处理取C57BL/6小鼠24只,雌雄各半,随机均分为3组:正常对照组( control)、急性胰腺炎组( AP组)和急性胰腺炎+清胰汤Ⅱ号冲剂治疗组( AP + QYT组)。各组小鼠自由饮水条件下禁食12 h后接受实验。用雨蛙肽及脂多糖腹腔注射复制小鼠AP模型[6]。具体操作方法如下:给小鼠腹腔注射雨蛙肽( 50 μg/ kg),每小时1次,连续注射6次;在第6次注射的同时给予脂多糖( 10 mg/kg)腹腔注射。AP + QYT组在第1次雨蛙肽注射前30 min及注射后5 h按0. 1 mL/10 g体重经胃管给小鼠饮用水( AP组)或24%浓度的清胰汤Ⅱ号冲剂[4-5]。正常对照组小鼠获得相同次数和剂量的生理盐水腹腔注射以及饮用水灌胃。于末次注射后3 h麻醉处死小鼠,取胰腺、肺、肠组织、小肠Peyer’s结及血液。
2.2指标检测
2.2.1组织病理学变化取胰腺组织,固定、包埋、切片,HE染色。光学显微镜下观察胰腺组织病理改变,采用盲法由病理专业人员在光镜下阅片,参照Nathan等[7]标准进行评分。
2.2.2血浆淀粉酶活性取血液抗凝,离心取上清液。血浆淀粉酶活性用化学试剂盒,按照厂家说明书进行测定。结果以对照组的值为100%,AP组和AP + QTY组的值分别以对照组的百分比来表示。
2.2.3血浆炎症介质水平用ELISA试剂盒,按照说明书介绍的方法分别检测血浆IL-6和MCP-1水平,结果以mg/L表示。
2.2.4胰腺和肺组织髓过氧化物酶活性组织称重后以生理盐水按1∶9制成10%匀浆,离心后取上清液,用MPO检测试剂盒,按照说明书要求进行检测,计算出单位组织重量中MPO活性。结果以对照组的值为100%,AP组和AP + QTY组的值分别以对照组的百分比来表示。
2.2.5肠菌检测在距盲肠上、下1 cm左右取回肠和结肠各1 cm,称重,用LB液态培养基冲洗肠壁,进行大肠杆菌、肠球菌、双歧杆菌及总细菌数的培养,培养48 h后作细菌计数[8]。结果以每mg组织样品中含有的细菌菌落总数( cfu/mg)来表示。
2.2.6小肠Peyer’s结T淋巴细胞亚群检测取小肠,记录Peyer’s结数量并摘取之,用机械分离法取得单细胞,进行细胞计数。取10 μL 1×109/L细胞悬液于EP管,进行血清封闭后加100 μL FACS buffer与CD3-Percp、CD4-FITC和CD8-PE抗体混合液,避光,冰上孵育30分钟。1 500 r/min离心5 min,弃上清,加200 μL PBS重悬,转移至流式细胞管中,用BD FACSVerse流式细胞仪收集细胞,用FlowJo 7. 6. 1进行数据分析,获得各标本中CD3+、CD4+和 CD8+T淋巴细胞,并计算CD4+/CD8+比值。
3统计学处理
这一创新做法,从2013年起连续6年被写入安徽省委一号文件,2017年被原农业部等六部委联合发文向全国推广,2018年被写入中央一号文件。为抓好政策扶持和配套服务,宿州市委、市政府出台了《关于扶持农业产业化联合体发展的若干政策意见》等文件,市、县区两级财政每年兑现产业化联合体成员各类奖补资金3600多万元。
统计分析数据采用均数±标准差( mean±SD)或均数±标准误( mean±SEM)表示,用SPSS 20. 0统计软件行单因素方差分析:先采用单因素方差分析,若方差齐,采用LSD的两两比较,若方差不齐,则对数据进行个案排秩;然后使用个案排秩后的数据进行单因素方差分析,并采用LSD的两两比较。以P<0. 05为差异有统计学意义。
结果
1胰腺组织病理学
与正常小鼠比较,AP小鼠胰腺组织损伤严重,表现为水肿、出血、腺泡坏死、炎症细胞浸润等,组织病理学评分明显增高( P<0. 01),说明AP小鼠模型复制成功。清胰汤Ⅱ号冲剂治疗使小鼠胰腺组织水肿及炎症程度减轻,小叶间隙轻度增宽,组织仍可见少量炎症细胞浸润,但程度减轻,未见明显胰腺腺泡坏死;组织评分较AP组显著降低( P<0. 01)。结果表明,清胰汤Ⅱ号冲剂能够改善AP时胰腺组织的炎症和损伤,见图1。
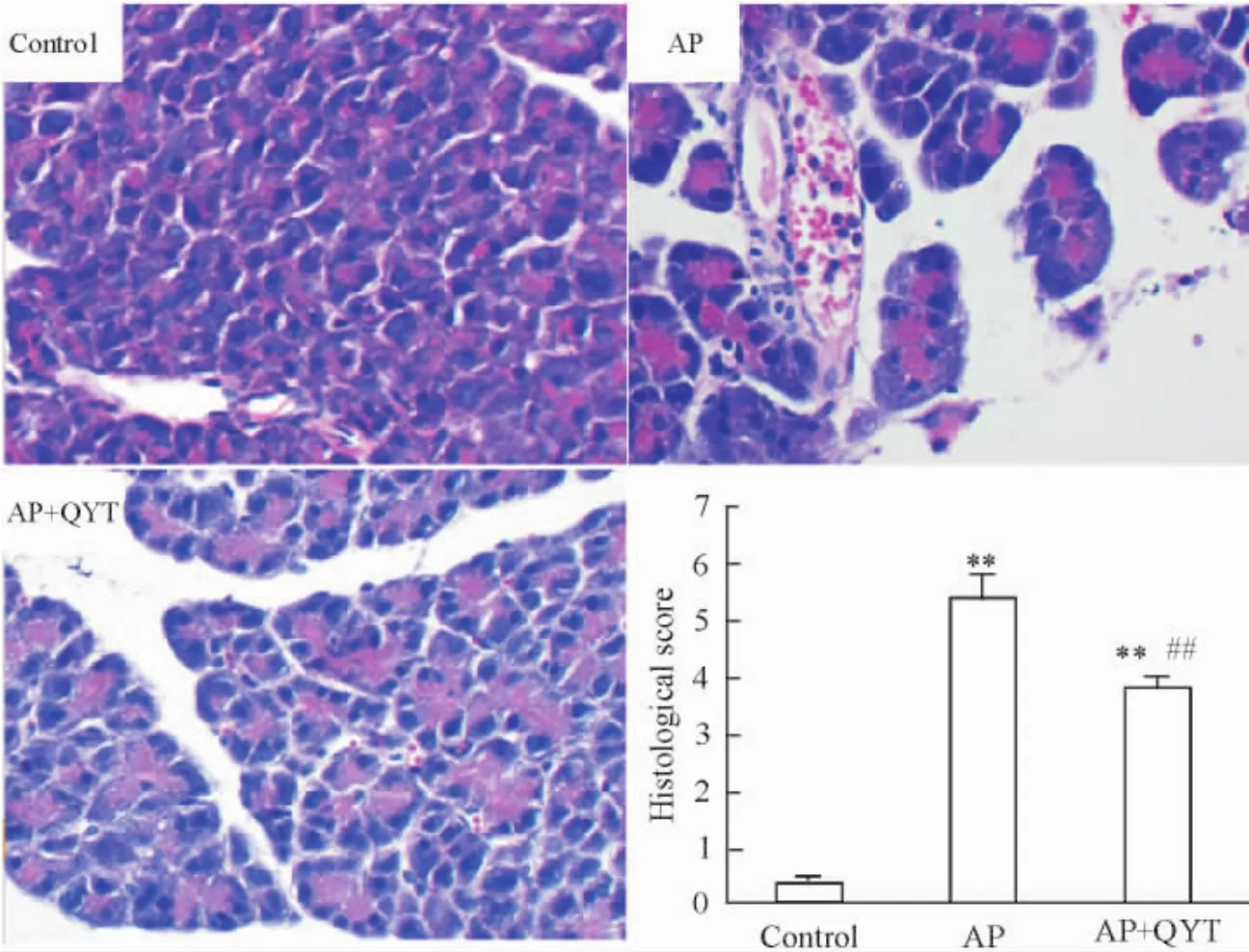
Figure 1.Effects of Qing Yi TangⅡgranule ( QYT) on the pathological changes ( HE staining,×400) and histological scores of pancreas sections from mice with acute pancreatitis ( AP).Mean±SEM.n = 3.**P<0. 01 vs control;##P<0. 01 vs AP group.图1 清胰汤Ⅱ号冲剂对AP小鼠胰腺组织病理变化的影响
2血浆淀粉酶活性的变化
血浆淀粉酶的检测结果显示,AP组小鼠血浆淀粉酶活性较正常小鼠明显升高( P<0. 01),进一步证实AP模型复制成功;清胰汤Ⅱ号冲剂治疗可明显降低血浆淀粉酶的活性( P<0. 01),见图2。
3血浆炎症介质水平的变化
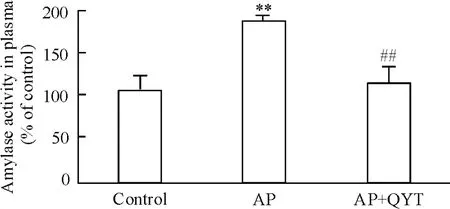
Figure 2.Effect of QYT on amylase activity in plasma from mice with AP.Mean±SEM.n =6.**P<0. 01 vs control;##P<0. 01 vs AP group.图2 清胰汤Ⅱ号冲剂对AP小鼠血浆淀粉酶活性的影响

Figure 3.Effects of QYT on levels of inflammatory mediators in the plasma of mice with AP.Mean±SEM.n = 6.**P<0. 01 vs control;#P<0. 05,##P<0. 01 vs AP group.图3 清胰汤Ⅱ号冲剂对AP小鼠血浆炎症介质水平的影响
4胰腺和肺组织髓过氧化物酶活性的变化
与正常对照组比较,AP组小鼠肺脏组织的髓过氧化物酶活性明显升高( P<0. 05),在胰腺组织的升高更为显著( P<0. 01),与图1 HE染色所示的胰腺组织中炎细胞增多相一致; AP + QYT组小鼠无论肺脏,还是胰腺组织的MPO活性都较AP组显著降低( P<0. 05)。结果提示,清胰汤Ⅱ号冲剂能够明显降低AP时中性粒细胞在胰腺和肺脏的浸润,见图4。

Figure 4.Effect of QYT on MPO activity in pulmonary ( A) and pancreatic ( B) tissues of mice with AP.Mean± SEM.n = 6.*P<0. 05,**P<0. 01 vs control;#P<0. 05,##P<0. 01 vs AP group.图4 清胰汤Ⅱ号冲剂对AP小鼠肺和胰腺组织MPO活性的影响
5肠道菌群的变化
与对照组相比,AP组小鼠回肠和结肠中的大肠杆菌、肠球菌、双歧杆菌以及总细菌数都明显增多,其中大肠杆菌和肠球菌增多更明显,差异有统计学意义( P<0. 05)。清胰汤Ⅱ号冲剂干预后,各类细菌较AP组均显著减少( P<0. 01),表明清胰汤Ⅱ号冲剂有利于肠道细菌的清除,见表2。
6小肠Peyer’s结T淋巴细胞亚群的改变
图5为流式细胞术检测小鼠肠道Peyer’s T淋巴细胞的代表图,可见其中CD3+T淋巴细胞的变化,与对照组比较,AP组最低,AP + QYT组降低不明显。将各组CD3+细胞再分类,得到亚型CD4+T淋巴细胞和CD8+T淋巴细胞所占百分比。与对照组比较,AP组和AP + QYT组CD4+T淋巴细胞所占比例明显增加( P<0. 01),CD4+/CD8+比值也增加,AP + QYT组更明显( P<0. 05)。这提示清胰汤Ⅱ号冲剂可能有提高CD4+T淋巴细胞、改善细胞免疫功能的作用,见图5、表3。

表2 清胰汤Ⅱ号对治疗急性胰腺炎小鼠肠道菌群的影响Table 2.Effects of QYT on the intestinal microflora in ileum and colon from mice with AP ( cfu/mg.Mean±SEM.n =6)

Figure 5.Changes of CD3+T lymphocyte percentage in the intestinal Peyer’s patches from mice with AP ( representative figures captured from flow cytometry measurement).图5 肠道Peyer’s结CD3+淋巴细胞百分数变化的流式图

表3 肠道Peyer’s结T淋巴细胞亚群的变化Table 3.Changes of T lymphocytes in the intestinal Peyer’s patches from mice with AP.( Mean±SD.n =6)
讨论
急性胰腺炎的发病机制复杂,涉及多环节、多因素,包括胰酶的过早激活及胰腺组织自身消化、自由基的损伤作用、钙超载,以及炎症介质、促炎细胞因子的大量释放等[9-10]。如何有效防治急性胰腺炎,尤其是控制病变从局部向远隔器官的扩散,以及机体多个器官系统的受累及MODS,一直是基础和临床的研究课题。雨蛙肽是胆囊收缩素( cholecystokinin,CCK)的类似物,有研究表明它可与胰腺细胞的CCK-A低亲和受体结合,引起胰酶的分泌,大剂量使用可诱导AP发生[11]。内毒素主要成分是脂多糖,作用于机体后可促使巨噬细胞和白细胞产生白细胞介素1、6、8和肿瘤坏死因子α等炎症介质,还可直接损伤血管内皮细胞,使小血管扩张、通透性发生改变,造成微循环障碍,从而加重胰腺组织的损害。我们用雨蛙肽及脂多糖腹腔注射复制重型急性胰腺炎小鼠模型[6],通过胰腺病理切片观察到组织明显炎症及损伤,大量淀粉酶释放入血,同时有血浆促炎细胞因子水平增高以及远隔器官肺脏的炎细胞浸润,证明急性胰腺炎小鼠模型复制成功。
急性胰腺炎往往累及肺,肺损伤是AP的严重并发症,当AP合并ARDS时病人的死亡率非常高。肺损伤的机制主要是由于炎症的播散,中性粒细胞、单核巨噬细胞、淋巴细胞的激活和移行,引发炎症介质和氧化应激分子大量产生所导致[12]。可见,炎症细胞浸润在AP并发急性肺损伤的发生机制中起着重要的作用。AP也常常累及胃肠道,引起胃肠道运动功能减弱,肠内容物排空受阻,导致细菌过度生长,加上肠道机械屏障、免疫屏障功能的改变,可出现肠道菌群的紊乱和移位[13]。肠道细菌移位进一步刺激机体免疫细胞和炎症相关的信号通路,释放过量的细胞因子和炎症介质,这些物质又造成对胰腺等组织器官第2次打击,可能诱发MODS。这些变化在本实验AP小鼠中也不同程度地发生。因此,改善胃肠运动功能和保护肠道屏障是AP治疗的重要环节。
通过多年的实验研究及临床经验,已经证明中药复方清胰汤对AP动物及患者的治疗作用。有报道,清胰汤能明显降低AP时IL-1、IL-6等促炎细胞因子的表达和释放,阻断其触发的一系列连锁反应[14-15]。研究表明,清胰汤能减轻胰腺炎引发的多方面的病理生理变化,维护肠黏膜屏障功能,减少肠道细菌移位和感染的发生机会,其保护机制可能是通过促进肠蠕动以促进细菌和毒素排泄,调整肠道微生态平衡,减轻内毒素和各种细胞因子的损伤,并调节机体的免疫功能等综合作用来实现的[8,16]。本实验用标准化的、同时利于患者携带和服用的清胰汤Ⅱ号冲剂治疗AP,效果得到进一步的肯定,主要实验依据及可能的作用机制包括: ( 1)明显减轻AP动物胰腺组织的水肿、出血和坏死程度以及炎细胞的浸润; ( 2)降低血浆淀粉酶活性; ( 3)下调炎症介质IL-6、MCP-1的血浆水平,进而可能阻断由其触发的一系列炎症连锁反应; ( 4)减轻肺部炎细胞浸润。本研究结果表明,AP小鼠肺组织中MPO活性明显增高,给予清胰汤Ⅱ号冲剂的小鼠,肺组织的MPO活性显著降低,提示肺部中性粒细胞的浸润减少,炎症减轻; ( 5)促进肠内细菌的清除。清胰汤Ⅱ号加重了大黄等药物的用量,具有通里攻下、清热解毒、疏肝理气等功能,可促进排便、抑制肠道细菌的增殖。我们之前的研究还发现,清胰汤可增加胃动素的分泌,提高胃肠的蠕动,从而促进肠内毒物的排泄[17]; ( 6)增强小肠免疫屏障功能。小肠Peyer’s结是肠道免疫屏障的重要组成部分,从其中淋巴细胞亚群的分类,反映出AP时肠道细胞免疫功能有改变。在清胰汤Ⅱ号冲剂治疗组小鼠,其小肠Peyer’s结的CD3+T淋巴细胞百分比增加,其亚群CD4+细胞比例以及CD4+/ CD8+比值也增高。结合前面清胰汤Ⅱ号冲剂改善AP胰腺组织的损伤,下调血浆炎症介质,抑制炎细胞浸润等功能,提示清胰汤Ⅱ号冲剂可能有改善肠道免疫屏障功能的作用。已知,CD3 T淋巴细胞中包括CD4和CD8T淋巴细胞,CD4为辅助/诱导T淋巴细胞( Th/Ti),Ti细胞诱导细胞的成熟,这类细胞在细胞免疫的效应阶段产生多种淋巴因子,导致炎症反应,适度的炎症反应可加速消除抗原物质。CD8+细胞可对靶细胞产生细胞介导的细胞毒作用,且对CD4+细胞具有调节作用。CD4+/ CD8+比值反映细胞免疫功能状态[18]。药理研究揭示,大黄中的有效成分大黄素对淋巴细胞外钙内流有明显促进作用,可增强淋巴细胞免疫功能[19]。至于高比例的CD4+T淋巴细胞中又有哪些亚群在行使主要作用,我们将进一步探究,包括对分泌IL-10、γ-干扰素或IL-17的CD4+T淋巴细胞的数量和功能的研究,以揭示清胰汤Ⅱ号冲剂改善肠道免疫屏障功能的作用机制。
[参考文献]
[1]鱼毛毛,刘金姣,王雨楠,等.葡萄多酚对雨蛙肽诱导的急性胰腺炎胰腺组织的保护作用[J].中国病理生理杂志,2014,30( 10) : 1820-1826.
[2]宋胜江,汤礼贵,戴华卫,等.清胰汤对实验性重症胰腺炎大鼠炎症介质的影响[J].福建中医药,2010,41 ( 2) : 44-45.
[3]李振华,王湘英.重症急性胰腺炎肠黏膜屏障功能障碍细菌易位的研究现状[J].中国普通外科杂志,2011,20( 3) : 286-291.
[4]Li Y,Sibaev A,Zhou M,et al.The Chinese herbal preparation Qing Yi Tang ( QYT) improves intestinal myoelectrical activity and increases intestinal transit during acute pancreatitis in rodents[J].Phytother Res,2007,21 ( 4) : 324-331.
[5]周明正,李永渝,朱国英,等.清胰汤制剂对急性胰腺炎大鼠胃肠肌电活动变化的作用[J].同济大学学报医学版,2006,27( 4) : 4-8.
[6]Li YY,Stephanie O,Gao ZR,et al.Regulation of HSP60 and the role of MK2 in a new model of severe experimental pancreatitis[J].Am J Physiol Gastrointest Liver Physiol,2009,297( 5) : G981-G989.
[7]Nathan JD,Peng RY,Wang Y,et al.Primary sensory neurons a common final pathway for inflammation in experimental pancreatitis in rats[J].Am J Physiol Gastrointest Liver Physiol,2002,283( 4) : G938-G946.
[8]吴承堂,黎沾良,黄祥成,等.中药清胰汤及双歧杆菌合剂对急性坏死性胰腺炎肠道细菌移位影响的比较研究[J].世界华人消化杂志,1999,7( 6) : 69-72.
[9]林旭红,李永渝.急性胰腺炎发病机制及相关治疗的研究进展[J].中国病理生理杂志,2010,26( 5) : 1029-1032.
[10]Li K,Feng JY,Li YY,et al.Anti-inflammatory role of cannabidiol and O-1602 in cerulein-induced acute pancreatitis in mice[J].Pancreas,2013,42( 1) : 123-129.
[11]冯佳燕,李琨,林旭红,等.新型大麻制剂O-1602 和CBD减轻小鼠实验性急性胰腺炎的机制研究[J].中国病理生理杂志,2011,27( 3) : 539-544.
[12]兑丹华,彭慈军,赵鹏,等.清胰Ⅱ号对香猪重症急性胰腺炎胰肺损害的保护作用[J].消化外科,2004,3( 6) : 394-395.
[13]兑丹华,彭慈军,高占峰,等.清胰汤对香猪重症急性胰腺炎并发内毒素血症的防治实验研究[J].遵义医学院学报,2004,27( 4) : 343-346.
[14]李永渝,高占峰,兑丹华,等.清胰汤和汉防己甲素对香猪重症急性胰腺炎的治疗作用及血药浓度测定[J].中国中西医结合杂志,2003,23( 11) : 832-836.
[15]朱国英,李永渝,李学礼.急性胰腺炎大鼠胰、肝组织IκBα的表达及中药新清胰汤的影响[J].中国病理生理杂志,2006,22( 12) : 2438-2442.
[16]郁燕.双歧杆菌联合清胰汤防治重症胰腺炎患者肠道菌群失调[J].内蒙古中医药,2014,33( 6) : 72-73.
[17]李永渝,高占峰,兑丹华,等.粉防己碱、清胰汤对重症急性胰腺炎猪血胃泌素、胃动素的影响[J].胰腺病学,2004,4( 1) : 5-9.
[18]Haga Y,Tempero MA,Zetterman RK.Unconjugated bilirubin inhibits in vitro cytotoxic T lymphocyte activity of human lymphocytes[J].Biochim Biophys Acta,1996,1317 ( 1) : 65-70.
[19]高峰,张中平,陈育健,等.清胰汤对急性胰腺炎患者细胞免疫功能的影响[J].中国中医急症,2006,15 ( 5) : 476-477.
Chinese herbal preparation Qing Yi TangⅡgranule protects against experimental acute pancreatitis in mice
LI Min1,2,LIN Si-si1,SHEN Li3,ZHANG Rui-qin1,DUI Dan-hua4,LI Yong-yu1
(1Department of Pathophysiology,Institute of Digestive Disease,Tongji University School of Medicine,Shanghai 200092,China;2Department of Physiology,Zunyi Medical and Pharmaceutical College,Zunyi 563000,China;3Department of Pathogen Biology,Tongji University School of Medicine,Shanghai 200092,China;4Department of Hepato-Biliary-Pancreatic Surgery,Affiliated Hospital of Zunyi Medical College,Zunyi 563003,China.E-mail: liyongyu@ tongji.edu.cn)
[ABSTRACT]AIM: To investigate the protect effect of Chinese herbal preparation,Qing Yi TangⅡgranule ( QYT),on acute pancreatitis ( AP) mice and its mechanism.METHODS: Adult male and female C57BL/6 mice ( n = 24) were randomly divided into control group,AP group and AP + QYT group.Severe AP was induced by combined intraperitoneal injection of caerulein ( 50 μg/kg) and lipopolysaccharide ( LPS; 10 mg/kg).Drinking water or 24% QYT solution was given to the mice in AP group or AP + QYT group by oral gavage.The mice in control group were intraperitoneally injected with equivalent volume of normal saline and gavaged with water.The mice were sacrificed 3 h after the last injection.Severity of AP was assessed by biochemical markers and histology.The plasma level of IL-6 and MCP-1,and lung myeloperoxidase ( MPO) levels were determined for assessing the extent of systemic inflammatory response.The intestinal microflora,T lymphocytes and T-lymphocyte subgroups were examined for assessing the function of the intestinal barrier.RESULTS: Compared with control group,the mice in AP group presented significant increases in pathological histological scores,plasma amylase activity and IL-6 and MCP-1 levels,as well as the MPO activity in the lung and pancreatic tissues.QYT attenuated these changes to some extent.Furthermore,the increased intestinal microflora was significantly reversed by QYT.No difference of the numbers of Peyer’s patches in small intestine in the 3 groups was observed,but the percentage of CD3+T lymphocytes decreased significantly in AP group,and increased percentage of CD4+and CD4+/CD8+ratio were found in AP group and AP + QYT group.CONCLUSION: QYT protects against cearulein and LPS-induced acute pancreatitis in mice.The mechanisms may be related to the suppression of the inflammatory response,promoting intestinal bacteria removal,and regulating the functions of T lymphocytes in the intestinal barrier.
[KEY WORDS]Qing Yi TangⅡgranule; Acute pancreatitis; Inflammatory mediators; Intestinal microflora; Peyer’s patches
通讯作者△Tel: 021-65981021; E-mail: liyongyu@ tongji.edu.cn
*[基金项目]国家自然科学基金资助项目( No.81270477)
[收稿日期]2015-01-12[修回日期]2015-04-03
[文章编号]1000-4718( 2015)07-1282-06
[中图分类号]R363. 2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.023
