慢性乙型肝炎和原发性肝癌患者体内人腺病毒5型、26型及黑猩猩腺病毒68型中和抗体的流行率
2015-05-16熊域皎赵启全章述军黄文祥周向阳重庆医科大学附属第一医院感染科重庆市传染病寄生虫病学重点实验室重庆40006Wistar研究所美国费城904
熊域皎,赵启全,章述军,黄文祥,周向阳,,贾 蓓△(重庆医科大学附属第一医院感染科,重庆市传染病寄生虫病学重点实验室,重庆40006;Wistar研究所,美国费城904)
慢性乙型肝炎和原发性肝癌患者体内人腺病毒5型、26型及黑猩猩腺病毒68型中和抗体的流行率
熊域皎1,赵启全1,章述军1,黄文祥1,周向阳1,2,贾蓓1△
(1重庆医科大学附属第一医院感染科,重庆市传染病寄生虫病学重点实验室,重庆400016;2Wistar研究所,美国费城19104)
[摘要]目的:调查慢性乙型病毒性肝炎( CHB)和原发性肝癌( PLC)患者体内人腺病毒5型( AdHu5)、26 型( AdHu26)和黑猩猩腺病毒68型( AdC68)中和抗体的流行率,为这2种疾病开发安全有效的生物治疗载体提供依据。方法:我们收集196份CHB患者的血清和193份PLC患者的血清,通过腺病毒中和实验检测血清中AdHu5、AdHu26和AdC68的中和抗体。结果:在CHB患者中AdHu5、AdHu26和AdC68中和抗体的阳性率分别为84. 7%、58. 2%及39. 8%;在PLC患者中AdHu5、AdHu26和AdC68中和抗体的阳性率分别为75. 1%、66. 8%及32. 1%。结论:本次实验显示3种腺病毒中和抗体的流行率和抗体滴度都以AdC68的最低,故其作为CHB和PLC的生物治疗载体较AdHu5与AdHu26具有优势。
[关键词]慢性乙型病毒性肝炎;原发性肝癌;腺病毒;中和抗体
目前对于慢性乙型病毒性肝炎( chronic hepatitis B,CHB)的病毒清除和原发性肝癌( primary liver cancer,PLC)的进展控制尚缺乏十分有效的药物,基因治疗和疫苗的开发是近年来关注的重点之一,而携带靶向基因的载体是决定效率的重要因素。腺病毒载体具有高效低毒嗜肝性的特性,且肝脏是其基因表达的主要靶向器官,目前广泛应用于CHB和PLC生物治疗,最常用的为人腺病毒5型( human adenovirus type 5,AdHu5) ;然而,腺病毒载体由于其高度的免疫原性,导致在基因治疗过程中的作用受到一定限制[1-3],发现病人或是被接种对象体内已存在有该型腺病毒的中和抗体,会直接清除腺病毒载体及其携带的基因,导致得不到预期的表达或是完全不表达,使免疫或治疗失败[4-5]。有大约50多种腺病毒可能感染人类[6],因此选择合适的腺病毒载体对提高生物治疗和开发高效的疫苗非常必要,选择不常见的腺病毒血清型[如人腺病毒26型( human adenovirus type 26,AdHu26)]或动物腺病毒血清型[如黑猩猩腺病毒68型( chimpanzee adenovirus type 68,AdC68)]是降低其免疫原性、提高生物治疗疗效的最新研究方向。既往中国国内研究表明,AdHu5中和抗体在中国人群中存在高流行率,但对AdHu26 和AdC68的研究较少,且没有对CHB和PLC人群进行相关的研究[7]。因此,我们收集了重庆地区196 份CHB患者血清和193份PLC患者血清进行血清中和实验,以评估这类人群中AdHu5、AdHu26和AdC68血清中和抗体的流行情况,为相关腺病毒对CHB和PLC的生物治疗提供依据。
材料和方法
1材料
1.1主要质粒和细胞AdHu5、AdHu26和AdC68的腺病毒质粒由美国Wistar实验室惠赠,3种腺病毒都表达绿色荧光蛋白( green fluorescent protein,GFP) ;人肾胚细胞HEK293细胞购自ATCC。
1.2动物SPF级BALB/c小鼠,6~8周龄,体重( 20±4) g,由重庆医科大学动物实验中心提供,动物实验经过重庆医科大学动物实验伦理委员会批准。
1.3主要试剂和耗材胎牛血清( Gibco) ; DMEM高糖培养基和胰蛋白酶( HyClone) ;磷酸钙转染试剂盒( Invitrogen) ;限制性内切酶Pac I( NEB) ; 96孔板( Corning) ;磷酸盐缓冲溶液PBS和移液器吸头(北京鼎国生物技术有限公司)。
2主要方法
2.1血清样本血清样本来自于重庆医科大学附属第一医院2010年12月~2011年9月住院患者中的196位CHB患者和193位PLC患者。CHB患者以乙肝两对半表面抗原阳性,乙肝病史大于1年为标准,患者年龄范围在17~79岁,男女比例为157∶39; PLC患者以典型的PLC影像学表现和(或)肝组织活检证实,并排除肝血管瘤和转移性肝癌为标准,患者的年龄范围在17~75岁,男女比例为145∶48。收集的血标本离心( 3 000 r/min,5 min)后将上清液标本存于-80℃冰箱。
2.2细胞培养HEK293细胞是含腺病毒E1区的人肾胚细胞系,用含10%胎牛血清的DMEM高糖培养基,置于37℃5%、CO2培养箱中培养。待细胞达到80%~90%融合后,用胰蛋白酶消化细胞,按1∶3比例进行传代培养。
2.3重组腺病毒AdHu5、AdHu26和AdC68的腺病毒质粒在HEK293细胞中包装出病毒后(磷酸钙转染法),并在HEK293细胞中进行大量扩增,再用改良的氯化铯密度梯度离心法纯化腺病毒,收集纯化腺病毒(浓度约5×1015VP/L,VP即病毒颗粒)保存于-80℃。
2.4阳性对照血清的制备取100 μL浓度为1× 1014VP/L的腺病毒肌注小鼠左后腿肌肉,3周以后同一部位重复注射1次,1周后收集小鼠血清获得阳性对照,分装保存于-80℃。每种腺病毒分别注射4只雌性小鼠。
2.5腺病毒中和滴定实验实验前将病人血清标本置于56℃恒温水浴中灭活30 min。在96孔板的第1排孔中加入10 μL的病人血清样本,并在第1排孔最末2个孔分别加10 μL DMEM高糖培养基和10 μL的小鼠阳性血清(分别作为阴性对照组和阳性对照组),再每孔加入90 μL含10%胎牛血清的DMEM高糖培养基在第1排孔,同时其余各孔加入50 μL 的10%胎牛血清的DMEM高糖培养基。将96孔板第1排孔中吸取50 μL混合液加入对应的第2排孔中,再取50 μL混合液加入第3排孔,以此类推,将患者血清标本从1∶10~1∶1 280进行稀释(倍比稀释法),每个病人血清标本每个稀释度做2个复孔,最后每孔加入50 μL经方阵滴定实验筛选出的最佳腺病毒量。将此加样好的96孔板置于37℃、5% CO2培养箱中培养1 h,再每孔加入50 μL约2. 5×104个HEK293细胞,放回培养箱继续培养。36 h后取出HEK293细胞置于倒置荧光显微镜( Olympus)下观察结果,与阴性对照组比较,以绿色荧光较阴性对照组下降50%且滴度≥20为阳性结果。以血清样本稀释度的倒数作为腺病毒中和抗体的滴度。
3统计学处理
数据经SPSS 19. 0统计软件进行分析,比较AdHu5、AdHu26和AdC68血清中和抗体的流行率采用χ2检验,3种血清型的腺病毒中和抗体滴度的比较运用Friedman检验,以P<0. 05为差异有统计学意义。
结果
1 CHB患者各型腺病毒血清学分析结果
1.1CHB患者中腺病毒中和抗体的流行率196 名CHB患者中AdHu5中和抗体阳性率高达84. 7%,AdHu26中和抗体阳性率为58. 2%,AdC68中和抗体阳性率为39. 8%。AdHu5中和抗体阳性率显著高于AdHu26,AdHu26中和抗体阳性率显著高于AdC68( P<0. 05),见表1。
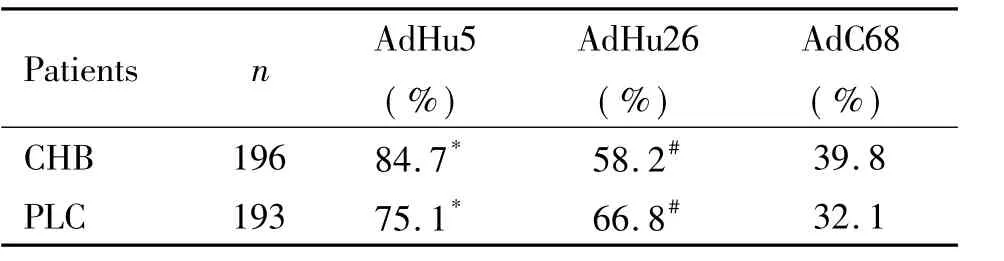
表1 腺病毒AdHu5、AdHu26和AdC68在CHB和PLC患者中的中和抗体阳性率Table 1.Seroprevalence of AdHu5,AdHu26 and AdC68 neutralizing antibodies in CHB and PLC patients
1.2CHB患者中AdHu5、AdHu26和AdC68的中和抗体滴度的分布情况在CHB患者中AdHu5显示出高滴度的中和抗体,其中中和抗体滴度在1 280及以上占46. 4%,而AdHu26中和抗体滴度≥1 280的仅占11. 2%; AdC68中和抗体滴度集中在20~160,占阳性者的97. 4%,中和抗体滴度在1 280及以上的占阳性者的0. 05%,显示出低滴度流行,见图1。

Figure 1.Distribution of AdHu5,AdHu26 and AdC68 neutralizing antibody titers in CHB and PLC patients.图1 腺病毒AdHu5、AdHu26和AdC68的中和抗体滴度在CHB和PLC患者中的分布
1.3CHB患者中腺病毒中和抗体在不同年龄和性别中的分布情况在表2中可以看出,CHB患者3种腺病毒中和抗体阳性率在各个年龄组之间没有明显区别,没有随着年龄增长的趋势( P>0. 05)。CHB患者的男女比例为157∶39,3种腺病毒中和抗体流行率在男女性别之间没有显著差异( P>0. 05),见表3。

表2 腺病毒AdHu5、AdHu26和AdC68在CHB和PLC患者中的不同年龄组的中和抗体阳性率Table 2.Seroprevalence of AdHu5,AdHu26 and AdC68 neutralizing antibodies in different age groups of CHB and PLC patients( %)

表3 腺病毒AdHu5、AdHu26和AdC68在CHB和PLC男女患者中的中和抗体阳性率Table 3.Seroprevalence of AdHu5,AdHu26 and AdC68 neutralizing antibodies between male and female ( %)
2 PLC患者中各型腺病毒的血清学分析结果
2.1PLC患者中腺病毒中和抗体的流行率193名PLC患者中AdHu5中和抗体阳性率高达75. 1%,AdHu26中和抗体阳性率为66. 8%,AdC68中和抗体阳性率为32. 1%。AdHu5的中和抗体阳性率与AdHu26的中和抗体阳性率没有显著差别( P>0. 05),AdHu5和AdHu26中和抗体阳性率显著高于AdC68( P<0. 05),见表1。
2.2PLC患者中AdHu5、AdHu26和AdC68的中和抗体滴度的分布情况在193名PLC患者中,AdHu5仍显示出高滴度的中和抗体,中和抗体滴度≥1 280的占19. 7%,明显高于AdHu26在该范围的比例; AdHu26的中和抗体滴度在20~160居多; AdC68中和抗体滴度<20的占67. 9%,其中中和抗体滴度在20~160的占32. 1%,≥1 280的没有检测到,显示出低滴度流行,见图1。
2.3PLC患者中腺病毒中和抗体在不同年龄组和性别中的分布情况在表2中可以看出,PLC患者中3种腺病毒中和抗体阳性率在各个年龄组之间没有明显区别,没有随着年龄增长的趋势。PLC患者的男女比例为145∶48。3种腺病毒中和抗体在男女间的流行率没有显著差异( P>0. 05),见表3。
讨论
我国是CHB高度流行区,其是导致PLC的首位原因;肝细胞肝癌是常见的严重影响身体健康的恶性肿瘤,我国肝癌患病率高,据统计,全球半数以上肝癌患者来自我国[8-10]。目前对其具有前景的一种治疗手段是应用腺病毒载体进行基因治疗和疫苗开发。腺病毒载体宿主细胞范围广泛,既可以感染分裂细胞又可以感染非分裂细胞,容易制备高滴度病毒粒子;而且在受染细胞内不发生整合,因此没有致癌和致突变的危险,并可插人大片段的外源基因,是生物治疗的理想载体[11-13]。但由于人类在幼年时期普遍感染过腺病毒AdHu5,进入人体会产生高滴度的中和抗体,导致其携带的基因表达下降,且应用时需要短期重复注射,也造成毒性增加。AdHu5的高流行率使其不适用于基因治疗,策略包括寻找在人群中具有低流行率的血清型的腺病毒或者改造AdHu5的表壳结构。
为使以腺病毒为载体的疫苗或基因治疗能最大限度地发挥作用,了解腺病毒中和抗体在该人群中的分布情况及其滴度是有效治疗的基础,血清中和试验检测特定血清型病毒的中和抗体存在情况,是目前可利用的血清学方法中较客观的一种途径[7]。
本次研究的196位CHB患者和193位PLC患者中,CHB患者男女比例为157∶39,PLC患者男女比例为145∶48,这可能与男性较女性更易得肝病有关,但无论CHB还是PLC病人的年龄和性别的差异并不影响各型腺病毒的血清中和抗体流行率的高低,这与在中国健康人群中的研究结果一致。AdHu5和不常见的人腺病毒AdHu26、黑猩猩腺病毒AdC68在CHB患者和PLC患者人群中的免疫趋势与健康普通人群也是一致的,其中AdHu5的流行率最高,但AdHu26流行率较中国健康人群和以往其余地方的的调查结果高[14],AdC68在重庆地区CHB和PLC患者中的流行率也明显高于中国健康人群的结果,而且AdHu5、AdHu26和AdC68在CHB患者和PLC患者人群中的流行率都比重庆地区的健康人群高[15],这是否由于肝病患者免疫功能的紊乱对腺病毒易感性增强,血清学反应异于健康人或者肝炎病毒与这几型腺病毒有交叉反应,尚有待于进一步研究。我们曾经对来自新疆的HIV高危人群进行AdHu5、AdHu26和AdC68腺病毒血清型的检测,也发现AdHu26和AdC68血清中和抗体的阳性率显著高于普通健康人群水平。尽管在CHB和PLC人群中总的抗体水平较高,但AdHu26和AdC68以低抗体滴度水平存在,高滴度水平相当低,尤其是AdC68,其最早成功应用于狂犬病毒的疫苗制备,具有低毒和优秀的免疫效果,AdC68的健康人群血清流行率在欧美和东南亚地区很低,而在非洲地区差异较大[16],尽管在重庆地区CHB和PLC人群中的流行率显著高于其他国家地区,但大部分抗体滴度水平在20~160,因此作为载体应用其效率远优于AdHu5,当然由于其来自动物,安全性尚待进一步验证。
本实验对重庆地区的CHB和PLC患者的人及黑猩猩腺病毒的血清流行率进行分析,结果表明AdHu5在该人群中有很高的流行率,如果不对其进行如表壳改造而用于基因治疗将可能导致治疗的失败;而AdHu26是最新开发的一种人腺病毒载体,但可惜也有很高的中和抗体流行率,不足以代替AdHu5,黑猩猩腺病毒AdC68用于CHB和PLC的基因治疗可能会有很好的前景。
[参考文献]
[1]Bessis N,GarciaCozar FJ,Boissier MC.Immune responses to gene therapy vectors: influence on vector function and effector mechanisms[J].Gene Ther,2004,11( Suppl 1) : S10-S17.
[2]Fitzgerald JC,Gao GP,Reyes-Sandoval A,et al.A simian replication-defective adenoviral recombinant vaccine to HIV-1 gag[J].J Immunol,2003,170 ( 3) : 1416-1422.
[3]Nunes FA,Furth EE,Wilson JM,et al.Gene transfer into the liver of nonhuman primates with E1-deleted recombinant adenoviral vectors: safety of readministration[J].Hum Gene Ther,1999,10( 15) : 2515-2526.
[4]Tatsis N,Ertl HC.Adenoviruses as vaccine vectors[J].Mol Ther,2004,10( 4) : 616-629.
[5]Chirmule N,Propert K,Magosin S,et al.Immune responses to adenovirus and adeno-associated virus in humans [J].Gene Ther,1999,6( 9) : 1574-1583.
[6]Appaiahgari MB,Pandey RM,Vrati S.Seroprevalence of neutralizing antibodies to adenovirus type 5 among children in India: implications for recombinant adenovirus-based vaccines[J].Clin Vaccine Immunol,2007,14 ( 8) : 1053-1055.
[7]Sun C,Zhang Y,Feng L,et al.Epidemiology of adenovirus type 5 neutralizing antibodies in healthy people and AIDS patients in Guangzhou,southern China[J].Vaccine,2011,29( 22) : 3837-3841.
[8]Fan JH,Wang JB,Jiang Y,et al.Attributable Causes of liver cancer mortality and incidence in China[J].Asian Pac J Cancer Prev,2013,14( 12) : 7251-7256.
[9]周嘉嘉,陈汝福,邓小耿,等.沉默NANOG表达对人肝癌细胞HepG2中cyclin D1表达及细胞增殖的影响[J].中国病理生理杂志,2014,30( 2) : 245-249.
[10]刘丽璇,吴灵飞,邓巍,等.丹参酮IIA对低氧条件下人肝癌HepG2细胞增殖、凋亡的影响及与HIF-1、VEGF和野生型P53蛋白表达的关系[J].中国病理生理杂志,2014,30( 12) : 2155-2160.
[11]Alden TD,Pittman DD,Beres EJ,et al.Percutaneous spinal fusion using bone morphogenetic protein-2 gene therapy[J].J Neurosurg,1999,90( 1 Suppl) : 109-114.
[12]Alden TD,Pittman DD,Hankins GR,et al.In vivo endochondral bone formation using a bone morphogenetic protein 2 adenoviral vector[J].Hum Gene Ther,1999,10 ( 13) : 2245-2253.
[13]张文峰,张琼宇,邵红伟,等.5型腺病毒载体对人T淋巴细胞的转染及细胞毒性分析[J].中国病理生理杂志,2014,30( 2) : 318-322.
[14]Ersching J,Hernandez MI,Cezarotto FS,et al.Neutralizing antibodies to human and simian adenoviruses in humans and New-World monkeys[J].Virology,2010,407 ( 1) : 1-6.
[15]Zhang S,Huang W,Zhou X,et al.Seroprevalence of neutralizing antibodies to human adenoviruses type-5 and type-26 and chimpanzee adenovirus type-68 in healthy Chinese adults[J].J Med Virol,2013,85( 6) : 1077-1084.
[16]Xiang Z,Li Y,Cun A,et al.Chimpanzee adenovirus antibodies in humans,sub-Saharan Africa[J].Emerg Infect Dis,2006,12( 10) :1596-1599.
Seroprevalence of neutralizing antibodies to human adenovirus type 5,human adenovirus type 26 and chimpanzee adenovirus type 68 in patients with chronic hepatitis B and patients with primary liver cancer
XIONG Yu-jiao1,ZHAO Qi-quan1,ZHANG Shu-jun1,HUANG Wen-xiang1,ZHOU Xiang-yang1,2,JIA Bei1
(1Department of Infectious Diseases,The First Affiliated Hospital of Chongqing Medical University,Chongqing Key Laboratory of Infectious Diseases and Parasitic Diseases,Chongqing 400016,China;2The Wistar Institute,Philadelphia 19104,USA.E-mail: beija7410@163.com)
[ABSTRACT]AIM: To investigate the seroprevalence of neutralizing antibodies to human adenovirus type 5 ( AdHu5),human adenovirus type 26 ( AdHu26) and chimpanzee adenovirus type 68 ( AdC68) in the patients with chronic hepatitis B ( CHB) and the patients with primary liver cancer ( PLC),and to provide guidance for developing safe and effective biotherapy vectors against CHB and PLC.METHODS: The blood samples from 196 patients with CHB and 193 patients with PLC were examined to assess the presence of neutralizing antibodies against AdHu5,AdHu26 and AdC68 by adenovirus neutralization assays.RESULTS: The seroprevalence rates of neutralizing antibodies to AdHu5,AdHu26 and AdC68 in the CHB patients were 84. 7%,58. 2% and 39. 8%,respectively.Among the patients with PLC,the prevalence rates of neutralizing antibodies were as follows: AdHu5,75. 1%; AdHu26,66. 8%; AdC68,32. 1%.CONCLUSION: The prevalence rates and titers of neutralizing antibodies against AdC68 were the lowest among the 3 adenoviruses.Therefore,AdC68 serves as more suitable biological therapy vectors for CHB and PLC than AdHu5 and AdHu26.
[KEY WORDS]Chronic hepatitis B; Primary liver cancer; Adenoviruses; Neutralizing antibodies
通讯作者△Tel: 023-89012430; E-mail: beijia7410@163.com
[收稿日期]2015-02-06[修回日期]2015-04-10
[文章编号]1000-4718( 2015)07-1272-05
[中图分类号]R511. 8; R181. 32
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.021
