氧化应激激活JNK-MAPK参与波动性高血糖诱导的大鼠肝细胞损伤*
2015-05-16李素娟金可可赵亚萍赵文玺高凯旋杨文娟王加林吴德平中国人民解放军第八十二医院内分泌科江苏淮安300温州医科大学病理生理学教研室浙江温州35035
李素娟,金可可,赵亚萍,王 鹏,赵文玺,高凯旋,杨文娟,王加林,吴德平△(中国人民解放军第八十二医院内分泌科,江苏淮安300;温州医科大学病理生理学教研室,浙江温州35035)
氧化应激激活JNK-MAPK参与波动性高血糖诱导的大鼠肝细胞损伤*
李素娟1,金可可2,赵亚萍1,王鹏1,赵文玺1,高凯旋1,杨文娟1,王加林1,吴德平1△
(1中国人民解放军第八十二医院内分泌科,江苏淮安223001;2温州医科大学病理生理学教研室,浙江温州325035)
[摘要]目的:探讨波动性高血糖引起糖尿病大鼠肝细胞凋亡的机制。方法: SD大鼠随机均分为4组:正常对照组、稳定高血糖组、波动高血糖组和胰岛素组。采用链脲佐菌素65 mg/kg腹腔注射诱发糖尿病,波动高血糖组每天定时腹腔注射速效胰岛素,并错时给予葡萄糖,造成1 d中血糖浓度大幅度波动,12周内波动高血糖组每天血糖波动模式相似,且HbA1c与稳定高血糖组无显著差异。12周后取血和肝脏组织,采用比色法检测超氧化物歧化酶( SOD)和谷胱甘肽过氧化物酶( GSH-Px)活性以及丙二醛( MDA)和一氧化氮( NO)含量,RT-PCR和Western blot检测JNK、p-JNK、Bax和Bcl-2的含量。结果:与正常对照组比较,稳定高血糖组、胰岛素组和波动高血糖组的食物量、饮水量和尿量增加,肝功能异常; MDA含量增多,SOD和GSH-Px活性降低,NO含量减少( P<0. 05) ; JNK mRNA、p-JNK蛋白及Bax蛋白水平上调( P<0. 05),Bcl-2表达减少( P<0. 01) ;且波动高血糖组的以上变化均较稳定高血糖和胰岛素组更加明显( P<0. 05)。结论:波动性高血糖较稳定性高血糖更促进糖尿病肝细胞的凋亡,其机制与JNK-MAPK信号转导通路激活有关。
[关键词]肝细胞;血糖波动;氧化应激; JNK-MAPK信号通路
慢性持续高血糖和波动性高血糖对糖尿病的预后及慢性并发症的发生和发展密切相关[1],而且糖尿病患者血糖波动越大,慢性并发症的发生率越高、预后就越差。我们前期研究也发现,糖尿病大鼠明显血糖波动可加速肾小管上皮细胞凋亡[2-5]。研究表明,急性血糖波动要比持续的高血糖状态更能促进氧化应激反应的发生,与JNK-MAPK通路密切相关[6-7]。因此,本研究旨在观察氧化应激和JNKMAPK在波动性高糖诱导的肝细胞凋亡中的作用,以探讨波动性高糖比稳定性高糖引起更严重的肝细胞凋亡的机制。
材料和方法
1动物
SPF级雄性Sprague-Dawley( SD)大鼠30只,体重( body weight,BW) 180~220 g,由温州医科大学实验动物中心提供,动物许可证号为SYXK(浙2010-0150)。
2主要试剂
链脲菌素( streptozotocin,STZ)及枸橼酸钠分析纯购于Sigma;葡萄糖购于天津药业集团新郑股份有限公司;普通速效胰岛素购于江苏万邦生化有限公司;强生稳步倍加血糖仪及配套的试纸购于Johnson;丙二醛( malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶( superoxide dismutase,SOD)试剂盒及谷胱甘肽过氧化物酶( glutathione peroxidase,GSH-Px)试剂盒均购自南京建成生物工程研究所;兔抗大鼠JNK、磷酸化JNK、Bax、Bcl-2和内参照GAPDH多克隆抗体均购自CST; TRIzol试剂购自Invitrogen;逆转录试剂盒购自MBI。
3主要方法
3.1动物模型制备及分组依据参考文献方法建立糖尿病模型[8-9],本实验雄性SD大鼠24只随机均分为4组,每组8只:正常对照( normal control,N)组,稳定性高血糖( stable high blood glucose,S)组,波动性高血糖( fluctuant high blood glucose,F)组,胰岛素( insulin,I)组,S、F和I组均一次性腹腔内注射STZ 65 mg/kg,N组给予同剂量的枸橼酸钠缓冲液。72 h后,尾部取血,测空腹血糖和刺激大鼠膀胱测尿糖,如果血糖>16. 7 mmol/L、尿糖+ + +,则造模成功; F组每天3次腹部皮下注射胰岛素20 U/kg,第1次注射时间是每天7: 30,第2次注射时间是每天11 ∶:30,第3次注射时间是每天15: 30;并每天3次腹腔注射葡萄糖2. 5 g/kg,第1次注射时间是每天10: 00,第2次注射时间是每天14: 00,第3次注射时间是每天18: 00,造成血糖波动模型。F组大鼠每天给予胰岛素时,I组给予同等剂量的胰岛素,其它组给予等剂量的生理盐水,F组给予葡萄糖时,N组、S组和F组均给予等剂量的生理盐水。F组12周内每天血糖波动模式相似,且糖化血红蛋白( glycosylated hemoglobin A1c,HbA1c)与S组无显著差异,则说明波动性高血糖造模成功。12周后腹主动脉取血,用于生化指标检测,取肝脏用于肝脏指数测定,并观察肝脏组织JNK-MAPK蛋白和mRNA的表达。
3.2一般情况记录大鼠体质量、饮水量、食物量和尿量。
3.3生化指标的检测采用Johnson稳步倍加血糖仪测定血糖,亲和层析-高效液相色谱法( HPLC)测定HbA1c的含量;采用雅培C8000生化分析仪检测白蛋白( albumin,ALB)、白蛋白与球蛋白比值(白球比)、天冬氨酸氨基转移酶( aspartate aminotransferase,AST)和丙氨酸氨基转移酶( alanine aminotransferase,ALT)。
3.4肝指数的测定取出整个肝脏,滤纸吸干血迹后电子天平秤重得肝湿重,肝湿重与体重的比为肝指数。
3.5氧化应激指标的测定取肝脏组织均浆,化学比色法测定SOD和GSH-Px活性及MDA和NO含量,操作均严格按照试剂盒说明书进行。
3.6肝脏形态学的观察取肝脏组织用4%多聚甲醛-PBS缓冲液固定,常规石蜡制片(厚度5 μm),HE染色,光学显微镜观察并拍照。另取肝脏组织行超微结构观察,用冷刀片取肝脏( 0. 5~1) mm×1 mm ×1 mm大小的组织块,迅速用2. 5%的冷戊二醛溶液固定。经过1% OsO4后固定、梯度丙酮脱水、环氧树脂浸透、包埋、切片,醋酸铀和柠檬酸铅染色,透射电镜下观察。
3.7Western blot检测蛋白含量取肝脏组织( 100 mg)剪碎转移至玻璃匀浆器中,加入含PMSF的裂解液1 mL,匀浆以充分裂解肾组织,12 000×g离心,取上清用BCA法测定蛋白质浓度。取100 μg蛋白上样于12%聚丙烯酰胺凝胶电泳并转印至PVDF膜上,5%脱脂奶粉室温封闭1. 5 h,分别加入1∶1 000稀释的抗兔多克隆抗体p-JNK、JNK、Bax、Bcl-2和GAPDH抗体,4℃静置孵育过夜,TBST洗膜后加入辣根过氧化物酶标记的羊抗兔II抗( 1∶3 000),室温孵育1. 5 h,膜于化学发光检测试剂反应5 min,暗室中用X胶片感光、显影1 min、定影15 min。扫描各种样品的蛋白条带的吸光度( A),并分别算出与正常对照组A值的比值,以求出其活化倍数。
3.8RT-PCR检测mRNA表达各取约60~100 μg肝脏组织,采用Trizol试剂盒提取总RNA,再使用分光光度计在260/280 nm处检测总RNA的质量和纯度之后,使用cDNA合成试剂盒将mRNA反转录为cDNA,cDNA采用相应特异性引物进行PCR扩增,引物由Invitrogen上海合成分部合成。PCR引物序列如下: JNK的上游引物为5’-AAC GAC CTT CTA CGA CGA TG-3’,下游引物为5’-GCA GCG TAT TCT GGC TAT GC-3’,扩增产物为367 bp[10-11];β-actin的上游引物为5’-GAG ACC TTC AAC ACC CCA GCC-3’,下游引物为5’-TCG GGG GAT CGG AAC CGC TCA-3’,扩增产物为400 bp。行JNK和β-actin共扩增,PCR反应过程参数如下: 94℃5 min; 98℃10 s,54℃20 s,72℃50 s,共32个循环。取PCR反应产物8 μL,在20 g/L琼脂糖凝胶上电泳45 min,图像分析仪采集图像,以内参照β-actin为基准,作半定量分析。目的基因相对表达量为目的基因条带光密度与内参照基因条带光密度的比值。
4统计学处理
用SPSS 16. 0统计软件进行分析。数据均采用均数±标准差( mean±SD)表示,多组间比较采用单因素方差分析( one-way ANOVA),组间两两比较采用最小显著性差异法( LSD)法,以P<0. 05为差异有统计学意义。
结果
1各组大鼠的体重及造模成功率
N组大鼠体型适中,精神状况良好,动作自如,反应灵敏,毛发平伏有光泽,12周末各组大鼠的体重为( 521. 67±44. 71) g,造模成功率为100%。S组、I组和F组大鼠消瘦,精神萎靡,反应迟钝,毛竖无光泽,动作迟缓,弓背蜷体。S组体重为( 361. 00± 106. 68) g,造模成功率为80%; I组体重为( 341. 00± 65. 70) g,造模成功率为70%; F组体重为( 254. 17± 67. 69) g,造模成功率为60%。
2各组大鼠血糖浓度及HbA1c的范围
N组血糖为5.40~6.25 mmol/L,S组为19.15~23.65 mmol/L,F组为6.17~30.33 mmol/L,I组血糖为12.17~23.83 mmol/L;波动性高血糖组大鼠1 d中的血糖浓度出现明显的波动,稳定性高血糖组大鼠1 d中的血糖浓度基本处于高水平状态。HbA1c在N组为( 5.10 ±0.32) %,S组为( 10.50±0.69) %,F组为( 10.13± 0.96) %,I组为( 10.30±0.56) %,S组与F组比较无显著差异( P>0.05),见图1。

Figure 1.Blood glucose variation curve of different groups.Mean ±SD.n = 8.**P<0. 01 vs N group;#P<0. 05,##P<0. 01 vs S group;P<0.05,P<0.01 vs F group.图1 各组大鼠血糖浓度的变化曲线
34组大鼠饮食量、饮水量、尿量每日的变化情况
与N组比较,S组、F组和I组的饮食量、饮水量、尿量的每日变化都明显增加( P<0. 05),与S组比较,F组的变化最明显( P<0. 05),见表1~3。

表1 各组大鼠饮食量的变化Table 1.The changes of the food intake in the rats with different treatments ( g·g-1·d-1.Mean±SD.n =8)

表2 各组大鼠饮水量的变化Table 2.The changes of the drinking volume in the rats with different treatments ( ml·g-1·d-1.Mean±SD.n =8)

表3 各组大鼠尿量的变化Table 3.The volumes of the urinary output in the rats with different treatments ( ml·g·-1·d-1.Mean±SD.n =8)
44组大鼠生化指标及肝脏指数的的比较
与N组比较,S组、F组和I组的ALT、AST、 ALB、白球比及肝脏指数增高;与S组比较,F组和I组的数值较高,见表4。

表4 各组大鼠ALT、AST、ALB、白球比和肝脏指数的比较Table 4.The changes of ALT,AST,ALB,A/G and liver function in the rats with different treatments ( Mean±SD.n =8)
5波动性高血糖对肝脏组织氧化应激的影响
与N组比较,其它各组的SOD和GSH-Px活性及NO含量明显降低,且F组更低于S组和I组( P< 0. 05) ; S组、F组和I组的MDA含量明显升高,且F组高于S组和I组( P<0. 05),见表5。

表5 波动性高血糖对肝脏组织SOD和GSH-Px活性以及MDA和NO含量的影响Table 5.The effects of glucose fluctuation on SOD and GSH-Px activity,and MDA and NO content in the liver of the rats with different treatments ( Mean±SD.n =8)
6各组大鼠肝脏形态观察
HE染色光镜(×40)观察可见N组大鼠肝脏切片的肝小叶结构清晰完整,肝索排列整齐,肝细胞呈多边形,胞浆丰富,核圆位于中央,肝细胞内无脂肪空泡; F组大鼠肝板结构破坏,细胞排列紊乱、增大、核大小不等,细胞内有明显脂肪变性,胞浆内可见大小不等、数量不一的脂肪空泡,有的较小为脂滴样散布于核周,有的较大位于整个胞浆,严重者胞核被脂滴挤向一侧,成印戒样改变; S组和I组虽然也存在空泡和炎症细胞,但较N组明显减少,见图2。
透射电镜观察超微结构可见N组的肝细胞核规则,线粒体有完整的膜和嵴,内质网排列整齐; S组和I组的肝细胞核不规则,线粒体模糊,内质网增生,破裂,毛细胆管扩张有淤胆现象,少量的储脂细胞,有少量的颗粒沉积; F组肝细胞核不规则,线粒体肿胀、结构不清,粗面内质网丰富、脱颗粒,滑面内质网扩张,毛细胆管明显扩张,管壁增粗,腔内可见非定形物质,储脂细胞明显增生,脂质颗粒沉积,毛细胆管增生,结构紊乱,见图2。
7波动性高血糖对糖尿病大鼠脏脏Bcl-2和Bax表达的影响
Western blot结果表明,与N组比较,各组大鼠肝脏组织Bax蛋白的表达水平上调( P<0. 01),Bcl-2蛋白下降( P<0. 01),其中,F组比S组表达明显( P<0. 05),见图3。

Figure 3.The protein levels of Bax and Bcl-2 in rat liver tissues detected by Western blot.Mean±SD.n = 8.*P<0. 05 vs N group;#P<0. 05,##P<0. 01 vs S group;P<0. 05,P<0. 01 vs F group.图3 Western blot检测大鼠肝脏组织中Bax和Bcl-2蛋白的表达
8波动性高血糖对糖尿病大鼠肝脏p-JNK蛋白水平的影响
与N组比较,各组大鼠肝脏组织p-JNK蛋白水平上调( P<0. 01),其中F组高于S组( P<0. 05),比I组高( P<0. 01),见图4。
9波动性高血糖对糖尿病大鼠肝脏JNK mRNA表达的影响
与N组比较,各组大鼠肝脏组织JNK mRNA表达均上调( P<0. 01),其中F组高于S组( P<0. 05),比I组高( P<0. 01),见图5。
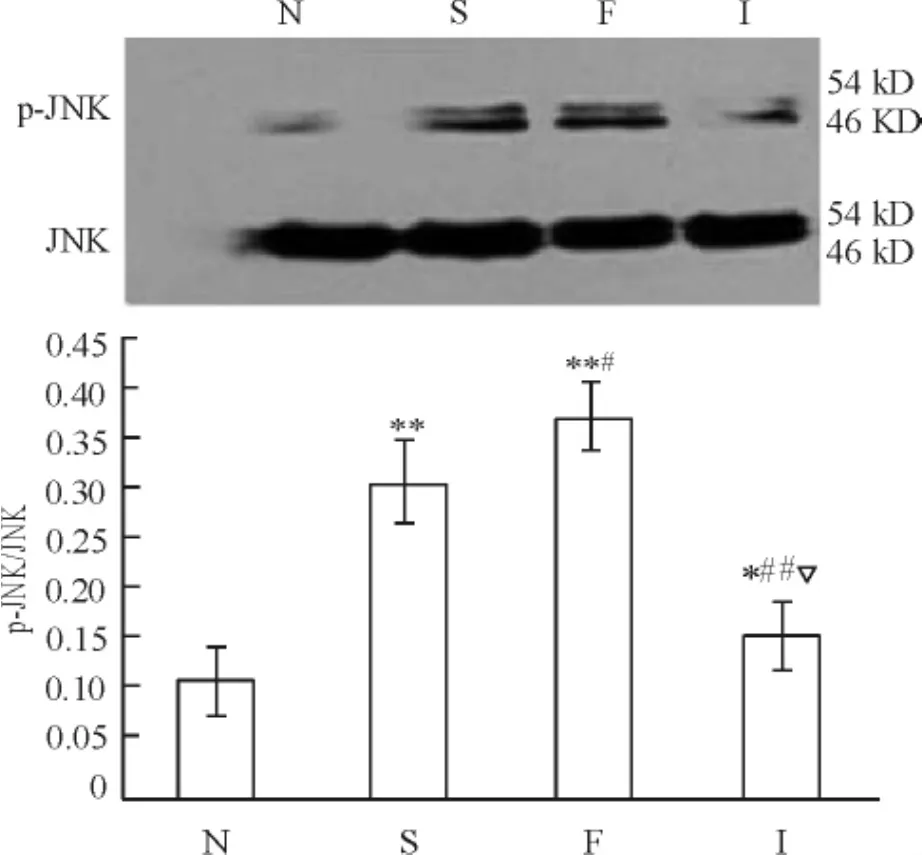
Figure 4.The protein level of p-JNK in rat liver tissues detected by Western blot.Mean±SD.n =8.*P<0. 05,**P <0. 01 vs N group;#P<0. 05,##P<0. 01 vs S group;P<0. 05 vs F group.图4 Western blot检测大鼠肝脏组织p-JNK蛋白的表达

Figure 5.The mRNA expression of JNK in the rat liver tissues.Mean±SD.n = 8.*P<0. 05,**P<0. 01 vs N group;#P<0. 05 vs S group;P<0. 01 vs F group.图5 肝脏组织JNK mRNA的表达
讨论
近年来研究表明,在HbA1c水平相同的情况下,血糖波动较大者慢性并发症的风险大大增加[12],且由于胰岛B细胞功能障碍,胰岛素抵抗,饮食控制不佳,用药的不合理等各种因素的存在,临床上糖尿病患者的血糖波动往往较大[13];故本研究采用临床实际的波动性高血糖大鼠模型与稳定性高血糖进行对比,以期进一步深入探讨糖尿病肝病的发病机制。在动物模型中,各组造模成功率不同,特别是波动性高血糖组造模成功率仅为60%,其它组在80~100%之间,对于造模成功率低的原因,分析主要为低血糖造成的昏迷死亡,高血糖、感染等影响因素也会导致死亡。在造模成功的大鼠中,进一步实验研究发现,链脲佐菌素诱导的糖尿病大鼠12周病程时出现了肝功能损害,同时伴有氧化应激水平升高。而最近发现糖尿病发生的急性血糖波动是触发氧化应激反应的一个额外因素[14],即血糖波动更容易引发氧化应激[15]。氧化应激在糖尿病及其并发症的发生发展过程中有着重要的作用[16-17]。本研究发现,稳定性高血糖、波动性高血糖诱导的肝细胞凋亡过程中均伴有SOD和GSH-Px活性及NO含量降低,MDA含量增加,且波动性高血糖组的上述改变更加明显,说明波动性高血糖引发的肝细胞氧化应激反应较稳定性高血糖增强。
体外实验均证实,氧化应激能导致JNK激活,JNK又是细胞凋亡发生过程中的重要调控者。一般认为,JNK被磷酸化激活后,能通过转录依赖或转录非依赖机制调控下游靶基因的表达或靶蛋白的活性而介导细胞凋亡。研究发现,JNK激活后可从胞质中转位入核,通过磷酸化激活c-Jun、c-Fos等转录因子而调节凋亡相关靶基因的转录表达。活化的JNK也可留在胞质内,催化Bcl-2家族的激活,调节细胞的凋亡[18]。本研究发现,与正常对照组比较,稳定高血糖组、胰岛素组和波动高血糖组肝脏JNK mRNA上调,p-JNK蛋白水平上调,Bax蛋白表达升高,Bcl-2蛋白下降。波动组的变化更明显。本研究发现糖尿病持续性高血糖组和波动性高血糖组肝脏组织中JNK蛋白的磷酸化水平均明显高于正常对照组,且波动性高血糖组较持续性高血糖组变化更为明显,这与其氧化应激水平和凋亡程度增加的趋势一致,提示血糖波动可能作为一种刺激信号,会引发较单纯高血糖更加严重的氧化应激反应,通过激活JNK,进而促进细胞凋亡。
[参考文献]
[1]王先令,陆菊明.血糖波动对糖尿病预后及其慢性并发症发生发展的影响[J].国外医学:内分泌学分册,2005,25( 3) : 169-171.
[2]金可可,林艳红,王万铁,等.血糖波动对糖尿病大鼠肾小球内皮细胞和肾小管上皮细胞凋亡的影响[J].中国病理生理杂志,2007,23( 3) : 570-573.
[3]李素娟,李剑敏,金可可,等.氧化应激和P53参与波动性高血糖诱导的肾小管上皮细胞凋亡[J].中国病理生理杂志,2011,27( 12) : 2302-2306.
[4]许益笑,李素娟,金可可,等.血糖波动对糖尿病大鼠肾脏氧化应激与凋亡的影响[J].中华内分泌代谢杂志,2012,28( 4) : 325-329.
[5]郝卯林,戴雍月,李素娟,等.JNK在血糖波动的糖尿病大鼠肾小管上皮细胞凋亡中的作用[J].中国应用生理学杂志,2012,28( 4) : 309-312.
[6]Monnier L,Mas E,Ginet C,et al.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes[J].JAMA,2006,295( 14) : 1681-1687.
[7]Ge QM,Dong Y,Zhang HM,et al.Effects of intermittent high glucose on oxidative stress in endothelial cells[J].Acta Diabetol,2010,47( Suppl 1) : 97-103.
[8]Azuma K,Kawamori R,Toyofuku Y,et al.Repetitive fluctuations in blood glucose enhance monocyte adhesion to the endothelium of rat thoracic aorta[J].Arterioscler Thromb Vasc Biol,2006,26( 10) : 2275-2280.
[9]Watada H,Azuma K,Kawamori R.Glucose fluctuation on the progression of diabetic macroangiopathy: new findings from monocyte adhesion to endothelial cells[J].Diabetes Res Clin Pract,2007,77( Suppl 1) : S58-S61.
[10]郑昌健,胡涵,曹红,等.JNK / MCP-1信号通路在姜黄素抗糖尿病神经病理性疼痛中的作用[J].中国病理生理杂志,2014,30( 11) : 1941-1945.
[11]Guido L,Manrique C.The expanding role of oxidative stress,renin angiotensin system,and β-cell dysfunction in the cardiometabolic syndrome and type 2 diabetes mellitus [J].Antioxi Redox Signal,2007,9( 7) : 943-954.
[12]Hirsch IB.Glycemic variability: it’s not just about A1C anymore![J].Diabetes Technol Ther,2005,7( 5) : 780-783.
[13]Aiello LP,Vignati L,Sheetz MJ,et al.Oral protein kinase C β inhibition using ruboxistaurin: efficacy,safety,and causes of vision loss among 813 patients ( 1,392 eyes) with diabetic retinopathy in the protein kinase C β inhibitor-diabetic retinopathy study and the protein kinase C β inhibitor-diabetic retinopathy study 2[J].Retina,2011,31( 10) : 2084-2094.
[14]Yaqoob M,McClelland P,Patrick AW,et al.Evidence of oxidant injury and tubular damage in early diabetic nephropathy[J].QJM,1994,87( 10) : 601-607.
[15]李金荣,王瑞英,张松筠.NADPH氧化酶在糖尿病肾病中的作用[J].国际内科学杂志,2009,36( 2) : 93-97.
[16]Lapshina EA,Sudnikovich EJ,Maksimchik JZ.Antioxidative enzyme and glutathione S-transferase activities in diabetic rats exposed to long-term ASA treatment[J].Life Sci,2006,79( 19) : 1804-1811.
[17]牟忠卿,陈丽.糖尿病与氧化应激[J].国外医学:内分泌学分册,2005,25( 6) : 393-395.
[18]Weston CR,Davis RJ.The JNK signal transduction pathway[J].Curr Opin Cell Biol,2007,19( 2) : 142-149.
Oxidative stress-activated JNK-MAPK signaling pathway is involved in fluctuant high glucose-induced injury of hepatocytes
LI Su-juan1,JIN Ke-ke2,ZHAO Ya-ping1,WANG Peng1,ZHAO Wen-xi1,GAO Kaixuan1,YANG Wen-juan1,WANG Jia-lin1,WU De-ping1
(1Department of Endocrinology,The 82nd Hospital of PLA,Huaian 223001,China;2Department of Pathophysiology,Wenzhou Medical University,Wenzhou 325035,China.E-mail: 13952329182@139.com)
[ABSTRACT]AIM: To explore the mechanisms of fluctuant high blood glucose-induced apoptosis of hepatocytes.METHODS: SD rats were randomly divided into normal control group ( N),stable high blood glucose group ( S),fluctuant high blood glucose group ( F) and insulin group ( I).Diabetic rats were induced by intraperitoneal injection of streptozotocin ( 65 mg/kg),and the fluctuant high blood glucose animal model was induced by intraperitoneal injection of ordinary insulin and glucose at different time points every day.The blood glucose fluctuation patterns of the animals in F group within 12 weeks were similar every day and no significant difference of the HbA1c concentration was observed compared with S group,indicating that the fluctuant hyperglycemia was successfully established in F group.The activity of superoxide dismutase ( SOD) and glutathione peroxidase ( GSH-Px),and the content of malondialdehyde ( MDA) and nitric oxide ( NO) in the homogenate of the liver tissues were detected by colorimetry.The mRNA and protein levels of JNK,p-JNK,Bax and Bcl-2 were examined by RT-PCR and Western blot.RESULTS: After 12 weeks,the increases in the intakes of food and water,the urine output,and the abnormal liver function were observed in S group,I group and F group.Compared with N group,the MDA level was increased,the content of NO and the activity of SOD and GSH-Px were decreased,and up-regulation of JNK mRNA and p-JNK and Bax proteins,and down-regulation of Bcl-2 were also found in S group,I group and F group.The above effects were more obviously showed in F group.CONCLUSION: Oxidative stress activates JNK-MAPK signaling pathway,which is involved in fluctuant high glucose-induced apoptosis of hepatocytes.
[KEY WORDS]Hepatocytes; Blood glucose fluctuation; Oxidative stress; JNK-MAPK signaling pathway
通讯作者△Tel: 0517-83568807; E-mail: 13952329182@139.com
*[基金项目]浙江省自然科学基金资助项目( No.Y207495) ;南京军区科技创新课题项目( No.12MA026) ;淮安市内分泌代谢性疾病重点实验平台持续支持项目( No.HAP201273)
[收稿日期]2015-01-08[修回日期]2015-04-09
[文章编号]1000-4718( 2015)07-1259-07
[中图分类号]R587. 1; R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.019
