硫化氢保护被ATP损伤的PC12细胞*
2015-05-16宋景贵韩亚州李东亮新乡医学院生理学与神经生物学教研室附属中心医院第三附属医院第二附属医院河南新乡00沁阳市人民医院神经内科河南沁阳0
马 洁,沈 慧,王 璐,宋景贵,韩亚州,李东亮△(新乡医学院生理学与神经生物学教研室,附属中心医院,第三附属医院,第二附属医院,河南新乡00;沁阳市人民医院神经内科,河南沁阳0)
硫化氢保护被ATP损伤的PC12细胞*
马洁1,2,沈慧1,3,王璐1,宋景贵4,韩亚州5,李东亮1△
(新乡医学院1生理学与神经生物学教研室,2附属中心医院,3第三附属医院,4第二附属医院,河南新乡453003;5沁阳市人民医院神经内科,河南沁阳454550)
[摘要]目的:观察硫化氢的供体硫氢化钠( NaHS)对三磷酸腺苷( ATP)诱导的PC12细胞活力、胞内Ca(2 +)浓度([Ca(2 +)]i)及膜通透性的变化,探讨硫化氢神经保护作用的嘌呤信号机制。方法:将对数生长期高分化的PC12细胞,随机分为4组,分别为( 1)正常对照组:常规培养,不进行ATP处理; ( 2) ATP组:接种细胞24 h后ATP处理; ( 3) NaHS + ATP组: NaHS预先孵育30 min后再用ATP处理,并且NaHS始终存在于反应体系中; ( 4) KN-62 ( P2X7受体阻断剂) + ATP组: KN-62预先孵育30 min,其余同NaHS + ATP组。MTT检测各组细胞活力,Fura-2/ AM荧光染料检测各组[Ca(2 +)]i,检测荧光染料YO-PRO-1的相对荧光单位以反映膜的通透性。结果: ( 1) 0. 3 mmol/L ATP对细胞活力无影响,但1、3、5、10 mmol/L ATP则呈浓度依赖式明显降低细胞活力,200 μmol/L NaHS干预可明显逆转ATP引起的细胞活力下降( P<0. 05),而800 μmol/L NaHS预处理则加剧ATP对PC12细胞的损伤( P<0. 05)。( 2) ATP处理PC12细胞会引起[Ca(2 +)]i迅速升高并且呈浓度依赖性,NaHS预处理能对抗ATP引起的[Ca(2 +)]i升高( P<0. 05)。( 3)随着ATP浓度的增加及作用时间的延长,PC12细胞内YO-PRO-1的荧光强度显著增加,NaHS预处理可明显减少细胞对YO-PRO-1的摄取( P<0. 05)。结论:硫化氢可保护ATP损伤的PC12细胞,可能与其抑制[Ca(2 +)]i升高和YO-PRO-1荧光增强有关。
[关键词]三磷酸腺苷;硫化氢;嘌呤P2X7受体; PC12细胞
近年来三磷酸腺苷( adenosine triphosphate,ATP) -P2X嘌呤信号途径在脑缺血-再灌注损伤中的作用逐渐受到关注,而对P2X7受体亚型的研究则成为焦点。在正常生理状态下,ATP作用于P2X7受体并将其激活,引起Ca2 +和Na+内流,K+外流,细胞去极化。而在脑缺血-再灌注损伤时,损伤的神经元和胶质细胞释放大量的ATP[1],这些高浓度的ATP持续地刺激P2X7受体,不仅使神经元去极化的内向电流振幅随时间增强[2],而且可形成大的“膜孔”,900 Da以下的各种物质(如NMDG+、YO-PRO-1和ethidium)都可以自由通过[3],此后进一步引起活性氧、谷氨酸、ATP等炎性物质的释放及炎性体的生成,导致细胞水肿,空泡形成,甚至凋亡和坏死,造成脑、神经组织的继发性损伤[4]。胞外高浓度的ATP是“死亡因子”的理念已经被研究者普遍认可,近年来的研究报道也相继证实了ATP的损伤作用[5]。
关于硫化氢( hydrogen sulfide,H2S)抗缺血-再灌注损伤的机制目前有几种说法,如激活KATP通道说、抑制兴奋毒说、抗氧化说等。而本实验室前期的研究结果证实了ATP损伤PC12细胞与P2X7受体有关,本文则关注H2S对ATP损伤PC12细胞保护作用机制及其关键分子靶点,试图为H2S的临床应用提供一些实验证据。
材料和方法
1细胞系和主要试剂
PC12细胞购于中国科学院上海生科院细胞资源中心。
MTT、ATP、H2S供体硫氢化钠( sodium hydrosulfide,NaHS)、P2X7受体阻断剂KN-62和DMEM培养基均购自Sigma; Fura-2/AM购自Dojindo; YO-PRO-1 Iodide购自Invitrogen;胎牛血清购自HyClone。
2方法
2.1母液及工作液配制ATP用无菌三蒸水配成500 mmol/L的母液,NaHS用无菌三蒸水配成50 mmol/L的母液。KN-62用无菌DMSO配成1 mmol/ L的母液。上述各母液分装后避光于-20℃保存,在使用前配成适宜浓度的工作液。
2.2细胞培养及实验分组PC12细胞置于含10%胎牛血清的DMEM培养基中,在37℃、5% CO2培养箱中常规培养。实验取对数生长期细胞进行,分为正常对照组( DMEM培养基常规培养)、ATP组(接种细胞24 h后用ATP处理)、NaHS + ATP组( NaHS孵育30 min后再用ATP处理,并且NaHS始终存在于反应体系中)和KN-62 + ATP组( KN-62预先孵育30 min,其余同NaHS + ATP组)。
2.3MTT检测细胞活力对数生长期的细胞消化后,稀释为5×105/L密度的细胞悬液,每孔100 μL接种于96孔板中。按照上述方法分组,每组设5个复孔,药物按预定作用时间处理后,加入以PBS配制的浓度为5 g/L的MTT 10 μL,以上配液及加药过程均需避光操作。37℃培养箱中孵育4 h后取出培养板,吸去孔内培养基,每孔加入DMSO 100 μL,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪波长为490 nm处测量各孔的吸光度( A)。根据下列公式计算各组细胞活力:活力( %) = ( A处理组-A空白组) /( A对照组-A空白组)×100%,实验重复3次。
2.4细胞内钙离子浓度( intracellular Ca2 +concentration,[Ca2 +]i)的测定取对数期生长的细胞,以2 ×105/L的细胞密度接种于35 mm的培养皿中,24 h后各组细胞按分组的描述进行处理。5 μmol/L的Fura-2/AM孵育30 min后常规洗涤,HBSS孵育30 min,使用具有Ca2 +成像系统的荧光显微镜检测ATP引起的[Ca2 +]i变化,[Ca2 +]i以340 nm荧光强度与380 nm荧光强度( F340/F380)的比值来计算。
2.5YO-PRO-1摄入实验检测膜孔形成细胞膜孔形成时分子量为629 Da的YO-PRO-1可进入细胞与核酸结合发出绿光,因此可根据荧光强度反映膜孔开放的程度。YO-PRO-1与ATP同时加入各组,使YO-PRO-1溶液的终浓度为2 μmol/L。37℃孵育1 h,此后使用多功能酶标仪检测(激发波长485 nm,发射波长516 nm)。YO-PRO-1荧光强度= A实验组/ A对照组×100%。本实验将对照组细胞摄取的荧光强度定为100%。
3统计学处理
数据以均数±标准误( mean±SEM)表示,采用SPSS统计软件进行处理,多组间显著性检验用单因素方差分析( one-way ANOVA),以P<0. 05为差异有统计学意义。
结果
1 ATP诱导的PC12细胞活力的变化
以空白对照组细胞活力设为100%,0. 3、1、3、5 和10 mmol/L ATP作用3 h后,PC12细胞活力分别为98. 7%、87. 5%、83. 0%、80. 4%和72. 4%,除0. 3 mmol/L组与对照组无显著差异外,其余各组细胞活力均明显低于空白对照组( P<0. 05),且随着ATP浓度增大,PC12细胞活力逐渐下降,见图1。
2 NaHS对ATP诱导的PC12细胞活力的影响
不同浓度NaHS预孵育PC12细胞半小时后再用ATP( 3 mmol/L)处理。以空白对照组细胞活力为100%,ATP ( 3 mmol/L)组为83. 0%,50 μmol/L NaHS组为80. 0%,与ATP组相比无明显差异; 200 μmol/L NaHS组为88. 4%,明显高于ATP组( P<0. 05) ; 800 μmol/L NaHS组为74. 2%,与ATP组相比反而下降( P<0. 05)。由此表明浓度为200 μmol/ L的NaHS对ATP损伤的PC12细胞具有保护作用,但浓度为800 μmol/L的NaHS对细胞表现为损伤作用,见图1。
3 ATP处理对PC12细胞[Ca2 +]i的影响
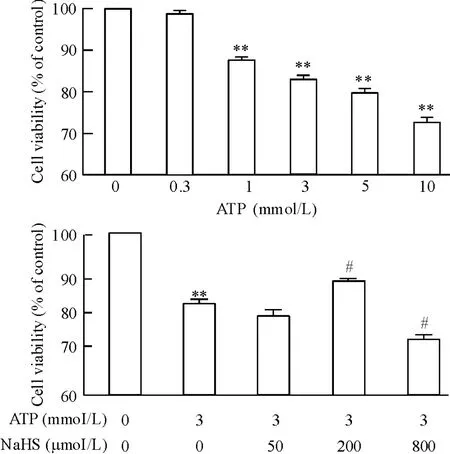
Figure 1.The effects of NaHS on the viability of PC12 cells injured by ATP.Mean±SEM.n = 3.**P<0. 01 vs control group;#P<0. 05 vs ATP group.图1 NaHS对ATP致伤PC12细胞活力的影响

Figure 2.The effects of different concentrations of ATP on[Ca2 +]iof PC12 cells.Mean±SEM.n = 20.**P<0. 01 vs control group.图2 不同浓度ATP对PC12细胞[Ca2 +]i的影响
如图2所示,加入1 mmol/L ATP后[Ca2 +]i轻微升高,与给药前相比无明显差异,但3 mmol/L ATP组[Ca2 +]i增加50%,显著高于给药前的基础值( P<0. 01),5 mmol/L ATP组给药后[Ca2 +]i增加66. 3%,也明显高于给药前( P<0. 01)。结果提示一定浓度的ATP激活相应的嘌呤受体后,可使[Ca2 +]i明显增加,Ca2 +或许是嘌呤信号分子在细胞内传递的关键分子。
4 KN-62与NaHS抑制ATP介导的[Ca2 +]i增高
分别给予P2X7受体阻断剂KN-62与NaHS处理PC12细胞均未引起[Ca2 +]i增加,表明单独使用KN-62或NaHS并不能改变PC12细胞[Ca2 +]i,即KN-62与NaHS均不能激活P2X7受体。
而P2X7受体阻断剂KN-62预孵育0. 5 h后再加入ATP( 3 mmol/L),KN-62 + ATP组[Ca2 +]i增幅为14. 5%,明显低于ATP( 3 mmol/L)组的50%增幅( P<0. 01),表明ATP介导的[Ca2 +]i增高与P2X7受体的激活有关。NaHS预孵育0. 5 h后再加入ATP ( 3 mmol/L),NaHS + ATP组[Ca2 +]i增幅为21. 3%,也明显低于ATP( 3 mmol/L)组的50% ( P<0. 01)。表明NaHS有类似于KN-62下调ATP介导的[Ca2 +]i升高的作用。
若将NaHS和ATP同时加入,[Ca2 +]i增幅为42. 6%,与单纯ATP( 3 mmol/L)处理组没有显著差异( P>0. 05)。而NaHS预孵育0. 5 h后再加入ATP ( 3 mmol/L),[Ca2 +]i为21. 3%,明显低于ATP( 3 mmol/L)组( P<0. 01)。表明NaHS存在于反应体系的时间及与ATP加入的先后顺序决定其作用的效果,0. 5 h的预处理能逆转ATP介导的[Ca2 +]i升高,见图3。
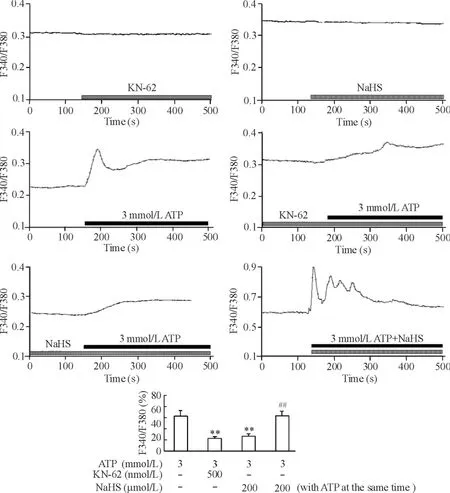
Figure 3.Inhibitory effects of KN-62 and NaHS on the increase in[Ca2 +]iinduced by ATP in PC12 cells.Mean±SEM.n = 20.**P<0. 01 vs ATP group;##P<0. 01 vs NaHS + ATP group.图3 KN-62与NaHS抑制ATP介导的PC12细胞[Ca2 +]i的升高
5 ATP对PC12细胞膜孔形成的影响
不同浓度的ATP作用于PC12细胞1 h后,细胞对YO-PRO-1的摄取量随ATP浓度的增加而增强,3 mmol/L ATP在分别作用15、30和60 min后,PC12细胞对YO-PRO-1的摄取随时间的延长也明显增强。表明ATP介导的PC12细胞膜孔形成既取决于ATP的浓度,又受到ATP作用时间长短的影响,见图4。

Figure 4.The effect of ATP on the uptake of YO-PRO-1 in PC12 cells.Mean±SEM.n =3.**P<0. 01 vs 0 mmol/L;##P<0. 01 vs 15 min.图4 ATP对PC12细胞YO-PRO-1摄入的影响
6 KN-62与NaHS抑制ATP介导的细胞膜孔形成
分别用KN-62和NaHS预孵育0. 5 h再加入ATP( 3 mmol/L),如图5所示,NaHS + ATP组与KN-62 + ATP组对YO-PRO-1的摄取都明显弱于单纯ATP( 3 mmol/L)组( P<0. 01),表明NaHS和KN-62 对ATP介导的细胞膜孔形成都有抑制作用。
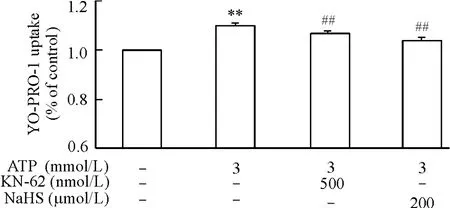
Figure 5.The effects of KN-62 and NaHS on YO-PRO-1 uptake induced by ATP in PC12 cells.Mean±SEM.n = 3.**P<0. 01 vs control group;##P<0. 01 vs ATP group.图5 KN-62和NaHS对胞外ATP诱导的PC12细胞摄入YO-PRO-1的影响
讨论
PC12细胞是一种大鼠肾上腺嗜铬细胞瘤细胞,在NGF诱导下其分化、生长、生理功能等方面均类似于神经元。用高浓度ATP处理PC12细胞,则类似于模拟体内各种病理条件如缺血、炎症、休克时损伤神经元、胶质细胞释放的大量ATP对病灶周围正常神经元产生的损伤。本文的实验表明0. 3 mmol/L ATP 对PC12细胞活力无影响,但随ATP浓度的增加,PC12细胞的活力逐渐下降,伤亡的细胞也明显增多,这些结果表明高浓度的ATP的确能造成神经元损伤并死亡。NaHS对ATP致伤PC12细胞的保护作用与其浓度有关,本实验的结果显示200 μmol/L浓度的保护作用较佳,更高浓度800 μmol/L的NaHS却对ATP诱导的PC12细胞起损伤作用。有文献指出过量的H2S是细胞色素氧化酶的强抑制剂,能与线粒体内膜呼吸链中的氧化型细胞色素氧化酶中的Fe3 +结合,抑制电子传递和氧的利用,引起细胞内缺氧,造成细胞内窒息[6]。孟金兰等[7]也证实了在PC12细胞中,50~200 μmol/L NaHS可呈浓度依赖性促进存活素表达,而800 μmol/L NaHS处理后存活素的表达明显低于对照组,与本实验的结果相符合,都表明800 μmol/L NaHS对PC12细胞本身可能有损伤作用。
在真核细胞中,Ca2 +是一个非常重要的第二信使,参与调节细胞的各种生理生化反应过程[8]。在生理情况下,维持细胞内钙稳态对健康细胞的生命活动是非常必要的,胞内Ca2 +的失调必将引起细胞损伤死亡。行妍妍等[9]提出了“钙调整点”的假说,认为细胞内Ca2 +浓度过高或过低都会抑制细胞神经突起的生长,影响突触传递、可塑性及神经元的发育。然而,神经系统功能发生紊乱(如脑缺血、低氧症、低血糖症、癫痫等)时,神经元将受到异常刺激,细胞内外的Ca2 +浓度发生波动[10]。脑卒中发生时,机体内的糖酵解增加,使乳酸和酮体聚积,pH值降低,引起细胞内钙超载,胞浆内游离Ca2 +增多,线粒体膜电位降低,从而诱发神经细胞凋亡或坏死[11]。30年前Chahwala等[12]报道了细胞外的ATP能够引起Ca2 +、Na+内流并使MEL细胞的活力下降。由此可见[Ca2 +]i增加会对细胞造成致命的损伤,维持[Ca2 +]i相对稳定对细胞的正常生存具有深远的意义。
有研究表明体外活化P2X7受体需要细胞外ATP浓度≥1 mmol/L,而活化其它的P2受体需要ATP浓度<100 μmol/L[13],在我们实验中1 mmol/L ATP对PC12细胞[Ca2 +]i影响甚小,3、5 mmol/L ATP使[Ca2 +]i显著升高,看来ATP诱导PC12细胞[Ca2 +]i升高可能主要是通过激活细胞上的P2X7受体实现的。为证实这一观点,我们进一步使用P2X7受体特异性的阻断剂KN-62预处理,结果发现能对抗ATP引起的[Ca2 +]i升高,从而也印证了上述观点。NaHS与ATP同时加入培养体系,ATP引起的PC12细胞[Ca2 +]i升高的现象没有被抑制,而NaHS预孵育0. 5 h后再加入ATP,[Ca2 +]i升高却明显被逆转,表明NaHS预孵育可以抑制P2X7受体的激活,为NaHS临床使用的适宜时间提供了实验依据。
通常P2X7受体作为阳离子通道发挥作用,但是经过反复或持续地暴露于高浓度的ATP时,可形成允许900 Da以下分子通透的“膜孔”[1],膜孔的不断增多导致细胞水肿,空泡形成、最终凋亡坏死。我们以分子量为629 Da的荧光物质YO-PRO-1摄入水平作为膜孔形成的指标,分别以不同浓度的ATP作用于PC12细胞,结果显示随ATP浓度的增高,细胞YO-PRO-1摄入水平也明显增加。随后我们用3 mmol/L ATP分别处理PC12细胞15 min、30 min、60 min,结果显示随ATP作用时间的延长,YO-PRO-1进入细胞也逐渐增多。以ATP作用15 min时PC12细胞内的荧光强度为100. 0%,30 min时荧光强度增至112. 2%,1 h时荧光强度达138. 0%。总之,同一作用时间,提高ATP浓度会加速PC12细胞膜孔的形成;而同一ATP浓度作用,则随作用时间延长,也会促进膜孔的形成[14]。Auger等[15]在胸腺细胞中也证实了ATP持续地作用会促使膜孔形成,然后大分子的YO-PRO-1即进入细胞,而P2X7受体特异性的阻滞剂o-ATP能明显拮抗这一现象。在我们的实验中使用了另一种P2X7受体特异性阻滞剂KN-62,结果发现也能减少ATP引起的细胞对YO-PRO-1的摄取,为P2X7受体在ATP诱导的膜孔形成中的重要作用进一步提供了实验依据。
细胞膜的通透性随着ATP浓度改变发生了质的变化,结果细胞膜上形成了大“膜孔”,大量小于900 Da的有机物质自由进出,细胞内稳态失衡而死亡。H2S抗损伤保护细胞的作用已经在多个组织器官得到了证实[16],H2S是否可通过调控膜孔的激活来实现抗损伤而保护细胞呢?本实验用NaHS ( 200 μmol/L)预孵育30 min可显著减少ATP诱导的YOPRO-1的摄取,减少PC12细胞对大分子的通透,减轻对PC12细胞的损伤,为NaHS调控膜孔激活观点取得了初步证据。
[参考文献]
[1]Skaper SD,Debetto P,Giusti P.The P2X7purinergic receptor: from physiology to neurological disorders[J].FASEB J,2010,24( 2) : 337-345.
[2]Chessell IP,Michel AD,Humphrey PP.Properties of the pore-forming P2X7purinoceptor in mouse NTW8 microglial cells[J].Br J Pharmacol,1997,121( 7) : 1429-1437.
[3]Rassendren F,Buell GN,Virginio C,et al.The permeabilizing ATP receptor,P2X7cloning and expression of a human cDNA[J].J Biol Chem,1997,272( 9) :5482-5486.
[4]王国红,郭直岳,尹雅玲,等.三磷酸腺苷对N9小胶质细胞的损伤作用及其机制[J].中国病理生理杂志,2012,28( 9) : 1597-1604.
[5]Zarjou A,Agarwal A.ATP as a death factor: purinergic signaling in renal epithelial-fibroblast cross talk[J].Physiol Renal Physiol,2011,300( 1) : F60-F61.
[6]郭宝清,马国煜,尚慧,等.急性硫化氢中毒26例临床病例分析[J].甘肃医药,2013,32( 9) : 688-690.
[7]孟金兰,莫利求,王建红,等.硫化氢对PC12细胞存活素表达的影响及其神经保护作用[J].中华神经医学杂志,2010,9( 6) : 586-589.
[8]Rocha AG,Mehlmer N,Stael S,et al.Phosphorylation of Arabidopsis transketolase at Ser428provides a potential paradigm for metabolic control of chloroplast carbon metabolism [J].Biochem J,2014,458( 2) : 313-322.
[9]行妍妍,汪军兵,谢赛,等.姜黄素对放线菌素D/ TNF-α诱导的PC12细胞和大鼠海马神经元损伤的影响[J].中国病理生理杂志,2012,28( 10) : 1746-1750.
[10]Celes MR,Malvestio LM,Suadicani SO,et al.Disruption of calcium homeostasis in cardiomyocytes underlies cardiac structural and functional changes in severe sepsis[J].PLoS One,2013,8( 7) : e68809.
[11]Massimini M,Amzica F.Extracellular calcium fluctuations and intracellular potentials in the cortex during the slow sleep oscillation[J].J Neurophysiol,2001,85( 3) : 1346-1350.
[12]Chahwala SB,Cantley LC.Extracellular ATP induces ion fluxes and inhibits growth of Friend erythroleukemia cells [J].J Biol Chem,1984,259( 22) : 13717-13722.
[13]曹淑花,袁绍鹏,侯琦.P2X7与呼吸系统炎症性疾病的研究进展[J].药学学报,2013,48( 8) : 1183-1188.
[14]沈慧,尹雅玲,李超堃,等.外源性ATP诱导PC12细胞的膜孔形成[J].中国病理生理杂志,2014,30( 9) : 1603-1609.
[15]Auger R,Motta I,Benihoud K,et al.A role for mitogenactivated protein kinase ( Erk1/2) activation and non-selective pore formation in P2X receptor-mediated thymocyte death[J].J Biol Chem,2005,280( 30) : 28142-28151.
[16]Hu LF,Lu M,Tiong CX,et al.Neuroprotective effects of hydrogen sulfide on Parkinson’s disease rat models[J].Aging Cell,2010,9( 2) : 135-146.
Protective effect of hydrogen sulfide on PC12 cells injured by ATP
MA Jie1,2,SHEN Hui1,3,WANG Lu1,SONG Jing-gui4,HAN Ya-zhou5,LI Dong-liang1
(1Department of Physiology and Neurobiology,2Affiliated Central Hospital,3The Third Affiliated Hospital,4The Second Affiliated Hospital,Xinxiang Medical University,Xinxiang 453003,China;5Department of Neurology,Qinyang People’s Hospital,Qinyang 454550,China.E-mail: xyldl8@126.com)
[ABSTRACT]AIM: To prove the purinergic signaling mechanism of the neuroprotective action of hydrogen sulfide by observing the effects of sodium hydrosulfide ( NaHS),a donor of hydrogen sulfide,on the cell viability,intracellular Ca(2 +)concentration([Ca(2 +)]i) and the change of membrane permeability in the PC12 cells injured by adenosine triphosphate ( ATP).METHODS: PC12 cells in logarithmic growth phase were randomly divided into 4 groups.In control group,the cells were cultured without ATP treatment.In ATP group,the cells were treated with ATP after cultured for 24 h.In NaHS + ATP group,the cells were incubated with NaHS for 30 min before treated with ATP,and NaHS always existed in the reaction system.In KN-62 + ATP group,the cells were pretreated with KN-62 for 30 min,and the other treatments were as the same as those in NaHS + ATP group.The cell viability was assessed by MTT assay.The[Ca(2 +)]iwas detected by Fura-2/AM staining.The membrane permeability was observed by staining with fluorescent dye YO-PRO-1.RESULTS: ATP at concentration of 0.3 mmol/L showed no injury effect on the cells.However,the cell viability was dropped gradually in a dose-dependent manner as the ATP at doses of 1,3,5 and 10 mmol/L.The decline of cell viability by ATP was obviously reversed by 200 μmol/L of NaHS in the PC12 cells ( P<0. 05),but exasperated by 800 μmol/L of NaHS ( P<0. 05).At the same time,ATP evoked the increase in[Ca(2 +)]iin a dose-dependent manner,which was inhibited by NaHS ( P<0. 05).Furthermore,the YO-PRO-1 uptake induced by ATP in a dose-dependent and time-dependent manner was also reduced by NaHS ( P<0. 05).CONCLUSION: Hydrogen sulfide has protective effect on the PC12 cells injured by ATP.The mechanism may be related to the reverse of the increased[Ca(2 +)]iand YO-PRO-1 uptake.
[KEY WORDS]Adenosine triphosphate; Hydrogen sulfide; Purinergic P2X7receptor; PC12 cells
通讯作者△Tel: 0373-3029104; E-mail: xyldl8@126.com
*[基金项目]国家自然科学基金资助项目( No.81371346; No.81271376) ;新乡医学院2013年度研究生科研创新支持计划资助项目( No.YJSCX201318Y)
[收稿日期]2014-10-22[修回日期]2015-03-02
[文章编号]1000-4718( 2015)07-1231-06
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.014
