云南省陆良县蚕区病蚕BmDNV VD1 ORF2 PCR检测及序列分析
2015-05-16张永红唐芬芬邵榆岚白兴荣
张永红 唐芬芬 邵榆岚 朱 峰 白兴荣
(云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101)
云南省陆良县蚕区病蚕BmDNV VD1 ORF2 PCR检测及序列分析
张永红 唐芬芬 邵榆岚 朱 峰 白兴荣
(云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101)
根据家蚕浓核病的典型病症,推测云南省陆良县蚕区病蚕感染该病毒;为进一步确认家蚕感染浓核病病毒,参照家蚕浓核病病毒-镇江株(Bombyx mori densonucleosis virus-3,BmDNV-3)基因组VD1链非结构蛋白基因1 ORF2序列设计特异性引物,以病蚕基因组为模板进行PCR扩增来检测该蚕区的病蚕是否感染BmDNV,PCR检测结果得知,在陆良县收集的14户蚕农病蚕样品中有7组样品感染了BmDNV;为进一步了解该地区病毒与已报道病毒株系间的进化关系,纯化该病毒并提取基因组,回收VD1 ORF2上下游引物扩增得到的PCR产物并克隆该基因片段(GenBank登录号:KR909094);收集NCBI已登录非结构蛋白1基因序列构建系统发生树,从进化树可以得知,BmDNV-3与家蚕浓核病病毒-陆良株(Bombyx mori densonucleosis virus-Luliang,BmDNV-Luliang)聚为1支,说明分离得到的BmDNV为BmDNV-3的1个分离株系,为下一步研究病毒与宿主间基因组进化提供理论依据。
陆良县;家蚕浓核病;PCR;VD1 ORF2;系统发生树;镇江株;陆良株
家蚕浓核病病毒(Bombyx mori densonucleosis virus,BmDNV;Bombyx mori bidensovirus,BmBDV)属于细小病毒科(Parvoviridae)的浓核病毒属(Densovirinae),无囊膜,病毒粒子呈正面体,它主要感染家蚕的中肠柱状上皮细胞[1]。该病毒基因组大小约为4.0~6.5 kb,且为正负链单分子ssDNA,正链和负链包被在不同的衣壳蛋白中,正负链在适当盐浓度条件下抽提可形成双链dsDNA[2]。BmDNV-3病毒基因组含有2种不同的单链线形DNA分子(VD1为6 543 bp,VD2为6 022 bp),两者之间没有同源性,基因组VD1链主要包括4个开放阅读框ORFs(ORF1、ORF2、ORF3、ORF4),VD2包括2个ORFs,VD1和VD2的末端重复序列分别为224 bp和524 bp[3]。VD1与VD2位于2个不同的衣壳蛋白中,VD1与VD2是如何相互作用的还有待于进一步的验证。
家蚕作为重要的经济昆虫,日本株系BmDNV-1[4]、日本山梨株BmDNV-2[5]、镇江株BmDNV-3[3]、印度株BmDNV-4[6]、日本信大株BmDNV-5[7]与重庆株BmDNV-6[8]家蚕浓核病病毒的不同株系在家蚕体内得到分离,上述株系的全基因组序列均被测定,家蚕对不同株系的DNVs的感受性、血清学上存在差异[9],在宿主感染部位上也存在不同[10]。BmDNV给中国蚕桑产业造成较大的损失,随着检测病毒技术的不断进步,PCR等分子生物学技术被广泛运用;本文以采集于云南省陆良县疑似BmDNV病蚕为样品,根据已报道的BmDNV-3 VD1基因组ORF2序列设计特异引物,通过PCR手段来鉴定是否感染BmDNV,在此基础上,克隆该基因片段、测序,应用生物信息学软件进行分析,构建了DNV进化树,分析了其与已报道株系的亲缘关系。
1 材料与方法
1.1 试验材料及主要试剂
1.1.1 家蚕品种、病毒与细菌 菁松×皓月家蚕品种,由云南省农业科学院蚕桑蜜蜂研究所家蚕资源室提供;BmDNV的病蚕样品,从云南省陆良县14户蚕农家采集,分别编号(1~14号)备用;大肠杆菌DH5α,由云南省农业科学院蚕桑蜜蜂研究所实验室保存。
1.1.2 引物 根据GenBank已登陆BmDNV-3株基因组片段VD1 ORF2序列,设计特异性引物(表1),引物由上海生工生物工程公司合成。

表1 BmDNV-3 VD1 ORF2扩增引物序列
1.1.3 试剂 PCR反应体系(10×PCR buffer、dNTPs和Ex-Taq聚合酶)、pMD19-T载体试剂盒,购自大连TaKaRa公司;PCR产物回收试剂盒,购自上海生工生物工程公司。
1.2 试验方法
1.2.1 病毒粒子收集与基因组提取 准备云南省陆良县14户蚕农的病蚕样品,取出病蚕中肠组织分别用灭菌水研磨后,用纱布过滤匀浆液,于4 000 r/min离心20 min,过滤数次,收集的混合液加到1 mL基因组抽提液(10 mmol/L Tris-Cl,pH8.0;0.1 mol/L EDTA,pH 8.0;0.5%SDS)中,并加入蛋白酶K,55℃水浴2 h;利用Tris平衡酚,酚∶氯仿(1∶1),酚∶氯仿∶异戊醇(25∶24∶l),氯仿各抽提1次;无水乙醇沉淀基因组,70%乙醇洗涤DNA,最后用适量的TE溶液溶解沉淀,溶液用于PCR检测。
1.2.2 病毒纯化与基因组提取 根据1.2.1中病蚕样品的PCR检测结果,选取感染BmDNV的1个样品(2号)纯化病毒粒子,接种于菁松×皓月的4龄起蚕,发病后收集病蚕。用1.2.1的方法收集病毒粒子,病毒混合液用氯仿反复抽提,至无明显的白色变性蛋白和脂类,然后用饱和度40%硫酸铵沉淀混合液,用PBS(0.1 M,pH7.2)溶解沉淀;40%(w/w)氯化铯溶液梯度纯化该病毒,45 000 r/min离心30 min,分部收集,取260 nm吸光度部分,4℃保存备用;再次提取病毒基因组用于PCR检测和扩增目的基因片段。
1.2.3 病毒基因组目的片段克隆 纯化后的病毒基因组作为模板进行PCR扩增,反应体系:10×PCR Buffer(Mg2+)5 μL,2.5 mmol/L dNTPs 4 μL,上下游引物各1 μL,cDNA模板1 μL,Ex-Taq DNA聚合酶0.25 μL,加ddH2O至50 μL;条件如下:94℃预变性3 min,94℃变性30 s,55℃30 s,72℃1 min,35个循环,终止延伸72℃10 min。PCR产物经回收试剂盒纯化,连接到pMD19-T载体并转化大肠杆菌DH5α,M13F/M13R扩增来验证阳性克隆,将阳性菌液送上海生物工程有限公司测序。
1.2.4 目的基因片段生物信息学分析 测序结果用BioXM 2.6软件(http://home.njau.edu.cn/~bioxm)进行拼接和分析;应用Prosite数据库(http://www.expasy.ch/cgi-bin/prosite/PSScan.cgi)分析该蛋白的结构功能域;已登陆BmDNV VD1 ORF2序列(表2),基于ORF2序列利用MEGA 4构建系统进化树来分析亲缘关系。

表2 浓核病病毒VD1 ORF⁃2序列来源
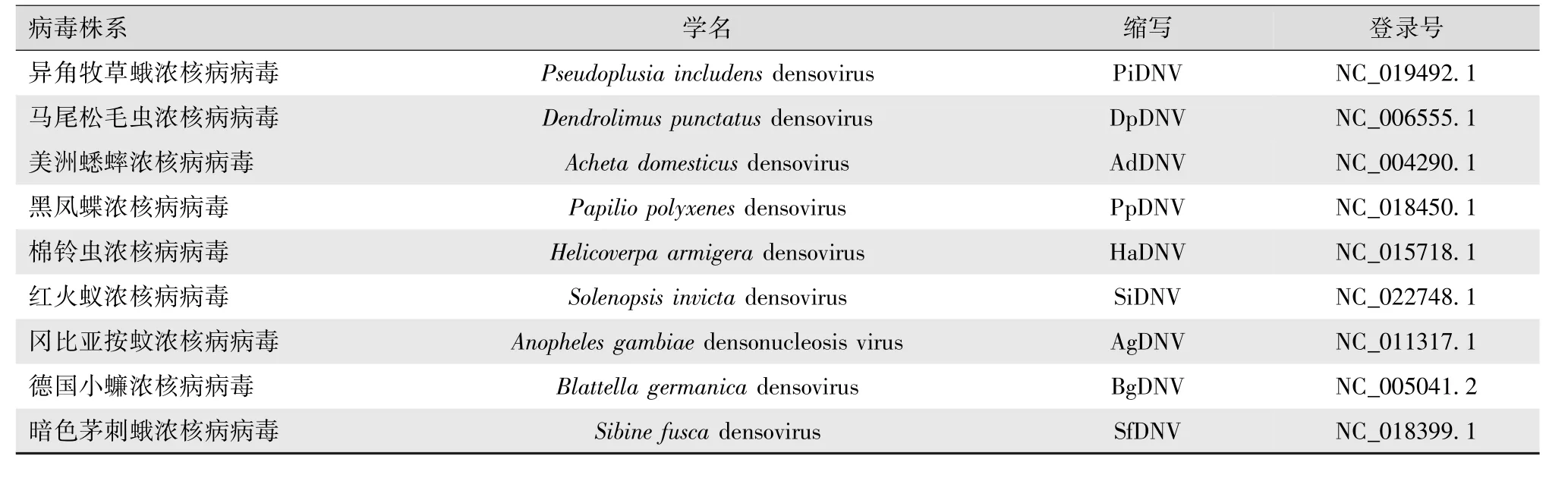
续表2
2 结果与分析
2.1 采集病蚕样本的PCR检测
从陆良县14户蚕农采集的病蚕样品抽提基因组后,VD1 ORF2上下游引物进行PCR扩增,结果如图1所示,PCR产物用1%的琼脂糖凝胶检测发现有约975 bp大小的条带,初步确定该地区有7个样品的家蚕感染了BmDNV。

图1 陆良县14个样品的病蚕基因组BmDNV-3 VD1 ORF2 PCR扩增结果
2.2 纯化后病蚕样本的PCR检测
选取陆良县2号病蚕的样本,添食正常家蚕的4龄起蚕,发病后收集病蚕,提取病毒粒子和病毒基因组再次进行PCR扩增确认,从电泳结果得知获得约975 bp大小的条带(图2),克隆该基因片段并测序。
2.3 BmDNV VD1 ORF2基因生物信息学分析
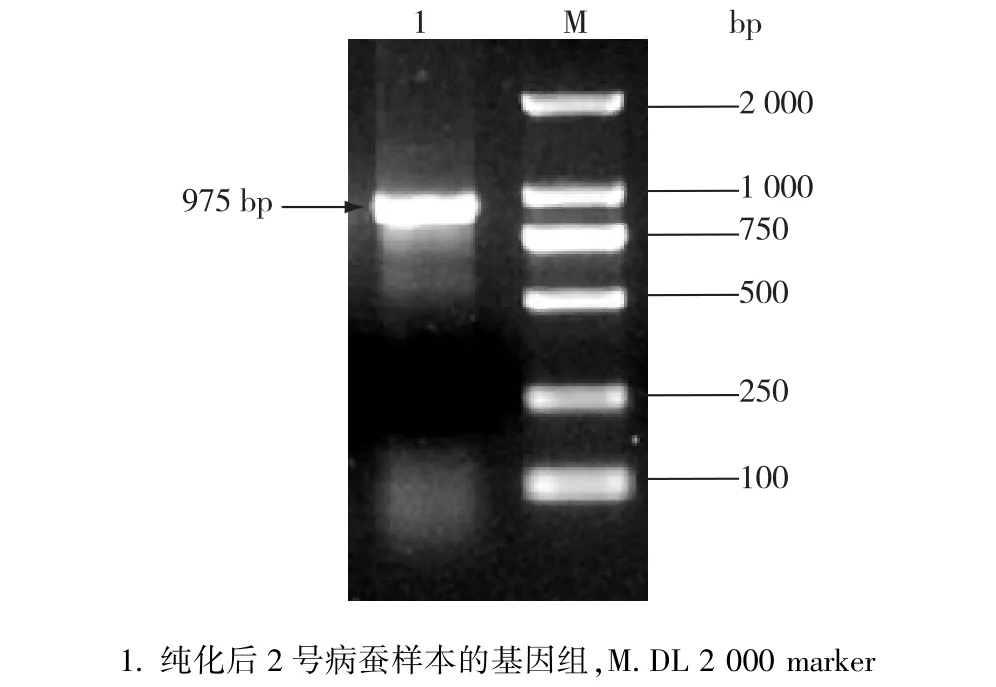
图2 陆良县2号病蚕样本纯化后的基因组BmDNV-3 VD1 ORF2 PCR扩增结果
2.3.1 BmDNV VD1 ORF2编码NS1蛋白生物信息学分析 BmDNV NS1(Non-structural protein 1,非结构蛋白1)为多功能蛋白,在病毒复制过程中具有重要功能[11]。NS1蛋白中也存在细小病毒保守的解旋酶(helicase)/ATP酶基序,涉及病毒DNA复制、序列特异性DNA结合、解旋酶、ATP依赖的专一性核酸内切酶以及ATP酶活性[12-14]。家蚕浓核病病毒-镇江株(Bombyx mori densonucleosis virus-3,BmDNV-3)VD1 ORF2核苷酸序列全长951 bp,编码含316个氨基酸的非结构蛋白NS1;家蚕浓核病病毒-陆良株(Bombyx mori densonucleosis virus-Lu⁃liang,BmDNV-Luliang)VD1 ORF2核苷酸序列全长951 bp,编码也含316个氨基酸。核苷酸序列比对分析发现在C585、C657这2个位置发生了点突变,均为T被替换为C,其中C585为非同义替换,C657为同义替换(图3);BmDNV-Luliang NS1氨基酸序列中196处由C替换为R(图4),即半胱氨酸变为精氨酸,Prosite数据库分析结果显示(图5)NS1解旋酶为超家族3解旋酶(Superfamily 3 helicase),其催化中心在118-305 aa之间,存在ATP结合位点的A型GXXXXGKT/S(X表示任何氨基酸)保守结构基序,且具有解旋酶活性,NS1蛋白质的解旋酶功能未发生变化。

图3 BmDNV-3与BmDNV-Luliang VD1 ORF-2核苷酸序列比对

图4 BmDNV-3与BmDNV-Luliang NS1氨基酸序列比对

图5 BmDNV⁃Luliang NS1蛋白质功能预测
2.3.2 NS1同源性和系统进化分析 根据已登录的病毒NS1基因序列,利用MEGA 4软件Neighbor Jointing(NJ)法进行系统进化分析(图6),结果显示,BmDNV-3与BmDNV-Luliang聚为1支,两者同其它宿主浓核病亲缘关系都较远,最近的为中国对虾肝胰腺浓核病病毒(Fenneropenaeus chinensis hepa⁃ topancreatic densovirus,FchDNV),分析FchDNV同BmDNV-3、BmDNV-Luliang病毒株系ORF2及NS1同源性,其中FchDNV同BmDNV-3和BmDNV-Lu⁃liang株系,与ORF2核苷酸序列同源性分别为44.2%、44.3%,与NS1氨基酸序列同源性均为18.1%(表3)。

图6 NS1系统进化分析
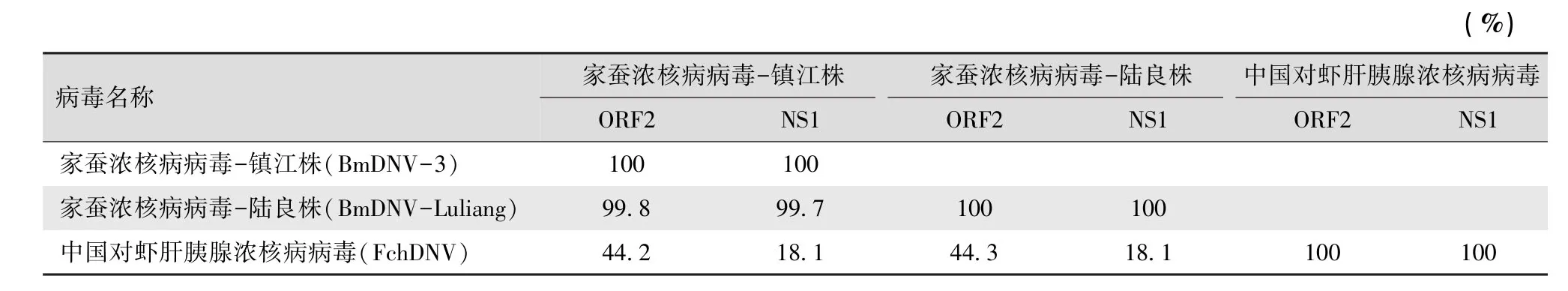
表3 FchDNV同BmDNV-3、BmDNV-Luliang病毒株系ORF2及NS1同源性比较
3 讨论
PCR检测的14个病蚕样品中有7组样品感染了BmDNV,7个样本是从同一种寄生家蚕品系中获得,而且各农户的地理位置相近,可推测该地区流行的BmDNV株系为同1个株系,所以选取2号样品作为研究的对象,纯化该病毒对正常家蚕进行添食,该病毒同样表现为高致病性,为了分析该病毒株系基因组类型,利用BmDNV-3 VD1 ORF2基因引物扩增得到特异条带,并且该基因的进化树也说明了该病毒为BmDNV-3的1个分离株系。
本研究只对VD1 ORF2序列进行了克隆分析,ORF2与BmDNV-3 ORF2核苷酸序列同源性高达99.8%,其中C585、C6572个位置发生了点突变,均是T被替换为C,其中C585为非同义替换,C657为同义替换,对应的氨基酸序列196处的半胱氨酸变为精氨酸,Prosite数据库预测该蛋白仍然具有解旋酶的功能基序,氨基酸的变化是否直接影响到病毒的毒力,这有待于进一步验证。NS1系统进化分析发现BmDNV-Luliang为BmDNV-3的1个分离株系,该病毒的基因组类型相同,进化树上的其它宿主病毒NS1蛋白都具有解旋酶基序,但同源性都较低,BmDNV-Luliang与FchDNV ORF2核苷酸序列的同源性较高为44.3%,与NS1氨基酸序列的同源性为18.1%(表3),其中2种家蚕的BmDNV与FchDNV亲缘关系较近。
该地区的分离株系VD1和VD2基因组片段还未克隆,其它结构蛋白基因和非结构蛋白基因同BmDNV-3的同源性如何还有待于进一步的研究。
[1]Iwashita Y,Chun C Y.The development of a densonucleosis virus isolated from silkworm larvae,Bombyx mori of China[J].The Ultra⁃structure and Functioning of Insect Cells Soc Insect Cell Japan, 1982:161-164.
[2]Bando H,Hayakawa T,Asano S,etal.Analysis of the genetic infor⁃mation of a DNA segment of a new virus from silkworm[J]. Archives of Virology,1995,140(6):1 147-1 155.
[3]Wang Yongjie,Yao Qin,Chen Keping,etal.Characterization of the genome structure of Bombyx mori densovirus(China isolate)[J]. Virus Genes,2007,35(1):103-108.
[4]Li Yi,Zadori Z,Bando H,etal.Genome organization of the densovirus from Bombyx mori(BmDNV-1)and enzyme activity of its capsid[J]. Journal of General Virology,2001,82(11):2 821-2 825.
[5]Hayakawa T,Kojima K,Nonaka K,etal.Analysis of proteins encoded in the bipartite genome of a new type of parvo-like virus isolated from silkworm⁃structural protein with DNA polymerase motif[J].Virus Research,2000,66(1):101-108.
[6]Tijssen P,Bergoin M.Densonucleosis viruses constitute an increas⁃ingly diversified subfamily among the parvoviruses[J].Seminars in Virology Academic Press,1995,6(5):347-355.
[7]张袁松.BmDNV-5(信大株)的感染增殖及其基因组研究[D].重庆:西南农业大学,2001.
[8]潘敏慧.家蚕浓核病毒BmDNV-6的研究[D].重庆:西南农业大学,2005.
[9]川濑茂实.家蚕质型多角体病毒[J].日本蚕丝学杂志,1990,59(1):1-13.
[10]吕鸿声.昆虫病毒分子生物学[M].北京:中国农业科技出版社,1998.
[11]Li Guohui,Sun Chen,Zhang Junhong,etal.Characterization of Bombyx mori parvo⁃like virus non⁃structural protein NS1[J].Virus Genes,2009,39:396-402.
[12]Jindal H K,Yong C B,Wilson G M,etal.Mutations in the NTP-binding motif of minute virus of mice(MVM)NS1 protein uncouple ATPase and DNA helicase functions[J].Journal of Bio⁃logical Chemistry,1994,269:3 283-3 289.
[13]Walker S L,Wonderling R S,Owens R A.Mutational analysis of the adeno-associated virus Rep68 protein:Identification of critical residues necessary for site-specific endonuclease activity[J]. Journal of Virology,1997,71:2 722-2 730.
[14]Yang Bo,Zhang Jiamin,Cai Dawei,etal.Biochemical characterization of Periplaneta fuliginosa densovirus non-structural protein NS1[J]. Biochemical Biophysical Research Communications,2006,342(4):1 188-1 196.
S881.2
A
1007-0982(2015)04-0038-06
2015-06-02;接受日期:2015-07-31
云南省现代农业蚕桑产业技术体系(编号2013KJTX006);
现代农业产业技术体系建设专项(编号CARS-22)。
张永红(1985—),男,云南师宗,硕士,研究实习员。
E⁃mail:zhang200503@126.com
白兴荣,男,副研究员。
Tel:0873-3860077,E⁃mail:bxrong3@163.com
