HL-CMS基因orfH79在稻种资源中的遗传多态性研究
2015-05-15段世华颜红宇廖信军
段世华 ,郑 卓,颜红宇,贺 俐,廖信军
(1.井冈山大学 生命科学学院,江西 吉安 343009;2.井冈山大学 生态环境与资源研究所,江西 吉安 343009;3.井冈山大学 医务所,江西 吉安 343009)
细胞质雄性不育(cytoplasmic male sterility,CMS)是一种由于雄性生殖系统退化不能产生花粉或产生的花粉缺乏正常功能的母性遗传性状,广泛存在于高等植物中。水稻的细胞质雄性不育及其育性恢复系统是杂交水稻生产与利用的基础。自上个世纪70年代我国科学家在野生稻中发现细胞质雄性不育并成功实现杂交水稻的三系配套以来,三系法杂交水稻生产技术的应用为解决我国乃至世界粮食危机做出了巨大的贡献[1-2]。目前科学家在水稻中已经发现多种类型的CMS,其中野败型(WA-CMS)、红莲型(HL-CMS)和包台型(BT-CMS)是公认的3种主要水稻CMS类型[3],被广泛应用于杂交水稻组合的培育,并在生产上得到大面积的应用[4-7]。研究表明,与大多数高等植物的CMS相类似,水稻CMS现象的产生也与其线粒体基因组异常嵌合基因的形成有关[8-13]。近年来国内外多个科研小组对水稻CMS及其育性恢复的机理进行了广泛而深入的研究,但到目前为此,只有BT-CMS和HL-CMS的分子机理研究得较为清楚。早在1994年,Akagi等[11]研究发现BT-CMS系线粒体atp6基因下游的一段特殊序列与BT-CMS有关,并将存在该区域的一个能编码79个氨基酸的可读框命名为orf79。之后国内外多个研究小组对BT-CMS/Rf系统的分子机理进行了深入系统的研究,并证实orf79为BT-CMS基因[14-16]。2002年Yi等[13]发现水稻HL-CMS系线粒体atp6基因下游也存在一个与BT-CMS基因orf79具有97%同源性的特殊可读框,定名为orfH79。2010年Peng等[17]通过转基因研究证实orfH79为HL-CMS基因。在此基础上,Hu等[18]和Wang等[19]分别从不同的角度对HL-CMS/Rf系统的分子作用机制及orfH79的功能进行了深入的探讨,并对HL-CMS/Rf系统的分子机理做了系统的阐述。毋庸置疑,HL-CMS基因orfH79和BT-CMS基因orf79的研究证实及其功能的阐述,对进一步加强水稻CMS胞质资源的发掘与利用具有非常重要的理论与实践意义。
在三系杂交水稻育种实践中,优良的水稻CMS系是培育优质高产组合的必要条件,因此,发掘培育不同来源和类型的优良水稻CMS系,对丰富水稻CMS胞质的类型,避免因单一胞质而带来的生产风险意义重大[20-21]。农作物近缘种是作物遗传改良与利用的重要种质资源,生产上和容易通过有性杂交的手段转移这些种质资源中的有利基因[22]。过去几十年,育种家利用各种手段培育了一系列的水稻CMS系,为杂交水稻的可持续发展做出了重大的贡献。目前,生产上广泛应用的水稻CMS胞质大多数是来源于与水稻近缘的野生稻品种或性状原始的农家种[23],因此,推测水稻种质资源中应该蕴含有丰富的CMS胞质资源。HL-CMS胞质来源于红芒野生稻[23],但其是否在其它水稻种质资源中具有分布?如果具有分布它们是保守性遗传还是产生了遗传分化?非常值得去研究与探讨。为此本研究以水稻HLCMS基因orfH79为特异性分子标记,对来自不同稻作国家的124份水稻材料进行筛选,在探明HL-CMS基因orfH79在水稻种质资源中分布的基础上,通过对相关水稻材料中HL-CMS基因orfH79及其同源序列的克隆和序列分析,阐明其在稻种资源中的遗传特点及变异模式,为新水稻CMS胞质的发掘和利用提供理论和实验依据。
1 材料与方法
1.1 材料
来自不同稻作国家的 124份水稻材料(包括 O.nivara(21)、O.rufipogon(25)、O.glumaepatula(5)、O.longistaminata(4)、O.meridionalis(4)、O.barthii(4)、O.glaberrima(8)和 O.sativa(53))用于 HL-CMS 基因orfH79为特异分子标记的筛选,共筛选出18份具有HL-CMS基因 orfH79或其同源序列的水稻材料用于本研究。供试材料中具有IRGC种质库品系号(IRGC Acc.No.)的水稻材料种子来自菲律宾国际水稻所种质资源中心,其它水稻材料的种子由本实验室提供。所有水稻材料均种植于井冈山大学生命科学学院生物园试验田或温室中。
1.2 水稻材料总DNA的提取
研究已经证实水稻HL-CMS基因orfH79为其线粒体atp6基因下游特有嵌合片段,在细胞核中不存在其拷贝[13]。为了进一步确证水稻核基因组中不存在其完整拷贝,利用BLAST工具在NCBI数据库中分别对籼稻(9311)和粳稻(Nipponbare)核基因组进行序列搜索,结果均没有搜索到HL-CMS基因orfH79完整序列拷贝。为此,本研究提取各水稻材料总DNA为orfH79片段的特异性扩增模板,DNA提取方法采用Doyle[24]修改的CTAB法,具体操作详见文献[24]。
1.3 PCR 扩增
根据水稻 HL-CMS基因 orfH79编码区保守序列设计特异性 PCR扩增引物对:PF:5′-TGACAAATCTGCTCCGATG-3′;PR:5′-CTTACTTAGGAAAGACTAC-3′。以筛选出的18份水稻材料的总 DNA为模板对orfH79片段进行特异性PCR扩增。PCR反应体积为25 μL,其中Taq DNA聚合酶1.0 U(TAKARA),MgCl21.5mol/L,10×PCR 缓冲液 2.5 μL,dNTPs 200 μmol/L(TAKARA),DMSO 1 μL,模板DNA 60 ng,上下游引物均为 0.2 μmol/L,PCR 程序为 94 ℃ 变性 5 min;94 ℃,45 s,55 ℃,60 s,72 ℃,60 s,30个循环;72℃延伸10 min。
1.4 扩增DNA产物的回收、克隆与测序
所有水稻材料的DNA扩增产物在15 g/L琼脂糖凝胶上进行电泳分离,紫外灯下割胶后,用DNA胶回收试剂盒(Axyprep DNA,Axygen,Beijing)进行扩增DNA片段的回收与纯化,具体操作按DNA胶回收试剂盒说明书进行。回收的各水稻材料orfH79 DNA片段分别连接于pGM T-vector(Tiangen,Beijing),受体菌为DH5α。在含氨苄青霉素的选择性固体培养基上进行细菌培养。挑选3~5个阳性克隆对目标片段进行PCR验证。每个水稻材料挑选3个经PCR验证的阳性克隆进行测序。DNA序列测定由上海生工公司完成。
1.5 序列分析及聚类分析
所有水稻材料的DNA序列以CLUSTAL-X软件进行比对并辅以人工校正[24]。聚类分析采用Mega6.0版软件[25]中的邻接(Neighbor-joining,N-J)法进行。DNA序列之间的遗传距离按照Maximum Composite Likelihood model模型计算。
2 结果与分析
2.1 HL-CMS基因orfH79及其同源序列在稻种资源中的分布
为了探明HL-CMS基因orfH79及其同源序列在水稻资源中的存在,利用开放阅读框orfH79片段的保守区设计特异性PCR扩增引物对:PF和PR,对来自不同稻作国家的124份水稻材料进行PCR检测,结果获得18份具有orfH79片段的水稻材料(见表1)。18份水稻材料包括3份一年生普通野生稻(O.nivara)、3 份多年生普通野生稻(O.rufipogon)、2 份展颖野生稻(O.glumaepatula)、5 份栽培水稻(O.sativa L.)和 5 份栽培稻农家种(O.sativa landrace),它们分别来自中国(4)、印度(4)、孟加拉(2)、喀麦隆(2)、斯里兰卡(2)、巴西(1)、苏里兰(1)、菲律宾(1)和美国(1)等9个稻作国家。结果表明HLCMS基因orfH79及其同源序列在稻种资源中具有较高频率的存在(14.5%),并广泛分布于地球上的相关稻作地区。为了验证筛选结果的准确性,利用引物对PF和PR,对筛选出的18份水稻材料做了进一步的PCR验证,结果显示18份水稻材料均含有目标片段(图1),验证了本研究筛选结果的准确性。

图1 引物对PF和PR在18份含有orfH79水稻材料的PCR扩增验证Fig.1 orfH79 PCR validation of 18 rice materials by primer pairs PF and PR
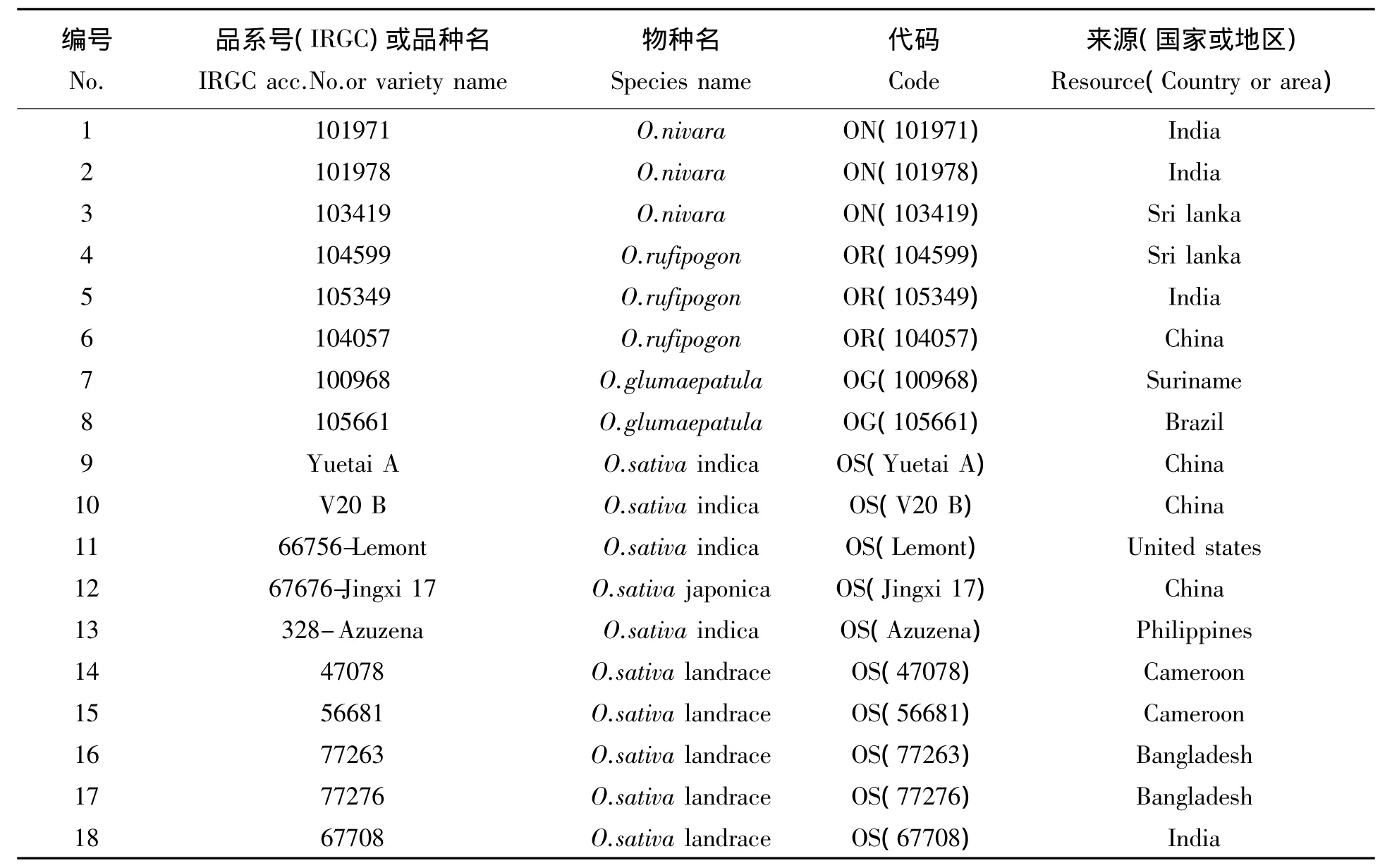
表1 本研究筛选出的18份水稻材料信息Tab.1 Information of 18 selected rice materials used in this study
2.2 DNA碱基及多肽氨基酸变异分析
研究已经证实水稻HL-CMS基因orfH79和BT-CMS基因orf79同为一个240 bp组成的开放阅读框[11,13]。DNA序列比对分析显示,本研究筛选出的18份水稻材料的orfH79片段及其同源序列和BTCMS基因orf79序列均为240 bp,且其保守性高达97%,有6个碱基多态性变异位点被检测出。在检出6个碱基变异位点中,第4和13位碱基,分别为A与G,C与G的变换,但这种变异为BT-CMS系Chinsurah Boro II所特有,表现出了BT-CMS基因orfH79与HL-CMS基因orf79在DNA水平上的重大差异;第142位碱基,表现为A与T之间的变换;第146位碱基为C、A变换;第147位碱基为A、T、C之间的变化;以及第178位碱基的C与T替换。其中第142、146和147位点表现为碱基的颠换,第178位点则为碱基的转换。根据DNA序列变异信息,具HL-CMS基因orfH79片段的18份水稻材料可分为四个类群,BT-CMS基因orf79由于其存在2个特有碱基变异而单独成为一类。各水稻材料orfH79/orf79或其同源序列碱基变换的详细信息见表2。
研究表明水稻HL-CMS基因orfH79与BT-CMS基因orf79均编码一个79氨基酸的多肽ORFH79[11,13]。根据氨基酸密码子编码信息显示,本研究中包括BT-CMS系在内的19份水稻材料的6个碱基变异导致多肽ORFH79/ORF79产生了5个氨基酸位点的改变(表2)。氨基酸序列比对分析表明多肽ORFH79/ORF79的第2和第5位密码子分别产生了由ACA→GCA和CTC→GCT的变化,使BTCMS基因orf79编码的多肽ORF79第2位和第5位氨基酸分别由苏氨酸(Thr)突变为丙氨酸(Ala),亮氨酸(Leu)突变为缬氨酸,从而形成了BT-CMS基因orf79不同于其它18个含HL-CMS基因orfH79的多肽变异模式;第48密码子产生了由ATG→TTG的突变,使其第48位氨基酸表现为甲硫氨酸(Met)与亮氨酸(Leu)间的变换;而第49密码子表现为一种较复杂的多态性变异模式,分别形成GCA、GCT、GAA和GAC四种密码子,由于GCA与GCT相互为同义密码子,均编码丙氨酸(Ala),因此,多肽ORFH79/ORF79的第49位氨基酸表现为丙氨酸(Ala)、谷氨酸(Glue)和天冬氨酸(Asp)之间的多态性变异模式;第60密码子则由CAC→TAC,产生组氨酸(His)与酪氨酸(Tyr)之间的转变。同时根据多肽ORFH79/ORF79氨基酸的变异信息,包括BT-CMS系在内的19份水稻材料可分为四个类群,其中BT-CMS系由于其独特的多肽变异模式而单独称为一类(表2)。
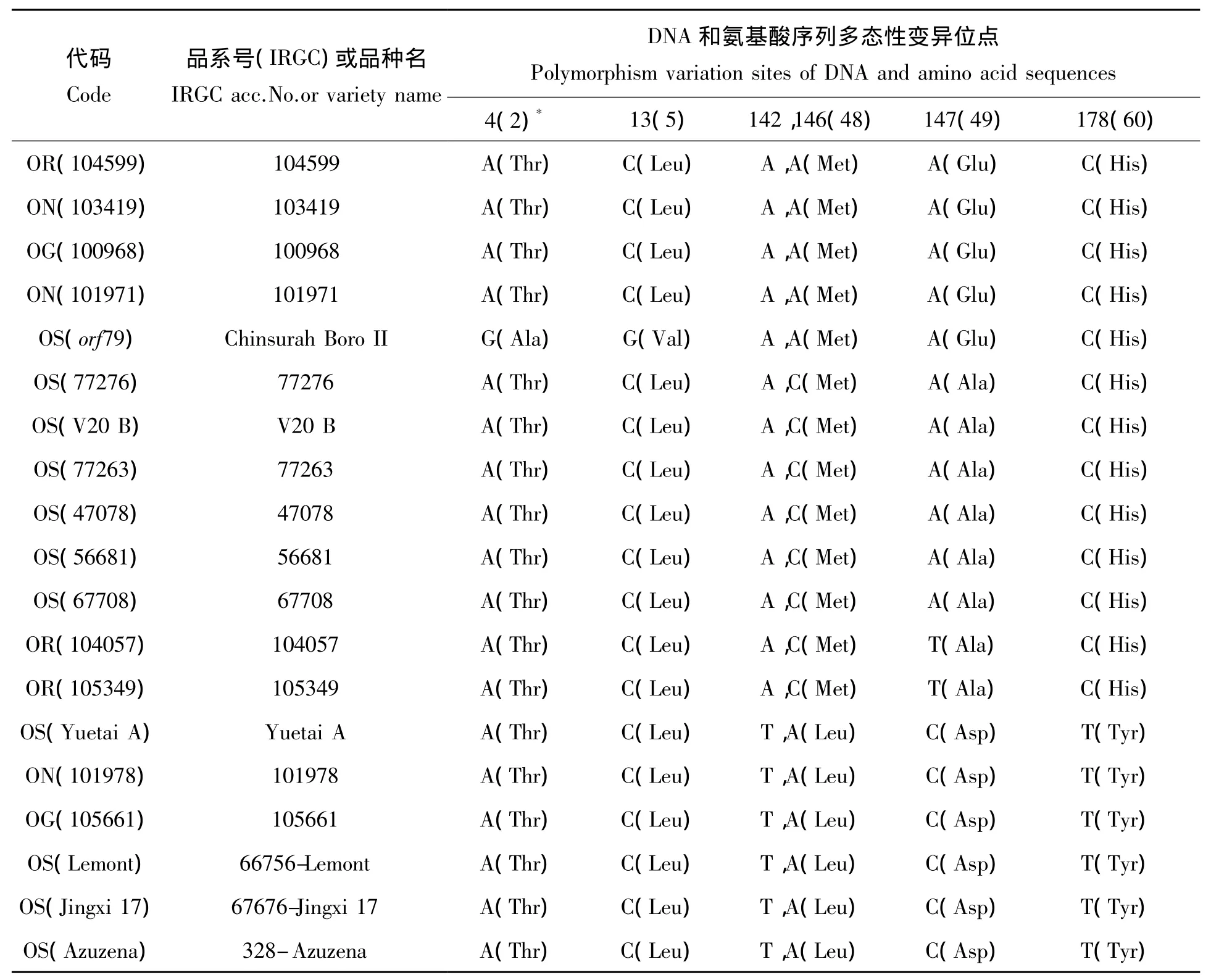
表2 18份水稻材料的orfH79/orf79及其同源序列和的DNA与氨基酸序列变异分析Tab.2 Analysis of DNA and amino acid variation for orfH79/orf79and its homologous sequences in 18 rice materials
2.3 聚类分析
利用Mega6.0软件根据包括BT-CMS系“Chinsurah Boro II”在内的19份水稻材料的orfH79/orf79及其同源序列数据进行聚类分析(图2)。结果显示,DNA序列的变异使18份含HL-CMS基因orfH79的水稻材料形成了四个类群:野生稻“101978”、“105661”和栽培稻品种“Lemont”、“Jingxi 17”、“Azuzena”与HL-CMS系“Yuetai A”的orfH79序列变异一致而聚在了一起形成第i类群;两个一年生普通野生稻(O.nivara)“10971”、“103419”与 1 个多年生普通野生稻(O.rufipogon)“104599”以及展颖野生稻(O.glumaepatula)“100968”聚在了一起组成第ii类群;5个栽培稻农家种(O.sativa landrace)“77276”、“77263”、“47078”、“56681”和“67708”一致地聚在一起与栽培稻“V20B”构成了第 iii类群;多年生普通野生稻品种“104057”与“105349”聚为第iv类群。BT-CMS系“Chinsurah Boro II”由于其独特的序列变异模式而单独成为一支。但从多肽ORFH79氨基酸的变异来看,由于第iv类群的2个多年生普通野生稻品种“104057”与“105349”的第49密码子(GCT)与第iii类群6个栽培稻品种的第49密码子(GCA)相互为的同义密码子,所以根据氨基酸序列变异信息,18份含HL-CMS基因的水稻材料则被分成了3个类群(图2I、II、III)。多肽ORF79由于其特有的氨基酸变异模式而使BT-CMS系“Chinsurah Boro II”单独成为IV类。碱基变异导致基因功能的改变,通常是由其变异的多肽或蛋白质表现出来,因此,根据氨基酸序列的变异可以推测HL-CMS胞质在水稻资源中至少分化出3种变异类型。

图2 基于19份水稻材料的orfH79/orf79及其同源序列构建的聚类分析Fig.2 A clustering tree of 19 accessions rice materials based on orfH79/0rf79 and its homologous sequences
3 讨论
3.1 HL-CMS基因orfH79及其同源序列在水稻资源中的分布
在当前水稻生产实践中,由于三系法杂交稻稳定的育性和完善的技术体系,其在生产上依然具有非常重要的地位,因此,发掘与培育新型水稻CMS系,对丰富水稻CMS胞质,培育高产优质杂交稻组合具有重大的意义[3]。生产上利用远缘杂交进行水稻CMS系的选育,是新水稻CMS系培育的主要方式。研究已经证实线粒体异常嵌合基因orfH79为HL-CMS基因[15-19]。利用水稻CMS基因为特异选择标记,以检测水稻资源中相应不育胞质的存在,是发掘与培育新水稻CMS系最为快捷有效的方法[20]。水稻HL-CMS胞质来源于红芒野生稻[23],推测其在水稻资源中,特别是野生近缘种或农家种中应该广泛的存在。本研究利用HL-CMS基因orfH79为特异分子标记对来自不同稻作国家的124份水稻材料进行筛选,结果显示HL-CMS基因orfH79在水稻资源中(包括野生稻、栽培稻以及农家种)确实具有较高频率的分布。筛选的18份水稻材料分别来自9个不同的稻作国家,这也表明其具有广泛的地理分布。然而HL-CMS基因orfH79在野生稻和栽培稻中的这种高频率分布,除了引起雄性不育外,是否还有其他方面重要作用,这是一个非常值得去进一步深刻探究的问题。
3.2 HL-CMS基因orfH79及其同源序列的变异多态性
众所周知,发生在基因编码区的碱基变异可能会导致其编码氨基酸的变化,从而产生多肽或蛋白质结构的变异,最终可能引起多肽或蛋白质功能的改变[24]。Yi等[13]2002年研究证实水稻HL-CMS基因orfH79与BT-CMS基因orf79在编码序列上高度同源(具97%的同源性),它们之间仅存在6个碱基的替换,并导致多肽ORFH79与ORF79之间产生5个氨基酸的变异。然而正是由于这6个碱基及5个氨基酸的变异导致HL-CMS与BT-CMS表现出明显不同的花粉败育表型(前者为园败,后者为染败),并产生了不尽相同的败育机制[15-19,27-28]。本研究对筛选出的18份水稻材料以及BT-CMS系“Chinsurah Boro II”的orfH79/orf79及其同源序列进行了分析,结果显示HL-CMS基因orfH79和BT-CMS基因orf79及其同源序列在水稻资源中确实具有非常保守的遗传特性(同源性达97%)。18份含HL-CMS基因orfH79及其同源序列的水稻材料仅检测出4个多态性碱基变异位点,这4个多态性变异位点可将这18份水稻材料分成4个类群。氨基酸序列变异分析显示4个碱基位点的替换导致多肽ORFH79产生了3个氨基酸的变异,并将18份水稻材料分为3个类群。DNA和氨基酸序列的聚类结果也进一步表明,HL-CMS基因与BT-CMS基因属于不同类型胞质不育基因,这一点在以往的研究中已经得到了证实[15-19,27-28]。另外有趣的是,从聚类结果来看,栽培稻品种和农家种分别聚在了一起,而野生稻品种则表现为多样性的变异特点,说明栽培稻存在明显的人工选择倾向,也进一步表明HL-CMS基因orfH79在栽培稻中除了引起雄性不育外,可能还有其他方面重要作用。根据多肽氨基酸序列的变异模式,我们可以看出HLCMS胞质在水稻资源中可能分化出至少3种以上的变异类型,然而这些不同的变异类型是否导致不同的败育机制,也非常值得进一步深入去探究。
致谢:菲律宾国际水稻研究所种质资源中心Guzman Flora博士提供了所有的野生稻材料和部分栽培稻材料,江西农业大学贺浩华教授、江西师范大学谢建坤教授为本文的修改提出了宝贵建议,谨致谢意!
[1]张启发.中国科学家阐明Boro II型水稻细胞质雄性不育和育性恢复的分子机理[J].分子植物育种,2006,4(4):451-452.
[2]Ouyang Y D,Liu Y G,Zhang Q F.Hybrid sterility in plant:stories from rice[J].Current Opinion in Plant Biology,2010,13(2):186-192.
[3]黄文超,胡俊,朱仁山,等.红莲型杂交水稻的研究与发展[J].中国科学,2012,42(9):689-698.
[4]Shinjyo C.Cytoplasmic genetic male sterility in cultivated rice,Oryza sativa L.Ⅱ.The inheritance of male sterility[J].Jpn J Genet,1969,44(3):149-156.
[5]Lin S C,Yuan L P.Hybrid rice breeding in China[M]//IRRI.Innovative approaches to rice breeding,Manila,Philippines,1980:35-51.
[6]Rao Y S.Cytohistology of cytoplasmic male sterile lines in hybrid rice[M]//Smith W H,Bostian L R,Cervantes E P(eds.).Hybrid Rice .Manila,Philippines:International Rice Research Institute,1988:115-128.
[7]翟妙仙,许亦峰,刘玉芹,等水稻细胞质雄性不育及育性恢复的研究进展[J].福建稻麦科技,2013,31(1):91-93.
[8]Schnable P S,Wise R P.The molecular basis of cytoplasmic male sterility and fertility restoration[J].Trends Plant Sci,1998,3(5):175-180.
[9]Kadowaki K,Suzuki T,Kazama S.A chimeric gene containing the 5′portion of atp6 is associated with cytoplasmic male sterility of rice[J].Mol Gen Genet,1990,224(1):106-116.
[10]Iwabuchi M,Kyozuka J,Shimamoto K.Processing followed by complete editing of an altered mitochondrial atp6 RNA restores ferti1ity of cytoplasmic male sterility rice[J].EMBO J,1993,12(4):1437-1446.
[11]Akagi H,Sakamoto M,Shinjyo C,et al.A unique sequence located downstream from the rice mitochondrial atp6 may cause male sterility[J].Current Genetics,1994,25(1):52-58.
[12]Akagi H,Nakamura A,Sawada R,et al.Genetic diagnosis of cytoplasmic male sterile hybrid plants of rice [J].Theor Appl Genet,1995,90(7/8):948-951.
[13]Yi P,Wang L,Sun Q P,et al.Discovery of mitochondria chimeric gene associated with male sterility of Honglian-rice [J].Chinese Science Bulletin,2002,47(9):744-747.
[14]Wang Z H,Zou Y J,Li X Y,et al.Cytoplasmic male sterility of rice with boro II cytoplasm is caused by a cytotoxic peptide and is restored by two related PPR motif genes via distinct modes of mRNA silencing[J].The Plant Cell,2006,18(3):676-687.
[15]Kazama T,Nakamura T,Watanabe M,et al.Suppression mechanism of mitochondrial ORF79 accumulation by Rf1 protein in BT-type cytoplasmic male sterile rice [J].The plant Journal,2008,55(4):619-628.
[16]Ohta H,Ogino A,Kasai M,et al.Fertility restoration by IfrI in rice with BT-type cytoplasmic male sterility is associated with a reduced level,but not processing of atp6-orf79 co-transcribed RNA [J].Plant Cell Rep,2010,29(4):359-369.
[17]Peng X J,Wang K,Hu J,et al.The mitochondrial gene orfH79 plays a critical role in impairing both male gametophyte development and root growth in CMS-Honglian rice[J].BMC Plant Biology,2010,10(1):125.
[18]Hu J,Wang K,Huang W C,et al.The rice pentatricopeptide repeat protein rf5 restores fertility in Hong-Lian cytoplasmic male-sterile lines via a complex with the glycine-rich protein GRP162 [J].Plant Cell,2012,24(1):109-122.
[19]Wang K,Gao F,Ji Y X,et al.ORFH79 impairs mitochondrial function via interaction with a subunit of electron transport chain complex III in Honglian cytoplasmic male sterile rice [J].New Phytologist,2013,198(2):408-418.
[20]段世华,李绍清,李阳生,等.水稻CMS相关基因在稻属AA基因组中的分布及其单核苷酸多态性[J].遗传,2007,29(4):455-461.
[21]郑卓,张蓓玲,段世华,等.水稻新资源温敏核不育系长S的遗传学研究[J].植物遗传资源学报,2012,13(6):979-983.
[22]Duan S H,Lu B R,Li Z,et al.Phylogenetic analysis of AA-genome Oryza species(Poaceae)based on chloroplast,mitochondrial,and nuclear DNA sequences[J].Biochemical Genetics,2007,45(1/2):113-129.
[23]朱英国.水稻雄性不育生物学[M].武汉:武汉大学出版社,2000:12-14.
[24]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf material[J].Phytochemical Bulletin,1987,19(1):11-15.
[25]Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL-X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4876-4882.
[26]Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0 [J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[27]Tan Y P,Li S Q,Xie H W,et al.Genetical and molecular analysis reveals a cooperating relationship between cytoplasmic male sterility and fertility restoration-related genes in Oryza species[J].Theor Appl Genet,2011,122(1):9-19.
[28]Wang K,Peng X J,Ji Y X,et al.Gene,protein,and network of male sterility in rice[J].Frontiers in Plant Science,2013,4:1-9.
