梯度复合HA/ZrO2多孔支架材料在松质骨缺损应用的实验
2015-05-13邵荣学全仁夫谢尚举杨迪生韦习成
邵荣学,全仁夫,张 亮,谢尚举,杨迪生,韦习成
(1.浙江中医药大学,杭州 310053;2.杭州市萧山区中医院骨科,杭州 311200;3.浙江大学附属第二医院骨科,杭州 310009;4.上海大学材料科学与工程学院,上海 200072)
梯度复合HA/ZrO2多孔支架材料在松质骨缺损应用的实验
邵荣学1,全仁夫2,张 亮2,谢尚举2,杨迪生3,韦习成4
(1.浙江中医药大学,杭州 310053;2.杭州市萧山区中医院骨科,杭州 311200;3.浙江大学附属第二医院骨科,杭州 310009;4.上海大学材料科学与工程学院,上海 200072)
目的评估新型梯度复合HA/ZrO2(羟基磷灰石/二氧化锆)多孔支架材料在修复比格犬椎体骨缺损的效果。方法(1)采用泡沫海绵体浸渍成型法、联合梯度复合及高温烧结法制备新型梯度复合HA/ZrO2多孔支架材料;(2)将18只普通级比格犬(体重10~13kg、5~8月龄、雌雄不拘)随机分成2组(A组12只、B组6只),通过手术复制椎体骨缺损模型,A组予以植入梯度复合HA/ZrO2多孔支架材料、B组植入自体髂骨;(3)术后进行影像学检查、形态学观察及生物力学测试,并比较新型梯度复合HA/ZrO2多孔支架材料与自体髂骨对修复比格犬椎体缺损的效果。结果(1)新型HA/ZrO2多孔支架材料孔隙率为25ppi(每英寸25个孔)、孔隙均匀,孔径为100~300μm。(2)术后6周、12周、24周X线影像学观察显示:A组,随着术后时间延长,新型梯度复合HA/ZrO2多孔支架材料植入术后骨痂生成逐渐增多、植入材料与宿主骨之间的界线逐渐模糊,至术后24周,人工材料与自体新生骨融为一体;B组,在术后6周显示移植骨的吸收与塑形,至术后24周移植骨与自体骨完全融合,无明显界限。(3)组织形态学显示:支架材料孔隙内骨量随着术后时间延长逐步增加,部分材料降解、被新生骨替代。(4)生物力学测试:术后24周极限抗压试验,两组比较无明显统计学差异(P>0.05)。结论新型梯度复合HA/ZrO2多孔支架材料可诱导骨组织长入孔隙内部、促进松质骨缺损愈合,有望在未来的研究中,广泛应用于松质骨缺损的治疗。
羟基磷灰石;二氧化锆;骨组织工程;人工椎体
多孔支架材料的应用始于上个世纪70年代,最初主要用于高温熔融、合金过滤等,后来逐渐扩展到环境、隔热、汽车制造、及化学和生物等领域[1]。查阅文献发现,1971年,Rhinelander等[2]率先把多孔支架材料植入犬的胫骨,同时比较与金属材料的效果差异,术后4月显示:金属材料被新生骨组织及纤维组织包裹,而多孔支架材料与新生骨、及宿主骨得到严密整合。Benum等[3]将多孔支架材料植入羊的胫骨,术后3月发现:骨组织已长入泡沫材料内部达2~3mm,术后12月可见材料内部4mm内布满新生骨组织,未发现材料相关并发症。同时,一些学者对多孔支架材料的机械特性、组织相容性等做了相关研究,结果显示机械特性尚可、组织相容性较好[4-5]。
制备多孔支架材料的基质材料种类较多,其中最为常用的是羟基磷灰石。羟基磷灰石[Ca10(PO4)6(OH)2]是一种生物活性材料,是构成脊椎动物骨组织的主要无机成分。其植入人体后,会被体液部分降解释放出人体组织所必需的钙、磷元素,并被人体组织吸收、利用,结合入新的组织,从而使HA植入物和人体骨组织获得良好的结合[6]。但是,多孔支架材料的机械强度随着孔隙率的升高和孔径的增大几乎呈直线下降[7]。利用泡沫浸渍技术制备的多孔支架材料平均抗压强度和弹性模量分别为1.04±0.15MPa和0.1 GPa,而松质骨的抗压强度和弹性模量分别为2~12MPa和0.3 GPa[8]。故单一的HA材料难以满足人体松质骨替代的要求、更限制其在承重骨区域的应用[9]。从而,通过加入不同性能材料来提高HA的力学强度、韧性等性能已得到广泛关注。本文通过梯度复合二氧化锆(ZrO2)陶瓷材料来提高其机械性能,因为ZrO2具有较高的弯曲强度、断裂韧性和较低的弹性模量,且具有一定的生物相容性。研究显示HA/ZrO2复合材料的抗弯曲强度、抗压强度明显高于单纯HA[10]。此外,HA/ZrO2在体内、外实验中显示出完全的生物相容性,在骨组织、肌肉组织界面未出现副作用,细胞毒性试验和溶血试验的反应是微弱的、可接受的[11-12]。因此,梯度复合HA/ZrO2多孔支架材料为骨移植提供良好的替代材料。本文通过比较梯度复合HA/ZrO2多孔支架材料与自体髂骨移植修复椎体骨缺损的效果,为理想的骨组织工程支架材料的应用提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验用梯度复合HA/ZrO2多孔支架材料的制备
实验选用的添加剂为聚乙烯醇(PVA)、羧甲基纤维素(CMC)、硅溶胶、聚丙稀酸铵(PAA-NH4)、辛醇。将ZrO2粉体和添加剂按照预定配比进行完全混合研磨后和一定量的去离子水进行混合,混合过程采用粉球质量比为1:2,以300r/min的高速球磨机球磨3h制取浆料,而后进行挂浆。挂浆时,将有机泡沫内部多余的浆料通过挤压法压出,保证其通孔率,随后将试样在室温下放置18~24h自然干燥,然后放至烘箱中,于110℃烘干12h,使其水分质量分数降到1%以下。晾干和烘干时,采用翻倒工艺,前10min以1次/min速度翻倒,后翻倒间隔延长至2~3min;然后进行第二次研磨浆料挂浆,采用离心挂浆法,1500r/min离心;最后采用同样的烘干工艺后进行第3次挂浆,3次挂浆后进行晾晒烘干以供烧结。
烧结时,分别以2℃/min的速度从室温升至100℃、以1℃/min升温至200℃、以1℃/2min升温至500℃并保温1h、以2℃/3min升温至750℃并保温1h、以2℃/min升温至1200℃,最后以3℃/min升温至1550℃并保温烧结3h,然后随炉冷却,获得纯ZrO2人工椎体。采取两步浸涂法涂覆梯度HA涂层,按照原料质量百分比:HA粉末44.5%,磷酸乙酯约1.4%,乙基纤维素约0.18%,蒸馏水53.92%。先将HA在800℃进行预处理,然后将上述其他原料在热水中进行混合并搅拌5h。将烧结出的多孔陶瓷浸入浆料中,待完全浸透后取出,甩掉多余浆料,100℃下烘干干5h,然后升温至900℃并烧结5h,最后加热至1250℃烧结1h;同法进行第二次浸涂浆料。最后根据实验需要制得不同规格的新型梯度复合HA/ZrO2多孔支架材料。
1.1.2 实验动物及分组
普通级比格犬18只,体重10~13kg,月龄5~8月,雌雄不限,均购于浙江中医药大学实验研究中心【SCXK(浙)2010-0043】。无菌手术在浙江中医药大学实验研究中心手术室实施【SYXK(浙)2013-0184】。并按实验动物使用的3R原则给予人道的关怀。将比格犬随机分成实验组(A组,植入新型梯度复合HA/ZrO2多孔支架材料,12只)和空白对照组(B组,植入自体髂骨,6只)。
1.2 方法
1.2.1 手术方法
手术采用3%的戊巴比妥钠按1mL/kg的剂量经静脉给药麻醉,行气管插管,手术过程持续呼吸机辅助通气。取右斜侧卧位(躯干与手术台面成45°角),手术取腰椎前外侧(经腹膜后)入路,局部脱毛、消毒,沿第12肋后半部下方向下至脐及耻骨联合中点平面的腹直肌外缘作腹侧方斜切口、长约8~10cm,钝性分离皮下脂肪显露腹外斜肌腱膜、沿纤维走向将其分开,切开腹内斜肌,轻轻游离腹膜后腔及其内容物并将其推向内侧,显露手术椎体。充分游离腰3(L3)椎体水平腰横动脉及伴行静脉并予以结扎,用盐水纱布保护并牵开腹主动脉、下腔静脉及腹腔脏器,充分暴露L3椎体及上下相邻椎体。在冠状面以横突为界凿除前方2/3椎体,手术复制椎体部分缺损模型,刮除手术节段相邻椎间盘。A组实验动物植入新型梯度复合HA/ZrO2多孔支架材料;B组实验动物植入自体髂骨。确认植入物位置满意后,再以长度56mm掌骨接骨钢板固定。逐层缝合肌肉、皮下组织及皮肤。术后单笼常规饲养;术后3日内每只动物予以青霉素160万单位肌注,每日一次,以预防感染,术后2周拆线。所有手术操作由同一组医生完成。
1.3 观察指标
1.3.1 新型梯度复合HA/ZrO2多孔支架材料结构观察
观察材料的一般情况,包括新型梯度复合HA/ZrO2多孔支架材料的孔隙率、孔隙分布情况、孔径的大小,及材料的力学性能。
1.3.2 动物一般情况观察
观察实验动物的四肢活动、饮食、二便情况;手术部位有无红肿、渗液、感染,及手术切口的愈合情况。
1.3.3 术后影像学观察
术后6周、12周、24周,在静脉麻醉下,行腰椎摄片(曝光条件是:44KV,100MA,0.6MS),观察植入物位置及手术节段骨痂生长情况。
1.3.4 术后取材及组织切片、染色
分别于术后6周、12周、24周,A组各取2只实验动物在3%的戊巴比妥钠(1mL/kg)静脉麻醉下,利用空气栓塞法处死动物。暴露手术节段,相邻椎体从椎间盘处离断,取手术节段比格犬腰椎椎体,剔除椎体周围的软组织,锯除后缘的椎板。用丙酮脱水脱脂7d,甲基丙烯酸甲酯包埋,隔水式恒温培养箱中保存7d。用硬组织切片机(型号:EXAKT 310 CP)切片,切片厚度约50μm,分别进行苏木精-伊红及甲苯胺蓝染色,光学显微镜下观察。
1.3.5 生物力学测试(极限抗压实验)
将其余实验动物饲养至术后24周,通过上述方法取得新鲜标本,剔除腰椎椎体周围的软组织,保留椎体关节突关节完整。将标本置于力学测试系统(型号:Flex Test 40,Load Cell,Hydraulic Power Unit)上并固定,使椎体的长轴平行于压力轴,压缩强度速率设定为0.5mm/min,载荷从零开始直到标本破坏为止,试验机同步记录载荷-位移曲线,根据载荷-位移曲线读取最大抗压载荷Fm。极限抗压强度计算公式:P=Fm/S,其中S为受力表面积。
1.4 统计学分析
应用SPSS 18.0统计学软件进行分析,数据以均数±标准差(±ss)表示。分别对两组术后生物力学测试进行比较,组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 新型梯度复合HA/ZrO2多孔支架材料的结构观察
采用泡沫海绵体浸渍成型法、联合梯度复合及高温烧结法制备的新型梯度复合HA/ZrO2多孔支架材料的孔隙率为25ppi(每英寸25个孔)、孔隙均匀,孔径为100~300μm;空白材料的极限抗压强度详见生物力学的测试结果;根据实验需要,制备成不同规格。肉眼观察材料呈多孔交联状;显微镜下观察孔径大小、密度相当,偶见堵孔;扫描电镜下观察涂层均匀、梯度复合良好,两种材料结合致密(彩插6图1)。
2.2 一般情况观察
所有实验动物于术后0.5~2h苏醒,能站立行走、自主进食,四肢活动情况良好,二便无异常;对外界刺激反应灵敏;术后2周拆线,切口Ⅰ/甲愈合。
2.3 影像学观察
腰椎摄片,手术骨缺损造模满意。材料组(A组):支架材料随着术后时间延长密度降低,至术后24周,材料密度与自体骨接近,缺损边界和内部结构模糊,内有毛玻璃样新骨生成(封3图2);自体髂骨组(B组):术后6周可见骨吸收、植入骨塑形,至24周移植骨与自体骨完全融合(封3图3)。
2.4 组织学观察结果
苏木精-伊红染色和甲苯胺蓝染色显示,随着术后时间延长,均可见新生骨小梁向材料孔隙内爬行、并逐渐增加,材料与宿主骨界面模糊,术后24周可见部分材料降解被新生骨小梁替代、剩余材料被新生骨小梁包裹,二者交联,结合紧密(封3图4~5)。
2.5 生物力学测试结果
术后24周极限抗压试验结果显示:空白新型梯度复合HA/ZrO2多孔支架材料的极限抗压强度为2.52MPa±0.46MPa,A组手术椎体的体外极限抗压强度为13.98 MPa±1.64MPa;B组为14.72MPa±2.02MPa。两组比较差异无统计学意义(P>0.05)(图6)。
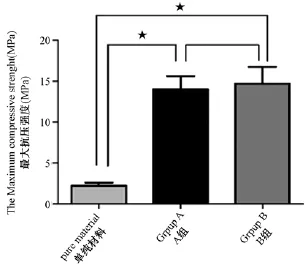
注:术后24周,新型梯度复合HA/ZrO2多孔支架材料组(A组)与自体髂骨组(B组)的极限抗压强度比较,差异无统计学意义(P>0.05),两组的抗压强度均大于空白HA/ZrO2材料(P<0.05),(*差异有显著统计学意义,P<0.05)。图6 生物力学测试结果Note:There was no significant difference between the two subgroups(P>0.05)in the maximum compressive strengths of biomachanics test at 24 weeks of post-operation,which was higher than that of pure HA/ZrO2material(P<0.05),(* significant difference,P<0.05).Fig.6 Biomechanical results
3 讨论
目前,常用的人工骨材料多为密质材料,仅能起到骨替代的作用,无法引导新生骨爬行至移植物内并使之融为一体。这也意味着移植材料在体内存在着耗损、老化、断裂的风险。HA多孔支架材料能诱导新生骨组织长入支架内部,从而达到宿主骨组织与支架材料的严密整合,成功解决了当前密质材料的问题[13]。与其他医用生物支架材料相比,HA具有良好的生物相容性、骨诱导性及骨传导性。但是,材料孔径的大小直接影响新生骨细胞的粘附及新生血管的长入,3-D网状连接的孔隙为新生骨和血管提供一个通道[14-15]。有学者指出,孔径大于100μm可以为新生骨细胞、及血管的生长提供一个支架,利于成骨细胞、软骨细胞及血管内皮细胞在其内部分化、扩增和爬行[16-17]。然而,材料的机械强度随着孔隙率的升高和孔径的增大而降低,通过加入不同性能的材料,来解决HA的力学强度、韧性不足等问题。
本研究通过把HA和ZrO2粉末梯度复合制备成多孔支架材料、并将材料植入比格犬椎体骨缺损处,术后24周极限抗压试验结果显示:HA/ZrO2梯度复合多孔材料组体外的极限抗压强度为13.98MPa±1.64MPa,达到松质骨的抗压强度(2~12MPa)[8];自体髂骨组为14.72MPa±2.02MPa。两组比较无明显统计学差异(P>0.05)。实验结果显示本材料即达到多孔支架材料的效果,又具有可靠的机械强度。现已有实验表明,HA陶瓷材料中有选择地加入第二相生物惰性材料(ZrO2)颗粒可以显著提高材料的断裂韧性,由于其具有良好的机械力学性能,基体与HA梯度复合制成多孔支架材料后,增加其生物相容性,用于承载种植体,当支架材料受到外加应力而产生裂纹时,第二相颗料能够有效地吸收能量,阻止材料断裂,从而提高材料的机械特性,达到人体承重骨的使用要求[18]。
从组织学观察结果看,随着术后时间延长,新生骨小梁向材料孔隙内爬行、并逐渐增加,术后24周可见部分材料降解、并被新生骨小梁取代、剩余材料被新生骨小梁包裹,二者交联,结合紧密。但是仅靠骨自身细胞增殖速度较慢,随着干细胞技术的快速发展,骨髓间充质干细胞(BMSCs)已被广泛应用,由于其可通过体外分离、培养、扩增,在不同诱导条件下可向骨细胞、神经细胞、脂肪细胞和内皮细胞等方向转化,且具有取材方便、体外增殖能力强、易于基因操作等优势,逐渐成为基因治疗适宜的细胞载体[19-20]。根据文献报道,通过体外培养、扩增的BMSCs种植于多孔羟基磷灰石可促进异位成骨、加速新生骨长入多孔结构内部孔道[21-22]。但获取BMSCs通常需要额外的手术,故受时间、地点及组织来源等限制,术后可能会出现取材局部的感染、愈合不良等并发症,且BMSCs会随着供者年龄的增长而增殖能力下降。
本课题计划在后续的研究中,应用诱导性多能干细胞(induced pluripotent stem cells,iPSCs)来源的MSCs种植于HA/ZrO2梯度复合多孔材料上,将上述材料植入实验动物骨缺损处,观察其作用效果,并逐步应用于临床。iPSCs具有和胚胎干细胞(embryonic stem cells,ESCs)类似的多潜能、多克隆分化等特性,且可以避免应用ESCs所面临的免疫排斥和伦理问题[23]。目前,iPSCs可以通过同源宿主体细胞重编程获得,例如人类纤维母细胞[24]、原始肝细胞[25]、神经干细胞[26],及其他体细胞等[27-29]。但直接应用iPSCs有形成畸胎瘤的潜在风险,有研究证实iPSCs可以在体外诱导分化成MSCs[30],来源于iPSCs的MSCs与H9-hECs有相似的特性,可通过诱导向成骨细胞和成软骨细胞等分化[31]。以iPSCs来源的MSCs种植于新型梯度复合HA/ZrO2多孔支架材料,构建的组织工程骨有望成为未来骨组织工程研究和应用的主流。
[1]靳洪允.泡沫陶瓷材料的研究进展[J].现代技术陶瓷,2005,3:33-36.
[2]Rhinelander FW,Rouweyha M,Milner JC.Microvascular and histogenic responses to implantation of a porous ceramic into bone[J].Journal of Biomedical Materials Research,1971,5(1):81-112.
[3]Benum P,Lyng S,Alm T,et al.Porous ceramics as a bone substitute in the medial condyle of the tibia.An experimental study in sheep.Long-term observations[J].Acta Orthopaedica,1977,48(2):150-154.
[4]Niles JL,Coletti JM Jr,Wilson C.Biomechanical evaluation of bone-porous material interfaces[J].Journal of Biomedical Materials Research,1973,7(2):231-251.
[5]Gallinetti S,Canal C,Ginebra MP,et al.Development and Characterization of Biphasic Hydroxyapatite/β-TCP Cements[J].J Am Ceram Soc,2014,97(4):1065-1073.
[6]Tancred DC,McCormack BA,Carr AJ.A synthetic bone implant macroscopically identical tocancellousbone[J].Biomaterials,1998,19:2303-2311.
[7]Taniyama T,Masaoka T,Yamada T,etal.Repair of osteochondraldefects in a rabbitmodelusing a porous hydroxyapatite collagen composite impregnated with bone morphogenetic protein-2[J].Artif Organs,2015,39(6):529-535.
[8]Liu B,Lin P,Shen Y,et al.Porous bioceramics reinforced by coating gelatin[J].Journal of materials science Materials in medicine,2008,19:1203-1207.
[9]Linhart W,Briem D,Amling M,et al.Mechanical failure of porous hydroxyapatite ceramics 7.5 years after implantation in the proximal tibial[J].Der Unfallchirurg,2004,107:154-157.
[10]Silva VV,Domingues RZ.Hydroxyapatite-zirconia composites prepared by precipitation method[J].Journal of materials science Materials in medicine,1997,8:907-910.
[11]Abedi G,Jahanshahi A,Fathi MH,et al.Study of nanohydroxyapatite/zirconia stabilized with yttria in bone healing:histopathological study in rabbit model[J].Pol J Pathol,2014,65(1):40-47.
[12]Quan R,Yang D,Wu X,et al.In vitro and in vivo biocompatibility of graded hydroxyapatite-zirconia composite bioceramic[J].Journal of materials science Materials in medicine,2008,19:183-187.
[13]Kwon BJ,Kim J,Kim YH,et al.Biological advantages of porous hydroxyapatite scaffold made by solid freeform fabrication for bone tissue regeneration[J].Artif Organs,2013,37(7):663-670.
[14]Kovtun A,Goeckelmann MJ,Niclas AA,et al.In vivo performance of novelsoybean/gelatin-based bioactive and injectable hydroxyapatite foams[J].Acta Biomater,2015,12:242-249.
[15]胡莹,刘笑涵,王靖宇,等.低强度脉冲超声波辐照与泡沫TiC/Ti对犬节段性骨缺修复的促进作用[J].中国比较医学杂志,2013,23(4):44-47.
[16]Lecomte A,Gautier H,Bouler JM,et al.Biphasic calcium phosphate:a comparative study of interconnected porosity in two ceramics[J].Journal of biomedical materials research Part B,Applied biomaterials,2008,84:1-6.
[17]Omae H,MochizukiY,Yokoya S,etal.Effects of interconnecting porous structure of hydroxyapatite ceramics on interface between grafted tendon and ceramics[J].Journal of biomedical materials research Part A,2006,79:329-337.
[18]Silva VV,Domingues RZ.Hydroxyapatite-zirconia composites prepared by precipitation method[J].Journal of materials science Materials in medicine,1997,8:907-910.
[19]Park J,Ries J,Gelse K,et al.Bone regeneration in critical size defects by cell-mediated BMP-2 gene transfer:a comparison of adenoviral vectors and liposomes[J].Gene Ther,2003,10(13):1089-1098.
[20]Hu N,Feng C,Jiang Y,et al.Regulative Effect of Mir-205 on Osteogenic Differentiation of Bone Mesenchymal Stem Cells(BMSCs):Possible Role of SATB2/Runx2 and ERK/MAPK Pathway[J].Int J Mol Sci,2015,16(5):10491-10506.
[21]Ohgushi H,Goldberg VM,Caplan AI.Heterotopic osteogenesis in porous ceramics induced by marrow cells[J].Journal of orthopaedic research:official publication of the Orthopaedic Research Society,1989,7:568-578.
[22]Ohgushi H,Dohi Y,Tamai S,et al.Osteogenic differentiation of marrow stromal stem cells in porous hydroxyapatite ceramics[J].Journal of biomedical materials research,1993,27:1401-1407.
[23]Ganji F,Abroun S,Baharvand H,et al.Differentiation potential of o bombay human-induced pluripotent stem cells and human embryonic stem cells into fetal erythroid-like cells[J].Cell J,2015,16(4):426-439.
[24]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131:861-872.
[25]Liu H,Ye Z,Kim Y,et al.Generation of endoderm-derived human induced pluripotent stem cells from primary hepatocytes[J].Hepatology(Baltimore,Md),2010,51:1810-1819.
[26]Kim JB,Greber B,Arauzo-Bravo MJ,et al.Direct reprogramming of human neural stem cells by OCT4[J].Nature,2009,461:649-653.
[27]Karakikes I,Ameen M,Termglinchan V,et al.Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes:Insights Into Molecular,Cellular,and Functional Phenotypes[J].Circ Res,2015,117(1):80-88.
[28]Ohnishi H,Skerleva D,Kitajiri SI,et al.Limited hair cell induction from human induced pluripotent stem cells using a simple stepwise method[J].Neurosci Lett,2015,599:49-54.
[29]Yan X,Qin H,Qu C,et al.iPS cells reprogrammed from human mesenchymal-like stem/progenitor cells of dental tissue origin[J].Stem cells and development,2010,19:469-480.
[30]Yang H,Aprecio RM,Zhou X,et al.Therapeutic Effect of TSG-6 Engineered iPSC-Derived MSCs on Experimental Periodokntitis in Rats:A Pilot Study[J].PloS one,2014,9(6):e100285.
[31]Liu Y,Goldberg AJ,Dennis JE,et al.One-step derivation of mesenchymal stem cell(MSC)-like cells from human pluripotent stem cells on a fibrillar collagen coating[J].PloS one,2012,7:e33225.
In vivo experiments of porous gradient bio-composites with HA/ZrO2in repair of the lumbar vertebra defect
SHAO Rong-xue1,QUAN Ren-fu2,ZHANG Liang2,XIE Shang-ju2,YANG Di-sheng3,WEI Xi-cheng4
(1.Zhejiang Chinese Medical University,Hangzhou 310053,China;2.Department of Orthopedics,Xiaoshan Traditional Chinese Medical Hospital,Hangzhou 311200,China;3.Department of Orthopedics,the Second Affiliated Hospital of Zhejiang University,Hangzhou 310000,China;4.College of Materials Science and Engineering,Shanghai University,Shanghai 200072,China)
ObjectiveTo evaluate the effect of porous gradient composites with hydroxyapatite(HA)/zirconia(ZrO2)in repair of lumbar vertebra body defects of dogs.Methods(1)New porous gradient HA/ZrO2bio-composites were prepared using Foam impregnation,gradient compound and high temperature sintering;(2)A total of 18 adult Beagledogs,weighted 10~13 kg and aged 5~8 months,were assigned randomly into two subgroups and were implanted with new porous gradient HA/ZrO2bio-composites(subgroup A in 12)and autologous iliac bone(subgroup B in 6);(3)The relative data was analyzed on roentgenoscopy,mophology and biomechanics of post-operation.The effect was compared between the subgroup A and the subgroup B to repair the vertebral body defect.ResultsThe porocity of new porous gradient HA/ZrO2bio-composites is 25 ppi(pores per inch),and the pores are well distributed with diameter of 100~300μm.The roentgenoscopy of post-operation displayed that new-bone formation is increased gradually,and the interface between bio-composite and host-bone becomes blur,and the new-bone around the bio-composite integrated into host-bone at 24 weeks of post-operation in subgroup A.As to subgroup B,the resorption and restructure were found at 6 weeks after the surgery,and the graft-bone and host-bone have integrated completely without obvious boundary at 24 weeks of postoperation.Histomorphology study showed that the amount of bone within pores of the scaffold material increased with a prolonged postoperative,and that partial bio-composite was degradated and replaced by new host-bone.There was no significant difference between the two subgroups(P>0.05)in the maximum compressive strengths of biomachanics test.ConclusionsNew porous gradient HA/ZrO2bio-composites can induce bone tissue to grow into the pores,and promote the repair of cancellous bone defect,which may be applied widely to the treatment of cancellous bone defect in the future.
Hydroxyapatites;Zirconia;Bone tissue engineering;Artificial vertebrae
R-332
A
1671-7856(2015)11-0046-06
10.3969.j.issn.1671-7856.2015.11.011
浙江省科技厅计划项目(2012C33114)。
邵荣学(1980-),男,博士生,研究方向:骨组织工程材料、脊柱关节疾病的诊治。Email:shaorongxue@163.com。
全仁夫(1969-),男,博士生导师,教授。Email:spinequan@yahoo.com。
﹞2015-10-13
