应用TALEN技术敲除gata4基因建立斑马鱼先天性心脏病模型
2015-05-11何嘉玲王天奇张长勇孙德明
刘 静,何嘉玲,暴 国,李 楠,王天奇,张长勇,孙德明
(1.北京协和医学院研究生院,北京 100730;2.国家卫生计生委科学技术研究所,北京 100081)
应用TALEN技术敲除gata4基因建立斑马鱼先天性心脏病模型
刘 静1,2,何嘉玲2,暴 国2,李 楠2,王天奇2,张长勇2,孙德明2
(1.北京协和医学院研究生院,北京 100730;2.国家卫生计生委科学技术研究所,北京 100081)
目的人工构建TALEN靶向敲除载体敲除gata4基因,建立斑马鱼先天性心脏病动物模型。方法
采用单元组装法构建靶向敲除gata4基因的载体,将其体外转录成TALEN mRNAs,通过显微注射的方式注入单细胞期受精卵中,胚胎检测TALEN的敲除效率,再通过剪尾、酶切、测序筛选发生基因突变的斑马鱼及突变的类型。结果 酶切、测序结果证实成功构建出正确的gata4靶向敲除载体,注入斑马鱼受精卵中,发生基因敲除的效率为35.18%,通过剪尾、PCR、酶切检测成功地筛选出了发生基因突变的斑马鱼,测序结果显示出不同种类的gata4基因突变。结论 成功构建gata4基因敲除的斑马鱼动物模型,为进一步研究人类gata4基因突变引起先天性心脏病的发病机制提供了良好的动物模型。
TALEN;gata4基因;斑马鱼;模型,动物;先天性心脏病
先天性心脏病(congenital heart disease,CHD)是由于胚胎发育过程中心脏、血管发育异常而导致心脏、血管在形态、结构、功能和代谢方面发生异常的一大类疾病,是人类极为普遍和具有破坏性的出生缺陷,发病率约占活产婴儿的0.8%[1],严重危害胎儿、新生儿、婴幼儿及儿童健康。目前认为该病的病因包括环境和遗传两个主要因素,约120种单基因被鉴定与先天性心脏病的发生有关。作为一种多因素疾病,其病因和发病机制尚未完全阐明。因此通过反向遗传学手段,建立先天性心脏病的基因敲除动物模型,探索该病的致病机制具有重要意义。斑马鱼的基因组与人类基因组相似度达87%,结构上具有与人类相似的心房、心室、心脏瓣膜结构以及心脏传导系统[2,3],且斑马鱼体积小、易于饲养、胚胎透明易于观察、体外受精、产卵能力强、有利于进行遗传操作,是构建先天性心脏病的理想动物模型。
基因敲除技术的传统方法是基于胚胎干细胞技术和同源重组技术,但是这种方法效率极低、过程繁琐,且对于像斑马鱼这种无法建立胚胎干细胞系的 物 种 无 法 实 施[4]。TALEN(transcription activator-like effector nuclease)技术是类转录激活因子效应物核酸酶介导的靶向修饰技术,通过组装蛋白模块识别靶序列,每两个氨基酸即可识别一个碱基,实现了对基因组的任意编辑,是先进的基因编辑技术。目前缺乏TALEN技术用于斑马鱼研究先天性心脏病的相关基因的功能。
锌指转录因子4(gata4)是gata转录因子家族的一员,具有与特定DNA结合的锌指结构域,在进化过程中高度保守,同时在心脏发育过程中起重要作用。研究表明,gata4与其他的转录因子一起调控心肌中一些特异基因的表达,对心肌细胞的形成以及心前细胞的迁移和分化、心瓣膜及间隔发育等具有重要作用。gata4基因突变会导致动物和人出现心脏发育异常,形态学上以瓣膜缺损为主要表现[5]。目前尚无较好的动物模型适用于机制研究,因此本研究采用TALEN技术对斑马鱼的gata4基因进行敲除,建立斑马鱼先天性心脏病动物模型,为先天性心脏病的遗传基础研究提供重要的动物模型。
1 材料
1.1 实验动物
本实验选取AB系野生型斑马鱼,为实验室常用的近交系品种[6]。
1.2 质粒
TALE基本单元模块载体质粒及pCS2-Fok I表达载体质粒:均为氨苄青霉素(Amp)抗性,而表达载体质粒需成对使用(pCS2-PEAS系列和 pCS2-PERR系列配对),由本实验室保存。质粒由北京大学生命科学院细胞增殖与分化实验室构建并馈赠[7]。
1.3 引物
实验过程中需要使用的引物见表1,包括扩增gata4基因和构建和检测TALEN载体时所需的引物。引物由北京诺塞基因组研究中心有限公司合成。
1.4 主要试剂
Takara限制性内切酶:Spe I、Nhe I、Hind III、Sac II、Hae II。
试剂盒:质粒小提试剂盒、普通琼脂糖凝胶DNA回收试剂盒、普通DNA产物纯化试剂盒、DNA连接试剂盒、T载体试剂盒、SP6 mMESSAGE mMACHINE Kit、2×Taq Master Mix(不含染料)、碱性磷酸酶(CIAP)、50 mM NaOH、1 M Tris-HCl(pH 8.0)、70%乙醇、超纯水(双蒸水,18 MΩ)
2 方法
2.1 斑马鱼饲养与繁殖
野生型斑马鱼饲养于自动水循环系统中,温度稳定在28.5±0.5℃,pH 7.2~7.5,每日固定光照时间14 h[8],喂食新鲜孵化的丰年虾。刚刚孵化的斑马鱼不需喂食,第5天后开始喂食草履虫,两周后开始喂食丰年虾,3个月左右可性成熟。繁殖时,交配前一晚放入配鱼缸内,雌鱼与雄鱼之间用挡板隔开;第二天早上,将中间的挡板抽出,可观察到追尾现象,大约30 min后可以开始收集斑马鱼受精卵。
2.2 TALEN敲除载体的构建
2.2.1 斑马鱼gata4基因的提取与靶点选择:采用简易DNA提取法提取斑马鱼鱼尾或胚胎的基因组DNA。过程如下:将鱼尾或胚胎(20条鱼尾或20个胚胎)吸到PCR管中,每管加入20 μL 50 mM NaOH溶液;使用PCR仪加热裂解,程序:95℃ 10 min,4℃10 min,取出后 vortex振荡均匀,重复一次;加入2 μL体积1M Tris(pH 8.0)混匀即为提取的基因组DNA。
斑马鱼gata4基因定位于第20号染色体上,结构基因由6个外显子和5个内含子组成。根据TALEN靶点选择的原则[7]和文献的报道[1,5],本研究针对gata4基因的第一外显子设计了一对靶点,如图1所示,提取鱼尾DNA后测序确认靶点的唯一性。测序均由北京诺塞基因组研究中心有限公司完成。

表1 实验过程中需要使用的引物Tab.1 Primers used in this experiment
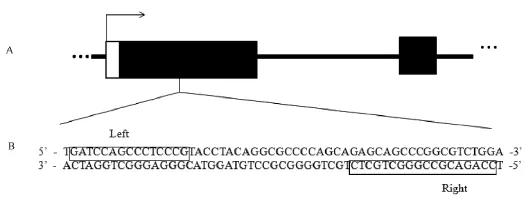
图1 基因敲除靶点图Note.A.Genomic organization of gata4 gene;B.The sequences for our designed TALENs;Left:Left binding sequence;Right:Right binding sequence.Fig.1 The recognition sequences of the target genes
2.2.2 TALEN表达载体的构建:根据设计的靶点,按照“单元组装法”构建TALEN质粒[7]。将TALE基本单元模块载体质粒转化至感受态细胞TOP菌种中;大量摇活含有质粒的大肠杆菌后,采用天根的质粒小提试剂盒提取质粒;将质粒经酶切后(Spe I、Nhe I、Hind III)进行回收、转化、连接反应,通过菌液PCR筛选出连接成功的质粒后,进入下一轮反应;经过几轮酶切、切胶回收及连接反应,直至完成所需要的两侧半位点的TALE重复序列,其中每轮的连接后都需要进行测序确认;再将TALE重复序列与pCS2载体连接,构建出最终的pCS2-TALEN表达载体质粒,酶切检测片段连接情况后,采用SP6测序确认。
2.2.3 TALENs质粒体外转录:先用Sac II将获得的TALENs质粒线性化,电泳确定线性化完全后,采用快速DNA回收试剂盒直接回收线性化DNA;采用SP6体外转录试剂盒进行TALENs体外转录反应;将体外转录后得到的mRNA采用氯化锂沉淀的方式回收,利用NanoDrop检测mRNA浓度和质量,冻于-80℃备用。
2.3 构建斑马鱼先天性心脏病动物模型
2.3.1 TALEN体内活性检测:注射前,按照200 pg/nL、300 pg/nL、400 pg/nL的不同浓度将左、右半位点的一对mRNA混合,加入酚红指示剂和双蒸水配制成4 μL体系后注入斑马鱼单细胞受精卵中[8];不同浓度mRNAs作为实验组,每个浓度注射100枚胚胎,同时将含有相同浓度的酚红指示剂和双蒸水配制成的4 μL体系作为对照组,将未注射的胚胎作为空白组,对照组和空白组各20枚胚胎,得到F0胚胎;24 h后显微镜下取出表型正常的胚胎,5个胚胎为一组,共取8组胚胎,总共40个胚胎,提取其基因组DNA。以G4-F和G4-R引物扩增胚胎gata4基因,并使用Hae II酶切检测PCR产物。如果未注射胚胎的PCR产物能够全部被切开,注射胚胎的PCR产物中有完整的、未切开的PCR条带,则说明靶点可能发生了突变。将未切开的条带回收,连入T载体,测序鉴定靶点的突变情况。未切开条带占所有条带的荧光亮度的百分比可大致反映TALEN的突变效率。
2.3.2 斑马鱼TALEN突变体筛选:将注射后的斑马鱼饲养至3个月后,逐条进行剪尾检测突变情况,酶切、测序分析其发生敲除的基因型的变化。
3 结果与分析
3.1 gata4基因扩增与敲除靶点比对
以提取的斑马鱼鱼尾DNA为模板,G4-F和G4-R为引物,PCR法扩增gata4基因后,进行1.2%琼脂糖凝胶电泳,结果如图2(A)所示,b和c泳道中可见扩增出明亮且较特异的条带,分子量约为550 bp,为扩增出的gata4基因。图中稍微存在一点非特异性条带,在后续的测序中可以通过回收去除非特异性条带。将PCR产物送测序,结果如图2(B)所示,从测序图上可以看出,测序底峰低,说明样品条带单一、结果真实可信;再将此测序结果与网站上的gata4参考序列进行比对分析,结果如图2(C)所示,黑色方框内显示的是设计敲除靶点的左、右半位点,敲除靶点单一且不存在SNP位点,符合敲除靶点的要求。
3.2 TALEN载体构建与鉴定
根据设计的靶点,需要构建出两个TALEN表达载体。先要分别构建出识别左、右半位点的TALE重复序列载体,再与pCS2载体连接,形成最终的表达载体。TALE重复序列载体需要通过菌液PCR鉴定和测序确认。菌液PCR采用M13-47、RV-M引物。左半位点的TALE重复序列为16单元体,产物分子量约为1800 bp,右半位点的TALE重复序列为18单元体,产物分子量约为2000 bp,见图3(A)。测序结果显示载体 TALE重复序列连接正确。TALEN终表达载体需要通过菌液PCR和酶切检测TALE重复序列的连入情况。菌液PCR的上游引物:左半位点为C-For,右半位点为T-For,下游引物为63 dn,进行菌液PCR后观察条带扩增情况。连接方向正确能扩增出条带,否则无法扩增出条带。电泳结果如图3(C)所示,1和2为左半位点连接正确的菌落,扩增出四个条带;3、4、7为右半位点连接正确的菌落,扩增出两个条带。酶切(Nhe I、Kpn I)检测结果如图3(B)所示,酶切产物为2 kb、5 kb两条带,说明TALE重复序列连接正确。测序结果显示左、右半位点的TALEN终表达载体构建完成。
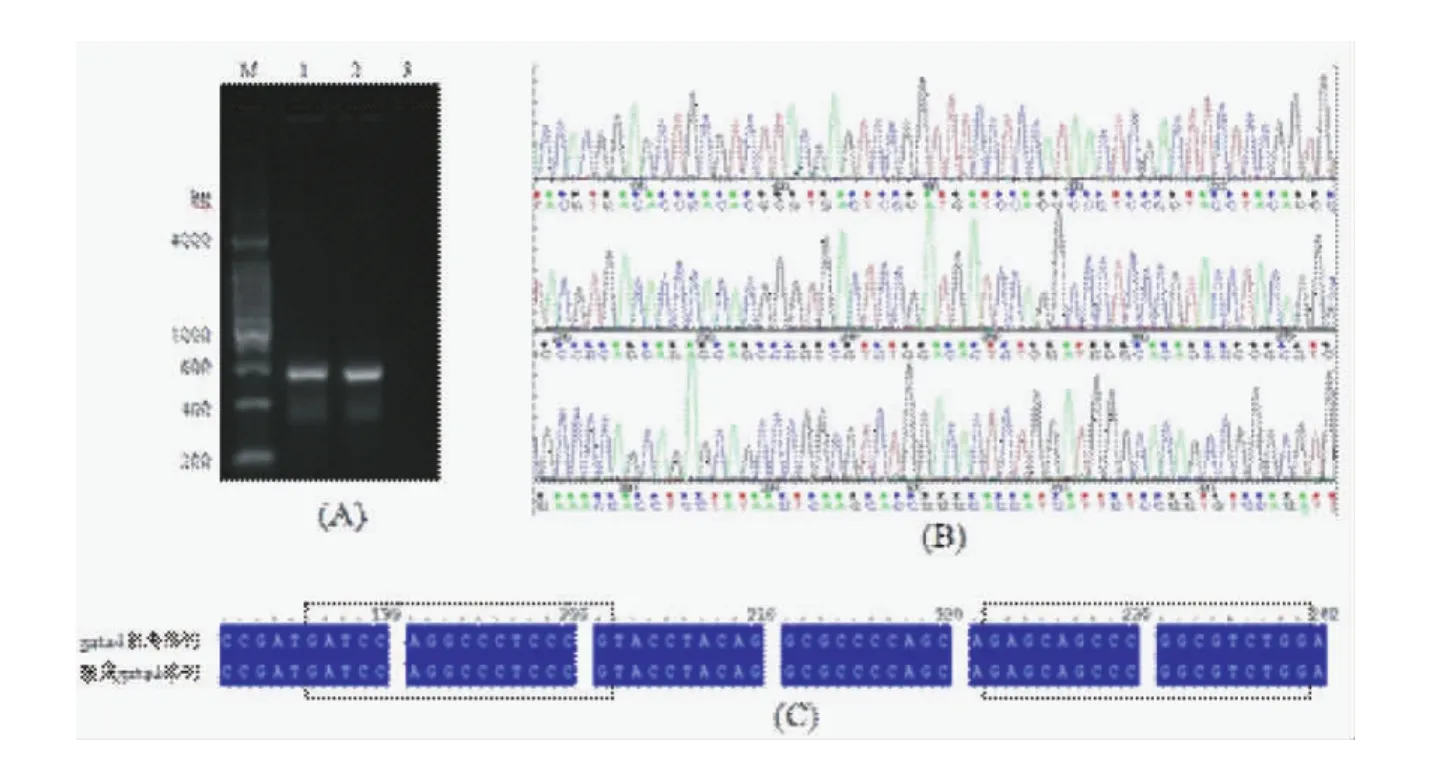
图2 靶点确认与比对图Note.(A)The PCR-amplified gata4;M:DNA marker,1-2:PCR amplification products;3:Control(B)gata4 sequenced diagram;(C).The PCR amplification products compared with reference sequencesFig.2 Confirmation and comparison of the target genes
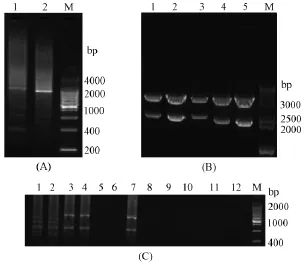
图3 TALE重复片段及终载体鉴定图Note.(A)Identification of TALEs by colony PCR;1:Right binding site;2:Left binding site;(B)Identification of TALENs by restriction enzyme;1-5:The constructed TALEN vectors;M:DNA marker;(C)Identification of the TALEN vectors constructed by colony PCR;1-4,7:Positive results;5,6,8-12:Negative results;M:DNA markerFig.3 Identification of TALEs and TALENs
3.3 构建斑马鱼先天性心脏病动物模型
3.3.1 TALEN体内活性检测:酶切检测TALEN突变效率的结果如图4所示,对照组胚胎的PCR产物能够完全被切开,产生两条带;2为mRNAs注射剂量为200 pg/nL组,PCR产物能完全被切开产生两条带;4、5为mRNAs注射剂量为300 pg/nL、400 pg/nL组,存在分子量与gata4基因PCR扩增片段大小相似的未切开条带,说明靶点可能发生了突变。通过软件分析电泳条带的灰度可以大致反映TALEN的突变效率,结果如表2。从表中结果可以看出,TALEN的敲除效率随着注射mRNAs的浓度升高而增加。

表2 不同TALEN mRNA注射浓度酶切检测的效率Tab.2 The efficiency of TALENs by different injection concentrations
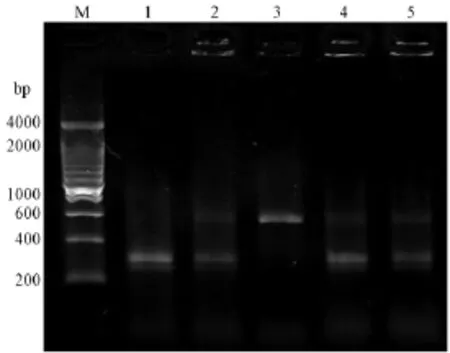
图4 酶切检测PCR产物电泳图Note.M:DNA marker;1:Control;2,4,5:Injection groups;3:PCR productsFig.4 Identification of PCR products by enzyme digestion
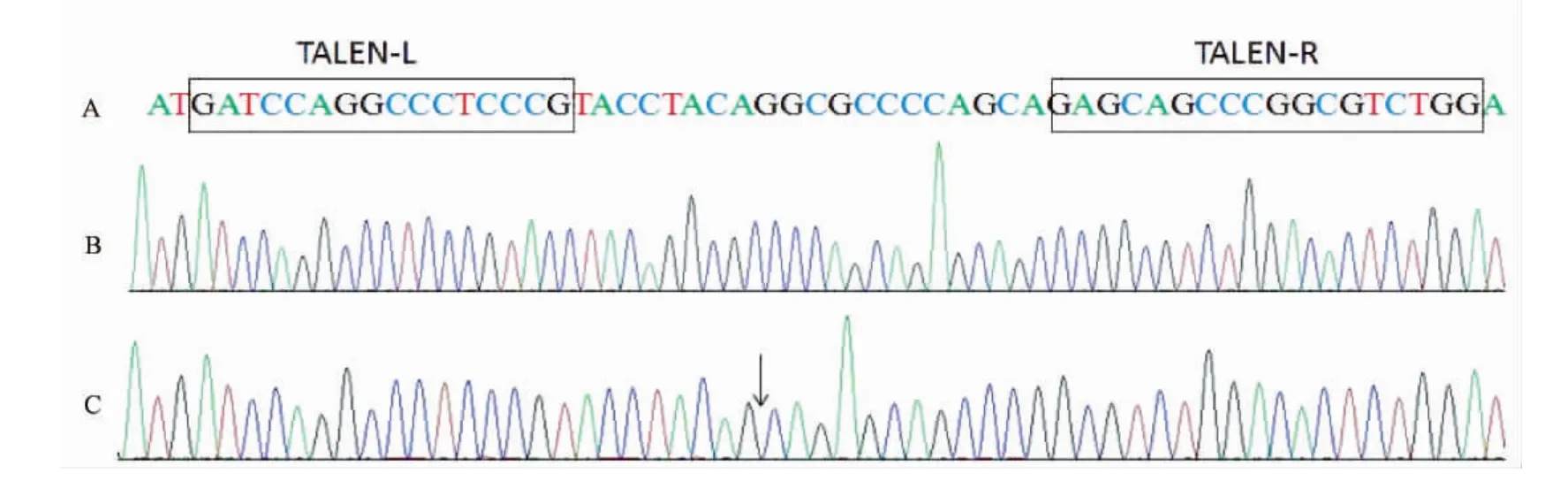
图5 TALEN体内活性检测Note.A.Our designed TALEN sequences;B.The sequenced diagram of wild-type(WT);C.The sequenced diagram of 8 bp deletionFig.5 Identification of the in vivo activity of TALENs
将未切开条带回收,连入T载体,测序检测靶点突变情况。测序结果如图5所示,A为本实验中设计的敲除靶点,B为野生型gata4基因测序图,C为注射mRNAs后两个靶点之间基因敲除8 bp的测序图,图中黑色箭头指示的是发生基因突变的位点。通过与野生型测序图比较可以看出TALEN对靶点的基因修饰情况。
3.3.2 斑马鱼 TALEN突变体筛选:斑马鱼TALEN突变体筛选采用酶切法。总共剪取F0斑马鱼成鱼尾鳍54条,提取基因组DNA进行酶切检测,结果显示其中有19条斑马鱼发生了基因敲除,敲除效率约为 35.18%。图 6为酶切检测gata4基因的电泳图,图中只显示出了部分斑马鱼的酶切结果。将酶切检测中的未切开条带回收,连入T载体,测序分析发生敲除斑马鱼的基因型变化,测序结果见图7。
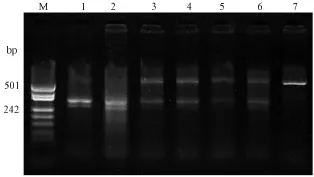
图6 酶切检测成鱼中gata4位点的基因型Note.M:DNA marker;1:Control;2-6:The different DNA by enzyme digestion;7:The undigested PCR productsFig.6 Identification of different genotypes of gata4 loci in the adult zebrafish by enzyme digestion

图7 gata4基因敲除斑马鱼测序结果Fig.7 The sequencing results of gata4 knockout zebrafish
4 讨论
类转录激活因子效应物核酸酶(TALEN)介导的靶向修饰技术是目前广泛使用的基因敲除技术,其已经成功应用于斑马鱼[9]、大鼠[10]、猪[11]等多个物种的研究中。转录激活子样效应因子(TALE)最初是在植物致病菌黄单胞杆菌属(Xanthomonas)中发现的,其本质是一个转录调控因子,主要有两个重要的结构域:特异性识别核酸的靶点识别域和切断DNA序列的核酸酶功能结构域。[12-14]。TAL蛋白的核酸结合域的氨基酸序列能够特异性地识别和结合靶位点的核酸序列,利用TAL的序列模块,组装成特异结合任意DNA序列的模块化蛋白,通过与核酸酶Fok I连接,构建针对任意特定核酸靶序列的重组核酸酶TALEN,达到在任意位点打断DNA的目的。TALEN中Fok I核酸内切酶形成二聚体时才发挥活性,对双链DNA进行切割[15]。细胞DNA损伤后会启动两种修复机制过程,其中一种是非同源末端连接修复机制(non-homologous end joining,NHEJ),另一种是同源重组修复机制(homologydirected repair,HDR)[16]。当没有外源的同源序列加入,细胞就会启动NHEJ修复机制,往往就会引起突变,从而达到基因敲除的目的。本研究中将TALEN mRNAs注射到斑马鱼受精卵中后,细胞就采用NHEJ方式修复损伤的DNA,这种修复是随机的,所以要对斑马鱼的突变进行筛选。通过分子克隆途径人工构建TALE重复序列的方法主要包括四类:基于Goldern Gate(GG)克隆的方法、基于连续克隆组装的方法、基于固相合成的高通量方法、基于长末端的LIC组装方法等[17]。本研究中构建敲除载体采用的是单元组装法,是北京大学细胞增殖与分化教育部重点实验室建立的一种合成TALE重复单元的方法[9],这种方法简单、技术难度低、精确度高、保真性好、成本较低、便于操作。但是,与最新的CRISPER/Cas9技术相比,构建载体的过程繁琐、费时、费力。今后构建其他基因敲除动物模型时,可以考虑使用CRISPER/Cas9技术。
有研究表明,先天性心脏病的发生与gata4基因突变有关[18]。目前尚无较好的动物模型用于先天性心脏病的机制研究。相比于其他动物,斑马鱼有着独特的优势:斑马鱼发育早期可以不完全依赖于有功能的心血管系统,甚至在最为严重的心血管系统缺失情况下,仍能通过对氧的被动运输能短时间存活[19],这一特点为研究者获得发育早期胚胎突变体,观察心脏发育相关基因缺陷型胚胎,研究心血管发育严重缺陷的活体提供可能;斑马鱼胚胎透明,可以动态地观察到整个心脏发育过程及血液循环情况,使得斑马鱼成为先天性心脏病研究的理想动物模型。
本研究发现,基因敲除的效率随着 TALEN mRNAs的注射浓度的增加而升高。当 TALEN mRNAs的注射浓度为200 pg/nL时,胚胎基因组电泳图中并没有发现明显的未切开条带,推测原因可能是mRNAs的浓度太低,细胞内存在大量降解外源mRNA的核酸酶,注射的TALEN mRNAs进入细胞后还没有来得及发挥识别、切断基因组DNA的作用就被细胞内的RNA核酶降解了;当注射浓度为300 pg/nL时,胚胎基因组鉴定发现明显的未切开条带并对其进行测序分析后,证实了TALEN mRNAs确实发挥了作用,改变了gata4基因的序列,发生基因敲除的效率为32.65%;当注射浓度为400 pg/nL时,24 dpf后发现注射后的胚胎大部分死亡,少数存活的胚胎出现发育畸形、甚至不能脱膜孵化成幼鱼,孵化率较低,推测原因可能是注射mRNAs的浓度越高,发挥敲除作用的效率越高,对细胞的毒性就越高,使胚胎无法存活。所以在注射时应该提高TALEN突变效率的同时兼顾胚胎的存活率。筛选斑马鱼TALEN突变体时,总共剪取54条注射过的斑马鱼,其中 gata4基因发生改变的斑马鱼有19条,敲除效率为 35.18%,这与注射后胚胎检测TALEN的效率大致相同。对发生基因敲除的斑马鱼gata4基因进行测序分析,发现TALEN敲除后产生了不同的基因型,说明细胞DNA损伤后采用的是随机的NHEJ修复,这符合文献中的报道[16]。胚胎及鱼尾基因组 PCR、酶切、测序分析均证明了TALEN在斑马鱼体内发挥了作用,实现了对斑马鱼gata4基因结构的改变。这说明本研究中针对gata4基因第一外显子构建的TALEN敲除载体是可行的且构建出了gata4基因敲除的斑马鱼动物模型。本研究只是初步构建出了针对gata4基因第一外显子的靶向敲除载体,并确认了其在体内的活性及造成的基因敲除效果,并筛选出了19条含有突变的斑马鱼,但是还需要大量的外交、内交来筛选含有靶点突变的纯合子斑马鱼、对不同突变基因型的斑马鱼进行表型分析、gata4基因标志物检测、病理切片检查等。本研究中构建出的gata4基因敲除斑马鱼模型可以用于先天性心脏病的发病机制研究、进一步为疾病的治疗奠定基础。
[1]Pierpont ME,Craig T,Basson D,et al.Genetic basis for congenitalheartdefects:Currentknowledge.A scientific statement from the American HeartAssociation Congenital Cardiac Defects Committee,Council on Cardiovascular Disease in the Young:Endorsed by the American Academy of Pediatrics[J].Circulation,2007,115(23):3015-3038.
[2]Beis D,Bartman T,Jin SW,et al.Genetic and cellular analyses of zebrafish atrioventricular cushion and valve development[J].Development.2005,132(18):4193-4204.
[3]Chi NC,Shaw RM,Junqblut B,et al.Genetic and physiologic dissection of the vertebrate cardiac conduction system[J].Plos Biol,2008,6(5):1006-1019.
[4]Pierpont ME,Basson CT,Benson DW,et al.Genetic basis for congenital heart defects:current knowledge[J].Pediatrics,2007.120(2):447.
[5]Sarkozy A,Conti E,Neri C,et al.Spectrum of atrial septal defects associated with mutations of NKX2.5 and GATA4 transcription factors[J].J Med Genet,2005,42(2):16.
[6]孙德明,王天奇,朱晓红,等.实验用鱼遗传控制及标准化[J].遗传,2012,34(9):1202-1207.
[7]沈延,黄鹏,张博.TALEN构建与斑马鱼基因组定点突变的实验方法与流程[J].遗传,2013,3(54):553-544.
[8]杨红波,梁巍,刘新星,等.应用双荧光报告系统检测斑马鱼microRNA的动态表达[J].遗传,2012,34(9):1181 -1192.
[9]Huang P,Xiao A,Zhou MG,et al.Heritable gene targeting in zebrafish using customized TALENs[J].Nat Biotechnol,2011,29(8):699-700.
[10]Tesson L,Usal C,Ménoret S,et al.Knockout rats generated by embryo microinjection of TALENs[J].Nat Biotechnol,2011,29(8):695-696.
[11]Xin JG,Yang HQ,Fan NN,et al.Highly efficient generation of GGTA1 biallelic knockout inbred mini-pigs with TALENs[J].PloS ONE,2013,8(12):e84250.
[12]Kay S,Hahn S,Marois E,et al.A bacterial effector acts as a plant transcription factor and induces a cell size regulator[J].Science,2007,318(5850):648-651.
[13]Romer P,Hahn S,Jordan T,et al.Plant pathogen recognition mediated by promoter activation of the pepper Bs3 resistance gene[J].Science,2007,318(5850):645-648.
[14]Kay S,Bonas U.How Xanthomonas type III effectors manipulate the host plant[J].Curr Opin Microbiol,2009,12(1):37 -43.
[15]肖安,胡莹莹,王唯晔,等.人工锌指核酸酶介导的基因组定点修饰技术[J].遗传,2011,33(7):665-683.
[16]Urnov FD,Rebar EJ,Holmes MC,et al.Genome editing with engineered zinc finger nucleases[J].Nat Rev Genet,2010,11(19):636-646.
[17]沈延,肖安,黄鹏,等.类转录激活因子效应物核酸酶(TALEN)介导的基因组定点修饰技术[J].遗传,2013,35(4):395-407.
[18]陈恒余,邓青春,李梦婷,等.先天性心脏病与GATA4基因的关系[J].中国优生与遗传杂志,2013,21(6):6-8.
[19]Stainier DY.Zebrafish genetics and vertebrate heart formation[J].Nat Rev Genet,2001,2(1):39-48.
Knockout gata4 gene and establish ment of a zebrafish model of congenital heart disease by TALEN
LIU Jing1,2,HE Jia-ling2,BAO Guo2,LI Nan2,WANG Tian-qi2,ZHANG Chang-yong2,SUN De-ming2
(1.Graduate School of Peking Union Medical College,Beijing 100730,China;2.National Research Institute for Family Planning,Beijing 100081,China)
Objective To establish a gata4 gene knockout zebrafish model of congenital heart disease,and construct transcription activator-like effector nuclease(TALEN)vectors targeting gata4 gene.Method We construct TALEN vectors targeting zabrafish gata4 gene using unit assembly method and the in vitro-transcribed TALEN mRNAs were microinjected into one-cell stage zebrafish embryos.The efficiency of TALEN was identified by injected embryos,and mutations of zebrafish were screened and confirmed the different types through PCR and enzyme digestion.Results We successfully constructed correct targeting vectors by enzyme digestion and sequencing,and the gene knockout efficiency was 35.18%.We screened the mutant zebrafish and confirmed different types of gata4 gene mutations.Conclusions A gata4 knockout zebrafish model is successfully established,it can provide a good animal model for further research of congenital heart diseases.
TALEN;gata4 gene;Zebrafish;Model,animal;Congenital heart disease
孙德明(1958-),男,研究员,博士,研究方向:比较生殖医学。Email:sundemingnet@163.com。
R33
A
1671-7856(2015)04-0001-07
10.3969.j.issn.1671.7856.2015.004.001
中央级公益性科研院所基本科研业务专项资金项目-优秀青年科技人才创业基金项目(编号:2012GJSSJKC02);国家十二五科技支撑计划计划生育技术安全性评价标准化实验动物培育关键性共享技术研究项目(编号:2012BA131B06)。
刘静(1988-),女,硕士研究生,研究方向:动物学。Email:864913436@qq.com。
2015-02-15
