SD大鼠标本血量不足对凝血四项检测结果的影响
2015-05-11翟青新黄爱军钱丽萍
翟青新,黄爱军,钱丽萍
(1.南京大学医学院附属鼓楼医院动物实验中心,南京 210008;2.南京大学医学院附属鼓楼医院医学检验科,南京 210008)
SD大鼠标本血量不足对凝血四项检测结果的影响
翟青新1,黄爱军2,钱丽萍1
(1.南京大学医学院附属鼓楼医院动物实验中心,南京 210008;2.南京大学医学院附属鼓楼医院医学检验科,南京 210008)
目的 探讨大鼠的最佳抗凝比,分析标本血量不足对凝血四项检测结果的影响。方法 60只大鼠分成2组,按真空采血法采集空腹12 h腹主动脉血液。第一组20只,用于全血细胞测定。全自动血液细胞计数仪检测红细胞压积(hematocrit,HCT),血小板计数(platelet,PLT)。第二组40只,每只鼠采2管血,按抗凝比[枸橼酸钠抗凝剂与全血的比例(V∶V)]分成1∶9(对照组)及1∶5(实验组),1∶8(实验组)及1∶7(实验组),离心获乏血小板血浆。全自动血凝分析仪检测凝血四项:凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplatin time,APTT)、凝血酶时间(thrombin time,TT)、纤维蛋白原(Fibrinogen,FIB)。结果 SD大鼠HCT(%)为41.7±2.9,PLT(×109/L)为1114±173。随着抗凝比的增大,PT、APTT、TT延长,FIB减小。与对照组相比:1∶8实验组,差异无统计学意义。1∶7实验组,除TT差异有统计学意义外,另3项指标差异无统计学意义。1∶5实验组,差异有统计学意义。结论 凝血四项的结果受抗凝比的影响。1∶9是大鼠最佳抗凝比,1∶8尚可。大鼠有其独特的生理特性。为大鼠的相关研究提供了基础的科学数据和基本的理论依据。
大鼠;凝血四项;红细胞压积;血小板计数
正常的止血机制有赖于血管壁内皮细胞、血小板、凝血系统、抗凝系统、纤维蛋白溶解系统、以及血液流变学等结构与功能的完整性以及它们之间的生理性调节与平衡[1]。据国家卫生和计划生育委员会卫医发[2000]412号文件《出血时间、凝血时间检验方法操作规程的通知》,动物实验中凝血四项的检测逐步兴起。该检测主要用于动物外科术前凝血功能的检查、肝病动物模型肝功能的判断以及中药对凝血功能的影响。血液离体即开始变化,凝血因子的消耗或激活会导致检测结果的异常,故对标本要求特殊、严格,只有合格标本的检测结果方有意义。特别强调:人血的抗凝比必须为1∶9,抗凝比的改变直接影响检测结果的准确性和可靠性[2-4]。
大鼠实验经常依靠处死前的唯一一次大量采血,实际科研工作中,经常由于采血困难,遇到抗凝比大于1∶9的标本。故本文主要针对标本血量不足对凝血四项的影响进行研究。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠,体重300~320 g,60只,来源于上海杰思捷实验动物有限公司【SCXK(沪)2013-0006】。饲养和实验在南京大学医学院附属鼓楼医院动物实验中心屏障环境内进行【SYXK(苏)2014-0052】。并按实验动物使用的3R原则给予人道的关怀。
1.2 主要器械和耗材
大鼠固定板(含橡皮筋),解剖剪,血管钳等常规手术器械,砂轮,棉签、棉球、纱布、2 mL注射器少许。碧迪(BD)医疗器械有限公司产品:一次性使用真空采血针组件(规格:0.8×20 mm×180 mm);一次性使用真空静脉血样采集容器(以下简称“紫头管”),规格型号:K2EDTA,2 mL;一次性使用人体静脉血样采集容器(以下简称“浅蓝头管”),规格型号:枸橼酸钠管,2.7 mL。
1.3 主要仪器和试剂
电子天平(精确到1 g,上海天平仪器厂),XS-800i全自动血液分析仪(日本Sysmex公司),离心机(52A型医用低速离心机,河北省安新县白洋离心机厂制造),CA-7000全自动血凝分析仪(日本Sysmex公司),试剂、校准物和质控品及一次性反应杯等均为该仪器原装进口配套产品。
1.4 方法
60只大鼠随机分成2组:第一组20只,采血测HCT、PLT。第二组40只,采血测凝血四项。适应性饲养1周后,禁食12 h,自由饮水。称重,10%水合氯醛腹腔注射麻醉(0.3 mL/100 g体重),仰卧固定,开腹,真空采血法用采血针组件和相应的采血管从腹主动脉采血。
第一组,紫头管采血后立即轻轻颠倒180°露底混匀8~10次,使血液与抗凝剂充分混匀,动作要及时、轻柔、到位。头盖向上在室温下放置。淘汰有血凝块的标本。测定HCT,PLT,2 h内检测完毕。第二组,梯度标记60个浅蓝头管:因管内有0.3 mL液态枸橼酸钠抗凝剂,从抗凝剂液面到刻度线为2.7 mL(抗凝比为1∶9),故在管外壁用Mark笔标出相应刻度,使抗凝比为1∶5、1∶7、1∶8。每只大鼠取2个梯度抗凝比的血液,采集方法同上。3000 r/min[5]离心15 min,目测各管血细胞比容(HCT),淘汰重度溶血标本。分离血浆,务必去除血小板。测定合格标本的凝血四项,2 h内检测完毕。
1.5 统计学方法
2 结果
2.1 第一组,顺利采样并检测
HCT(%)、(PLT×109/L)的检测结果分别为41.7 ±2.9和1114±173。
2.2 第二组,顺利采样并检测
凝血四项的检测结果见表1。
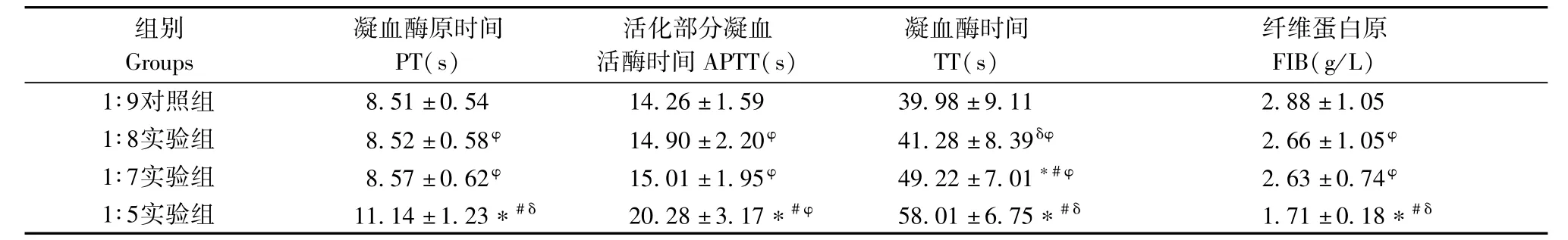
表1 SD大鼠不同抗凝比例血浆凝血四项测定值(n=20)Tab.1 Values of coagulation test of diffent anticoagulant ratio plasmas(n=20)
2.3 SD大鼠HCT、PLT及凝血四项测定值与人类比较[6]
与人类相似的是:Hct分别为41.7%和38.0~50.8%。高于人类的是:PLT分别为1114×109/L和100~300×109/L。TT分别为39s和13~21s。
3 讨论
动物实验常需要通过血液标本获得数据。《礼记》载“君子慎始,差若毫厘,谬以千里”,要想得到“真值”,必须对所有影响因素要有系统全面的认识,树立全过程质量控制理念,动物自身因素有来源、品种、品系、日龄、性别、微生物等级和饲养环境;人为因素有血液采集方法[应激和麻醉剂、采血部位、采血时间、血液体积、抗凝剂]、贮存方法、测定方法和所采用的仪器和试剂。检验分析前质量控制是广大动物实验科研人员最容易忽略的环节之一。
在用检测人类的仪器检测动物前,有必要先咨询仪器工程师[7],了解仪器项目设定的线性范围并加以调整,确保标本数据完整。沟通好检测事宜,合理安排实验。采集血液后及时送检和检测。
仔细阅读所有耗材说明书,掌握真空采血原理、注意事项且熟练步骤[8]。真空采血管不同品牌品质不一,对分析结果有一定干扰[9-10]。浅蓝头管保质期只有8个月,不用过期管,防止管内霉变,防止真空泄漏。
因血液黏稠度或血脂高[11],血液容易凝集,故大鼠应空腹,且通过麻醉使其平静。尽管全血细胞检测不需要空腹,但动物实验往往一次采血进行多个项目的检测,而大多数项目都需要空腹,故本实验取空腹血测HCT和PLT[12],更接近科研实际。
人血凝血四项检测抗凝比必须为1∶9的原因如下:抗凝剂与血的比例是基于“HCT(%)为(45± 5)%,即血浆为(55±5)%”这一基础,实质是“抗凝剂与血浆的比例为1∶5(抗凝剂0.3 mL,血浆1.5 mL)”。HCT(%)小于20或大于50时(低于或超出正常范围时),应按照下面公式调整抗凝剂用量:抗凝剂用量(mL)=0.00185×全血量(mL)×[100-HCT(%)]。抗凝剂浓度推荐为109 mmol/L,以保证抗凝剂在血浆中的绝对含量不变,血浆中各凝血因子的量越接近于动物生理值,凝血试验结果就越能反映各凝血因子质与量的真实水平[4]。故本实验测了HCT,以推断大鼠血的最佳抗凝比。
除抗凝比外,此检测分析前质控主要包括:防止凝块(特别是肉眼不可见的微小凝块)、原始标本(未离心)室温放置时间不超过2 h、血浆标本4℃冰箱放置时间不超过4 h、无重度溶血。这些因素对结果的影响,各文献报道略有不同[13-15],大致可以解释如下:凝块消耗凝血因子,使PT、APTT、TT延长、FIB降低;CA-7000凝血仪具有强大的抗干扰能力,血浆内Hb≤4.8 g/L时,溶血对PT、APTT没有影响,但对TT有影响[16]。冷藏或低温保存(原始标本)会损伤血小板,活化部分凝血因子Ⅶ、Ⅺ,使PT、APTT缩短,故原始标本需在室温下运送,但易变凝血因子Ⅷ及V因子对热不稳定,若室温下放置超过2 h,随着温度升高和放置时间延长凝血因子活性逐渐丧失,使PT、APTT延长,TT缩短。故在做科研之前,有必要了解这些影响因素,统一操作,使数据统计更有意义。
本实验考虑到采血的可操作性,采集研究的是大鼠动脉血。静脉血或许有不同,但不影响科研与临床实际。从分析前质控角度,研究了大鼠的HCT、PLT及凝血四项,把实验动物的基础数据研究提高了一个层次。为给对人类血液数据耳熟能详的临床医生及广大医务科技工作者提供生动参考,把大鼠数据与人类进行了简单的比较。初步得出:大鼠PLT比人高很多,值得进一步探讨。大鼠HCT在(45±5)%且接近下限,理论上抗凝比1∶9也是最佳比例。TT比人高很多,与已报道的文献[17-18]结论一致。
综上所述,1∶9是大鼠凝血四项最佳抗凝比。凝血四项的结果受抗凝比的影响。当标本抗凝比介于1∶8与1∶9之间时,可以用于凝血检测,谨给科研及兽医临床实际提供参考。
[1] 丛玉隆.实用检验医学(第1版)[M].北京:人民卫生出版社,2009:78-81.
[2] 李素珍,秦望森,陈风英.不同抗凝比血浆凝血试验结果在临床上的应用[J].中国卫生检验杂志,2005,15(1):103 -106.
[3] 王秀明,李志武,孙冀兵,等.不同抗凝比例对凝血四项检测结果的影响研究[J].河北医药,2012,34,(20):3161 -3162.
[4] 徐菡,邸平,夏全成,等.标本血量不足对凝血酶原时间及活化部分凝血活酶时间检测结果的影响[J].检验医学与临床,2014,11(16):2201-2202.
[5] 刘志锋,张耀辉,李雯丽.标本离心时间对凝血四项检测结果的影响[J].检验医学与临床,2013,10(12):1547-1548.
[6] 刘江伟,张永久,李泽信,等.长白仔猪血常规及生化指标正常值探讨[J].中国比较医学杂志,2007,17(7):393-394,376.
[7] 陈渊博,郑文婷,尹志军,等.CA7000全自动凝血仪性能验证[J].国际检验医学杂志,2013,34(2):209-211.
[8] 叶应妩,王毓三,申子瑜.全国临床检验操作规程(第3版)[M].南京:东南大学出版社,2006:121-122.
[9] 钟德优,范月珍,黄丽芳,等.真空采血管添加剂质量控制及其临床应用影响因素[J].国际检验医学杂志,2014,35(7):881-883.
[10] 沈伟,杨炼,罗德幸.凝血真空采血管及标本放置温度时间对凝血检验的影响[J].中国实验诊断学,2013,17(8):1448 -1450.
[11] 王秋菊,肖辉建,吴双,等.探讨重度脂血高速离心后对凝血四项的影响[J].血栓与止血学,2014,(20)6:336-338.
[12] 陈君,马海燕,齐寰宇.影响血常规检验结果的相关因素分析[J].国际检验医学杂志,2014,35(19):3652-3653.
[13] 宋月华.分析前质量控制在凝血项目测定中的应用价值[J].国际检验医学杂志,2014,35(11):1505-1507.
[14] 陈国,梁荣伟.对比试验分析凝血四项检测的影响因素[J].国际检验医学杂志,2012,33(19):2369-2370.
[15] 戴庆忠,覃瑜.影响凝血四项检测的因素分析[J].国际检验医学杂志,2013,34(17):2349-2350.
[16] 北京协和医院.北京协和医院医疗诊疗常规检验科诊疗常规(第2版)[M].北京:人民卫生出版社,2006:289-297.
[17] 王迎,闫峰,邓帅,等.SD大鼠、Wistar大鼠、ICR小鼠及长爪沙鼠的部分凝血因子凝集时间的测定[J].实验动物科学,2007,24(5):1-3,42.
[18] 孙劲,徐元宏.SD大鼠常见血液学检测指标参考范围的建立[J].临床输血与检验,2008,10(3):253-255.
Influence of insufficient blood specimens volume on the detection results of coagulation tests in SD rats
ZHAIQing-xin1,HUANG Ai-jun2,QIAN Li-ping1
(1.Center of Animal Experiments,Nanjing Drum Tower Hospital,The Affiliated Hospital of Nanjing University Medicine School,Nanjing 210008,China;2.Department of Clinical Laboratory,Nanjing Drum Tower Hospital,The Affiliated Hospital of Nanjing University Medicine School,Nanjing 210008,China)
Objective To explore the best anticoagulant ratio in SD rats.To analyse the influence of insufficient blood specimens volume on coagulation tests.M ethods 60 rats were divided into 2 groups.According to themethod of vacuum blood,collect abdominal aortic blood after fasting12 hours.The firstgroup 20 ratswere used only for routine blood test.Fully automatic hematology analyzer detected hematocrit and platelet.The second group 40 rats were used for coagulation test.Every rat was collected 2 blood specimens with different anticoagulant ratio[the proportion of sodium citrate anticoagulation and thewhole blood(vlume∶volume)]1∶9(the control group)and 1∶5(the experimental group),1∶8(the experimental group)and 1∶7(the experimental group).Get plasma without platelet through centrifugation.Fully automatic blood coagulation analyzer detected prothrombin time,activated partial thromboplatin time,thrombin time and Fibrinogen.Results HCT(%)and PLT(x 109/L)in SD rats were respectively 41.7±2.9 and 1114±173.Asanticoagulant ratio was increased,PT,APTT and TT were extended and FIB was decreased.Compared with the control group,these PT,APTT,TT,FIB four results of 1∶8 group were not statistically different,of 1∶5 group were statistically different,these PT,APTT,FIB three results of 1∶7 group were not statistically different,TT of 1∶7 group was statistically different.Conclusions The detection of coagulation project coagulation test results were affected by the proportion of anticoagulant and blood.1∶9 was the best anticoagulant ratio in SD rats,1∶8 can also.Rat had its unique physiological characteristics.The results could provide reference for the evaluation of rats.
Rat;Coagulation test;Hematocrit;Platelet
R-332
A
1671-7856(2015﹞10-0042-04
10.3969.j.issn.1671.7856.2015.010.010
翟青新(1973-),女,硕士,高级兽医师,研究方向:实验动物饲养与科研管理。E-mail:1508505619@qq.com。
﹞2015-08-18
研究报告
