基于NP968核酸提取仪 (磁珠法)的实时荧光定量PCR系统检测HBVDNA的性能评价
2015-05-10王建伟孙嘉峰黄毅
王建伟,孙嘉峰,黄毅
(1、福建省立医院南院福建省立金山医院检验科,福建 福州350008;2、福建省立医院检验科,福建 福州350001)
乙型肝炎病毒DNA(hepatitis B virus Deoxyribonucleic acid,HBV DNA)是反映HBV复制活跃程度及传染性的最直接指标,也是观察抗病毒药物疗效、预后和指导抗病毒药物应用的重要指标之一。HBVDNA定量检测从根本上突破了免疫学方法等间接方法的局限性,通过直接检测病毒核酸水平,可真实反应患者体内病毒水平[1-3]。目前提取HBVDNA主要采用煮沸法,该法不能有效去除干扰物质如血红蛋白,提取的血浆HBV DNA含量较低,接近临界值标本的提取结果不稳定,在临床检测中容易产生假阴性[4]。本研究应用西安天隆NP968自动核酸提取仪(磁珠法)提取HBVDNA,相比传统的煮沸法,具有快速、简便、减少人工误差等特点。根据ISO15189医学实验室认可标准[5],必须对其检测系统进行性能评价,本文通过分析其精密度、线性、回收率、最低检出限,并将检测结果与传统煮沸法进行对比,分析其相关性,从而评价该法对HBVDNA检测的性能。
1 材料与方法
1.1 标本来源 来自2014年10月13日至10月17日我院PCR实验室接收的79例门诊患者血浆标本及我院免疫室接收的20份我院国内体检健康人血清标本。
1.2 仪器与试剂
1.2.1 试剂 HBVDNA荧光定量PCR检测试剂盒与HBVDNA标准品(广州达安公司);核酸提取(磁珠法)试剂盒(西安天隆公司)。
1.2.2 仪器 NP968核酸提取仪(NP968,西安天隆公司);ABI7300实时荧光PCR仪 (ABI7300,美国ABI公司)。
1.3 检测方法
1.3.1 HBVDNA提取与检测
1.3.1.1 煮沸法 按照达安公司HBVDNA荧光定量PCR检测试剂盒说明书取待测血浆样本、HBVDNA荧光定量PCR检测试剂盒内阳性对照品、阴性对照品、标准品和自制高值、低值质控品各30μl,分别加入70μl核酸提取液,充分振荡混匀后 ,100℃ 恒 温 处 理 10±1min,12000r/min 离 心5min,取 20μl上清液加入反应管,在 ABI7300实时荧光PCR仪上进行HBVDNA的定量检测。
1.3.1.2 磁珠法 按照NP968自动核酸提取仪 (磁珠法)试剂盒说明书,取待测血浆、达安试剂盒阳性对照品、阴性对照品、标准品和质控品各200μl,加入预先分装好自动核酸提取液的板孔内,放入NP968自动核酸提取仪内,按预定的提取程序自动执行核酸提取,最终得到100μl洗脱液,取20μl上清液加入反应管,在ABI7300实时荧光PCR仪上进行HBVDNA的定量检测。
1.3.2 精密度评价 按照CLSI EP15-A2标准:2个浓度水平,5d实验,每天一批,每批每个水平重复测定3次,所有测定数据均转化为对数值。
1.3.3 线性评价 选择1份高值患者血浆标本,浓度接近厂家试剂盒说明书给出的线性范围上限(5.00E8 IU/ml),按1:10用正常人血浆倍比稀释此高值标本直至浓度接近线性范围下限 (1.00E2 IU/ml),形成浓度由高到低7份待测实验样品。每份实验样品在检测系统上重复测定2次,结果转换为对数,取2次测定的均值作为实测值(Y);以其系列稀释后理论上应含有的浓度(亦取对数)作为预期值(X),将所有结果点在X-Y坐标图上,计算回归方程:Y=bX+a。
1.3.4 回收率 选择厂家配套低值标准品为基础样本,取180μl基础样本和20μl蒸馏水作为对照样本, 分别取 180μl基础样本和 20μl浓度为2.0E6IU/ml、2.0E5IU/ml和 2.0E4IU/ml的标准品作为回收样品。每份样品在检测系统上测定3次,结果转换为对数,取平均值。根据以下公式计算回收率:回收率=回收浓度/加入浓度×100%;回收浓度=最终测定浓度-基础样本浓度;加入浓度=标准品浓度×标准品体积/(标准品体积+基础样本体积)[6]。
1.3.5 最低检出限 依据YY/T 1182-2010中华人民共和国医药行业标准 《核酸扩增检测用试剂(盒)》之6.8.2条款要求[7],采用无菌注射用水将购自卫生部临床检验中心的HBVDNA血清标准物质(1.20±0.24)E6 IU/ml按 1:10000 进行稀释,使其浓度达到广州达安公司HBVDNA试剂声明的最低检出限(1.00E2 IU/ml)后,进行25次重复检测,以至少22次结果≥1.00E2 IU/ml为最低检出限验证通过;如不符合此要求,应查找原因,并补充数据或重新实验。
1.3.6 参考区间 参考NCCLSC28-A2,通过测定29份我院国内体检健康人血清标本 (标本从我科免疫组获得,乙肝两对半模式为全阴/或-+---/或-+--+)的 HBV DNA 浓度,对〈1.00E3 IU/ml的生物参考区间进行验证;若20份标本的检测结果均在参考区间内或仅有2个标本超出,则验证通过。否则,进行参考区间确立实验。
1.3.7 相关性评价 分别采用煮沸法和磁珠法提取79例患者血浆标本进行荧光定量PCR,比较两种方法的相关性。
1.4 统计学方法 将定量HBVDNA拷贝数转化为对数值,所有统计学处理均在SPSS20.0统计软件包上进行。
2 结果
2.1 精密度验证 低、高水平样本检测的批内精密度均<3/5TEa,批间精密度均<4/5TEa。该检测方法的批内及批间精密度均符合厂家要求小于5%(见表1)。
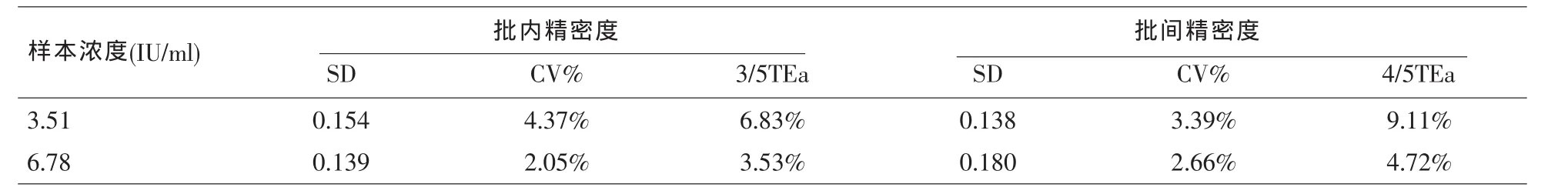
表1 精密度验证结果
2.2 线性范围验证 HBV-DNA在4.16E2-4.16E8 IU/ml范围内具良好线性关系 (厂家线性范围1.0E2-5.0E8 IU/ml),R2=0.989,b=1.01 在 0.97~1.03范围内;a=0.271,经t检验显示a与0无显著性差异(P>0.05)(见表 2,如图 1)。
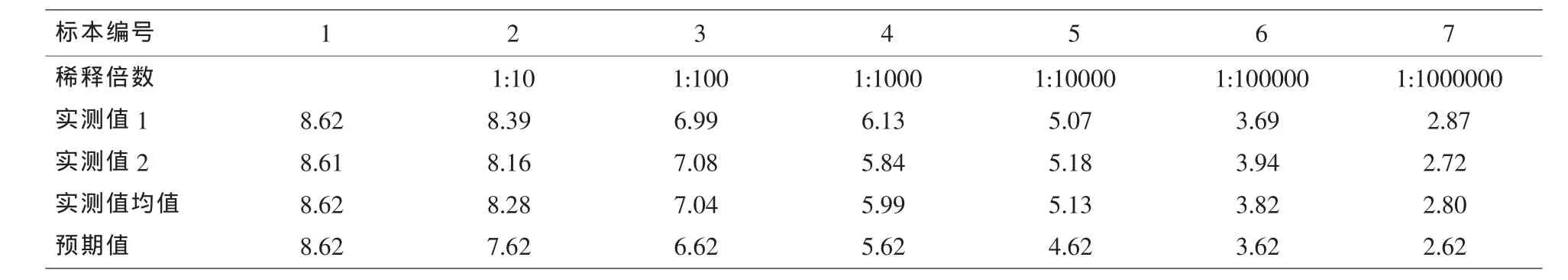
表2 线性范围验证结果
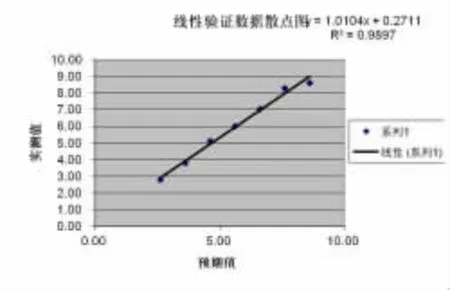
图1线性验证数据散点图
2.3 回收实验 根据相关公式计算的检测平均回收率为104%。见表3。
2.4 最低检出限验证 厂家声明的最低检出限(1.00E2 IU/ml)验证试验通过。见表4。
2.5 参考区间 参考区间为<1.00E3 IU/ml。见表5。2.6两种方法检测结果的相关性分析 以煮沸法检测结果为X,以磁珠法检测结果为Y,经分析显示两者相关性良好(Y=0.995X+0.526,R2=0.951。见图2。
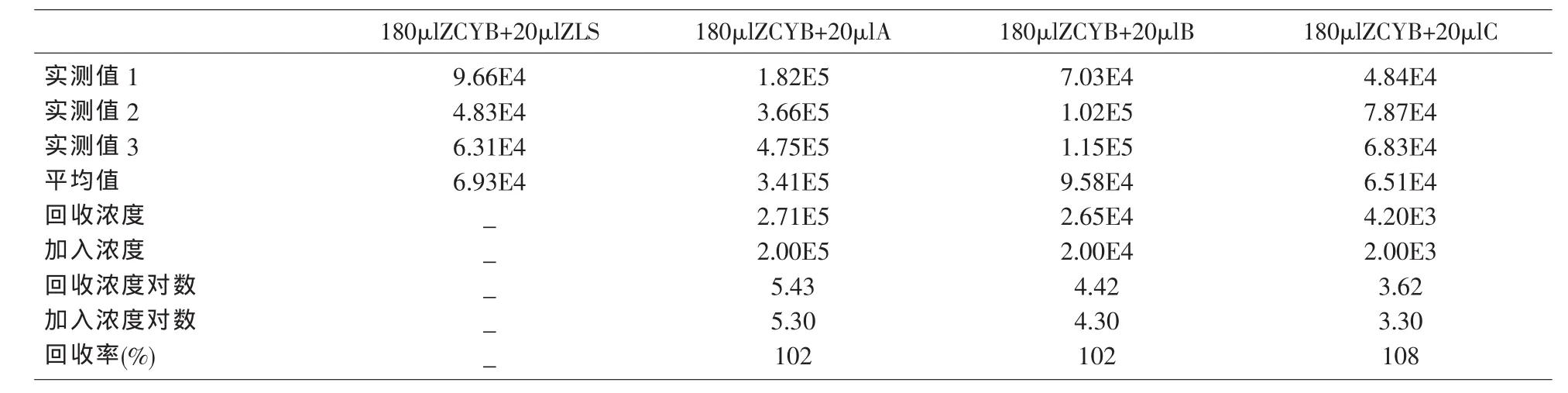
表3 回收实验结果
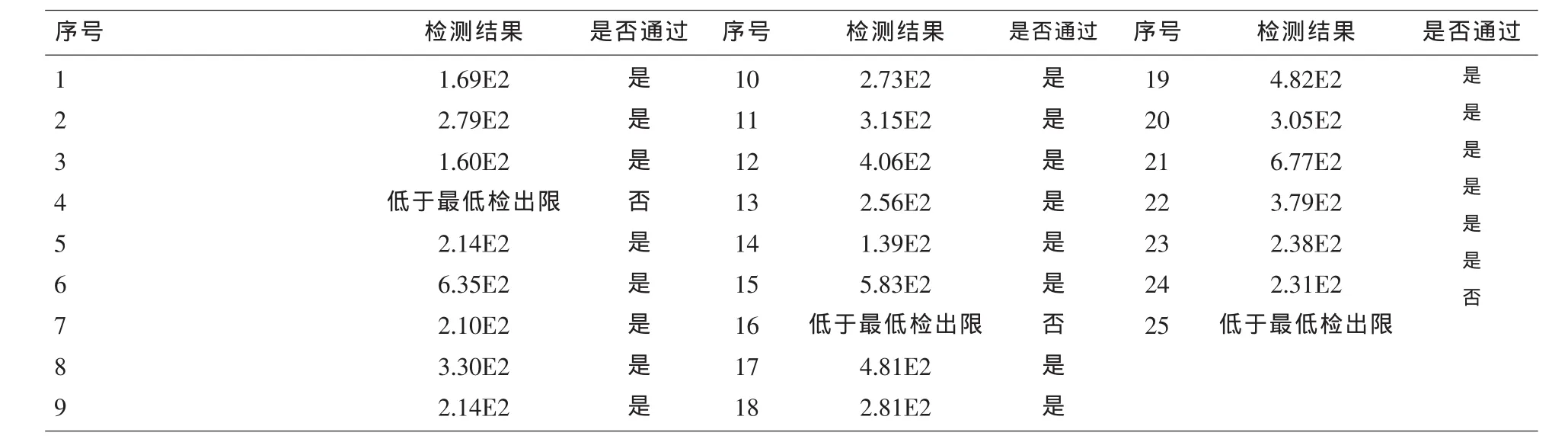
表4 最低检出限验证实验结果
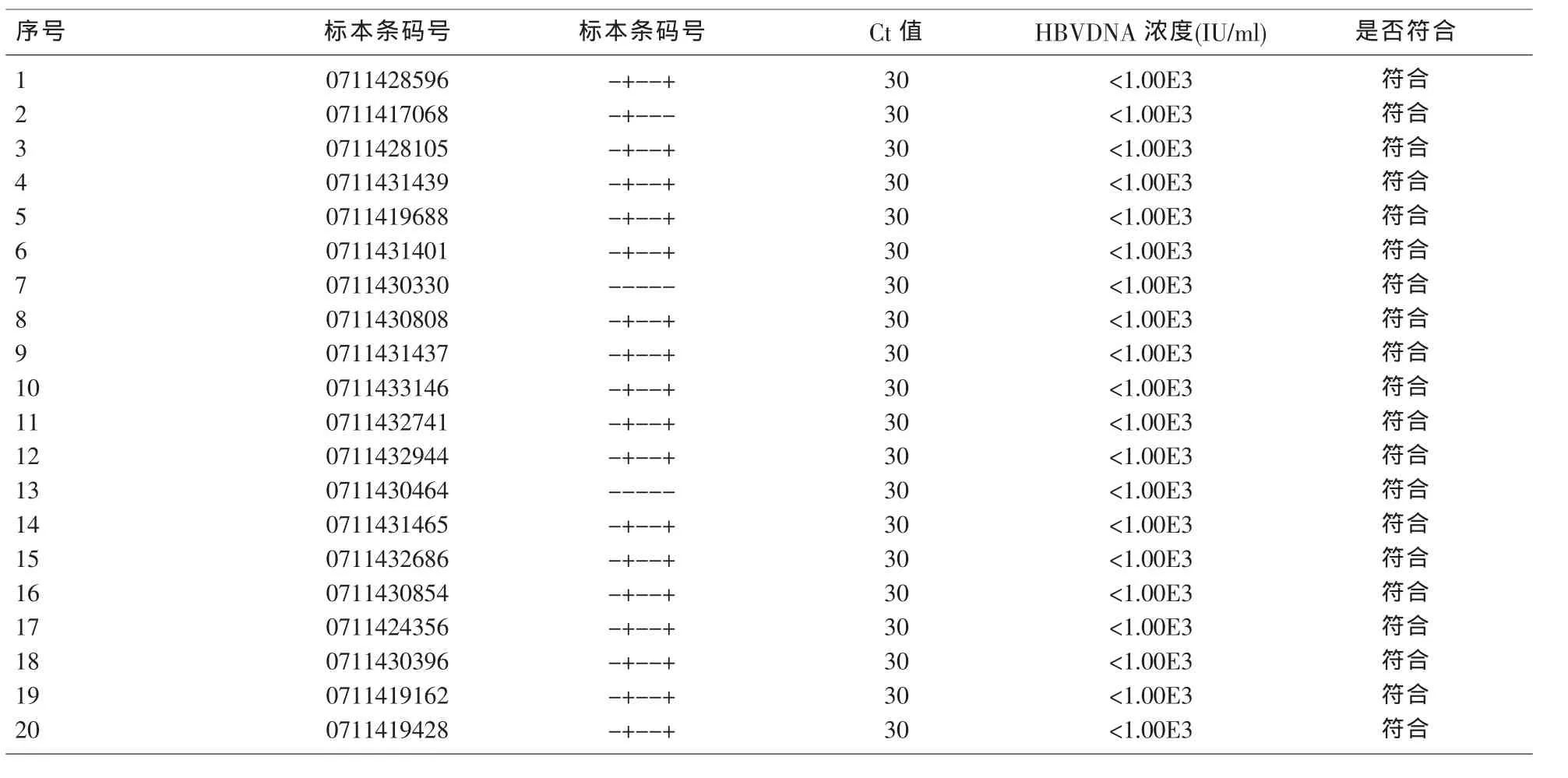
表5 参考区间验证结果
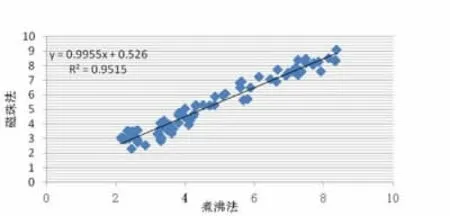
图2磁珠法与煮沸法检测结果相关性分析
3 讨论
我国人群对HBV普遍易感,HBVDNA是HBV感染最直接、特异性强和灵敏性高的指标。HBVDNA阳性提示HBV复制和有传染性,其含量越高表示病毒复制越厉害,传染性越强。因此,HBV DNA定量检测对于判断乙型肝炎传染性强弱、乙型肝炎病毒复制情况、乙型肝炎抗病毒治疗效果等都有十分重要的意义[8-11]。
病毒核酸的检测是生命科学领域一个重要的分支,在临床病原体检测、传染性疾病及基因诊断方面具有独特的应用价值。核酸提取是核酸检测中关键的步骤,直接影响后续实验结果[12]。目前,实验室一般采用传统的手工提取方法(煮沸法、柱提取法等)。煮沸法直接将病毒DNA从病毒颗粒中释放出来,离心后的上清液中不仅含有病毒核酸,还含有少量血红蛋白等一些干扰PCR的抑制性杂质;并且在处理临床标本时,存在生物安全等问题。因此,临床实验室迫切需要自动化方法来进行核酸提取[13]。随着纳米技术的发展,极大的推动了基于磁珠微球的自动核酸提取法的发展,目前自动核酸提取法(磁珠法)已经应用于临床核酸(DNA和RNA)等多种物质的分离和纯化[14]。磁珠法方法提取的核酸纯度高,能够除去大多干扰PCR的抑制因子,如蛋白质、多糖、酚类等物质,使实时荧光定量PCR检测方法更灵敏、更准确[15]。NP968自动核酸提取仪具有自身的优势:(1)提取速度快,操作时间短,30~60min/次,通量大,每次可同时提取32份样品;(2)内置紫外光杀菌功能可自我清洁;(3)严格控制孔间污染及批次间污染;(4)能有效避免人工操作引起的差异及错误,结果稳定,重复性好。
精密度评价实验按照EP15-A2文件进行,实验数据显示基于NP968自动核酸提取仪 (磁珠法)的实时荧光定量PCR系统,检测HBVDNA的低、高水平批内精密度均<3/5TEa,批间精密度均<4/5TEa,精密度良好。线性评价实验根据CLSI EP6-A文件,采用简便的平均斜率法,结果显示基于NP968自动核酸提取仪(磁珠法)的实时荧光定量PCR系统检测HBVDNA,在4.16E2~4.16E8 IU/ml范围内具有良好的线性关系,达到厂家的检测声明。最低检出限验证 依据YY/T 1182-2010中华人民共和国医药行业标准 《核酸扩增检测用试剂(盒)》之6.8.2条款要求,厂家声明的最低检出限(1.00E2 IU/ml)验证试验通过。在定量分析验证时,准确度通常可用回收率表示,回收率越接近100%表明分析方法准确度越高。本研究回收实验结果显示,基于磁珠法的HBVDNA检测回收率为104%,接近100%,准确度高。根据NCCLSC28-A2,参考区间<1.00E3IU/ml验证试验通过。此外,通过对79例患者血浆标本磁珠法与煮沸法HBVDNA检测结果的比较,表明两者相关性良好(Y=0.995X+0.526,R2=0.951)。总之,基于NP968自动核酸提取仪(磁珠法)的实时荧光定量PCR系统,实现了快速、自动化提取HBVDNA,对HBVDNA具有良好检测性能,适合临床实验室推广使用。
[1]吴斌,李彩东,李惠军,等.两种国产乙型肝炎病毒核酸定量试剂盒检测结果比较[J].国际检验医学杂志,2013,34(14):1880-1882.
[2]范公忍,韩聚强,胡学玲,等.两种核酸提取方法对血清HBV DNA荧光定量检测结果的影响 [J].中国卫生检验杂志,2013,23(9):2110-2111.
[3]郑金菊,刘珊,王荣.乙型肝炎病毒DNA定量与乙型肝炎五项结果的对比分析[J].中国当代医药,2014,21(9):96-97.
[4]陆佳飞,周科隆,王缦.磁珠快速提取乙型 肝炎病毒DNA方法的建立及其应用研究[J].中华检验医学杂志,2012,35(9):843-850.
[5]魏昊,丛玉隆.医学实验室质量管理与认可指南[M].北京:中国计量出版社,2004:59-75.
[6]申子瑜,李萍.临床实验室管理学[M].人民卫生出版社,2003:145.
[7]国家食品药品监督管理局,中华人民共和国医药行业标准.YY/T1182-2010核酸扩增检测用试剂(盒)[S].2012:4.
[8]宋丽.实时荧光定量聚合酶链检测在乙型肝炎诊断中的应用[J].实用医技杂志,2013,20(3):289-290.
[9]蒋素贞,鲁凤民,庄辉.慢性乙型肝炎病毒DNA定量检测的临床意义[J].中华检验医学杂志,2012,35(2):117-118.
[10]杨丽珠.乙型肝炎病毒表面抗原定量与HBV DNA含量的相关性分析[J].中国医药指南,2014,12(26):27-28.
[11]胡建勇,吴枚,李鑫.不同核酸提取方法用于HBV DNA定量检测的比较[J].国际检验医学杂志,2014,35(17):2387-2388.
[12]Lea JH,Park Y,Choi JR,et al.Comparisons of three automated systems for genomic DNA extraction a clinical diagnostic Laboratory[J].Yonsei Med,2010,51(1):104-110.
[13]胡荣盛,薛静俊,朱振坤,等.自动核酸提取实时荧光定量PCR检测全血及血浆中EBV DNA载量的性能评价[J].现在实用医学,2013,25(8):940-943.
[14]刘君,裴豪,陈燕燕,等.磁珠法检测抗酸杆菌的方法建立和临床应用[J].中华医院感染学杂志,2011,21(22):4861-4863.
[15]Watson RJ,Blackwell B.Purification and characterization of a common soil component which inhibits the polymerase chain reaction[J].JMicrobiol,2000,46:633-642.
