联唑类含能化合物及其含能离子盐研究进展
2015-05-10黄晓川王子俊邱少君葛忠学
黄晓川,郭 涛,刘 敏,王子俊,邱少君,葛忠学
(西安近代化学研究所,陕西 西安 710065)
1 引 言
含能材料作为推进剂、炸药等的基本组分,是武器做功的能源,其性能直接决定武器装备的战斗力[1-3]。为满足现代战争对武器“远程打击、高效毁伤”的要求,推进剂及填装弹药的能量需要进一步提高,但其感度也随之增大,在生产、运输、贮存和使用过程中遇到外界能量的刺激易产生意外爆炸,造成重大经济损失和人员伤亡。另外,传统硝胺类炸药对环境所造成的影响近年来也得到了广泛的关注。因此,解决能量与感度之间的矛盾以及寻找新型绿色含能材料成为研究人员迫切需要解决的难题。
唑环类化合物以其高氮含量、高生成焓、高产气量和爆轰产物清洁等特点逐渐成为含能材料领域的研究热点[4-7]。唑环的生成焓随氮含量的增加而逐步增高,但稳定性随之降低。三唑和四唑的氮含量适中,可以同时保有较高的生成焓和稳定性。近年来,研究人员,针对三唑和四唑结构单元设计合成了一系列含能化合物,基本都表现出了高爆轰性能、高密度以及低感度等特点,具有潜在的应用价值[3,8-9]。
以往对三唑和四唑类含能化合物的研究主要集中在单环衍生物、偶氮键相连的双环衍生物及其含能离子盐等方面[10-12]。研究发现,通过C—C键或C—N相连的联唑类化合物相比于传统单环衍生物具有更小的偶极矩以及更紧密的分子空间排布,对降低感度和提高堆积密度有促进作用[13]。联唑类化合物不仅具有传统唑类含能化合物高生成焓、高氮含量等优点,而且拥有相对更高的密度和更低的感度,是一类具有广泛应用前景的含能化合物[14]。本文综述了国内外联-1,2,4-三唑、联四唑和5-(1,2,4-三唑)四唑等联唑类含能化合物及其含能离子盐的最新研究成果,与传统硝胺类含能材料综合性能对比,发现联唑类含能化合物是理想的高能钝感含能材料,并且在原料成本、反应过程控制和爆轰产物对环境影响等方面更具优势。针对目前研究过程中所出现的不足和难点,指出下一步的工作重点为富氮阳离子对联唑类化合物的感度和爆轰性能的影响规律以及进一步合成出综合性能更好的联唑类含能化合物,此外还设计了9种新型联唑类含能化合物,并利用量子化学方法对其性能进行预估
2 联-1,2,4-三唑类含能化合物及其含能离子盐
2.1 对称取代的联-1,2,4-三唑类含能化合物及其含能离子盐
5,5′-二氨基-3,3′-联-1,2,4-三唑(1)是合成联-1,2,4-三唑类含能化合物的关键母体。1具有多齿配体的特性,在金属配合物中有较多的合成与应用报道,但由于原合成方法较难提纯,限制了其进一步应用[15]。Dippold等[13]以氨基胍碳酸氢盐代替以往所使用的氨基胍盐酸盐,在盐酸体系中与草酸反应,然后在碱液中回流合环,收率提高至70%(Scheme 1)。
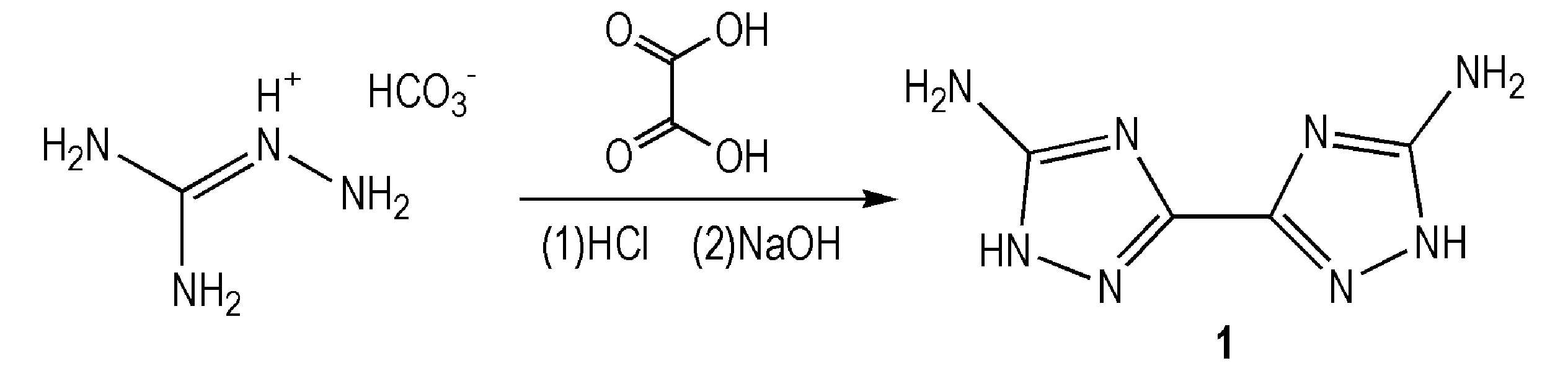
Scheme 1[13]
1为母体,通过Sandmeyer反应[16]、直接硝化和重氮化,可分别得到3,3′-二硝基-5,5′-联-1,2,4-三唑(2,Sandmeyer反应使三唑环发生重排)、5,5′-二硝胺基-3,3′-联-1,2,4-三唑(3)和5,5′-二叠氮基-3,3′-联-1,2,4-三唑(4)(Scheme 2)。
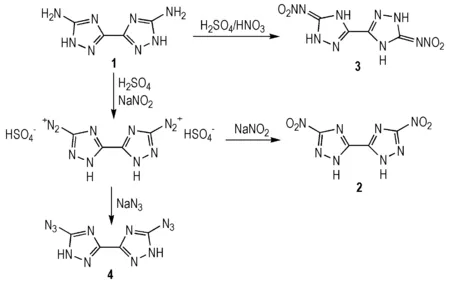
Scheme 2[16]
化合物2和3的密度分别为1.90 g·cm-3和1.80 g·cm-3,理论爆速分别为8413 m·s-1和 8355 m·s-1,理论爆压分别为320 kbar和300 kbar(10 bar=1.01 MPa),与RDX相当,但其感度较高(其中3的撞击感度为3 J,摩擦感度为108 N,BAM方法)[13]。1,2,4-三唑环2位上N—H键较为活泼,可与富氮阳离子结合成含能离子盐。Dippold等[17]将2与不同富氮阳离子结合,得到了6种含能离子盐(Scheme 3)。与2相比,2b和2c的性能较为优良,氮含量、爆速、密度和感度等性能都有一定提升(部分化合物的性质见表1)。
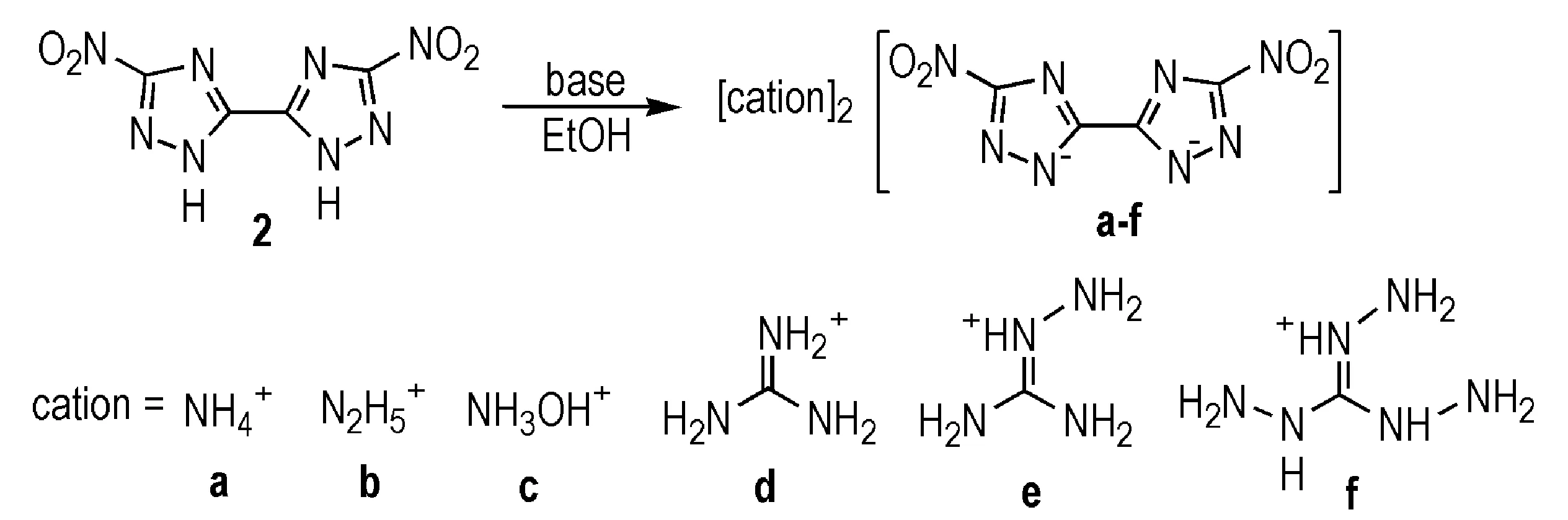
Scheme 3[17]
Wang等[18]利用1,2,4-三唑环上2位上的N—H的酸性,将3与不同富氮阳离子结合,得到了13种含能离子盐(Scheme 4)。与3相比,部分含能离子盐的分解温度和能量密度得到一定程度的提高,感度也有相应的降低。这可能由于阳离子的加入,丰富了分子间氢键网络结构,使得分子间的堆积更加规律,从而可以有效提高密度和降低感度。其中3j的性能最为突出,密度达1.95 g·cm-3,理论爆速为9399 m·s-1,理论爆压为360 kbar,撞击感度超过38 J,以上性能均优于RDX和HMX(部分化合物的性质见表1)。
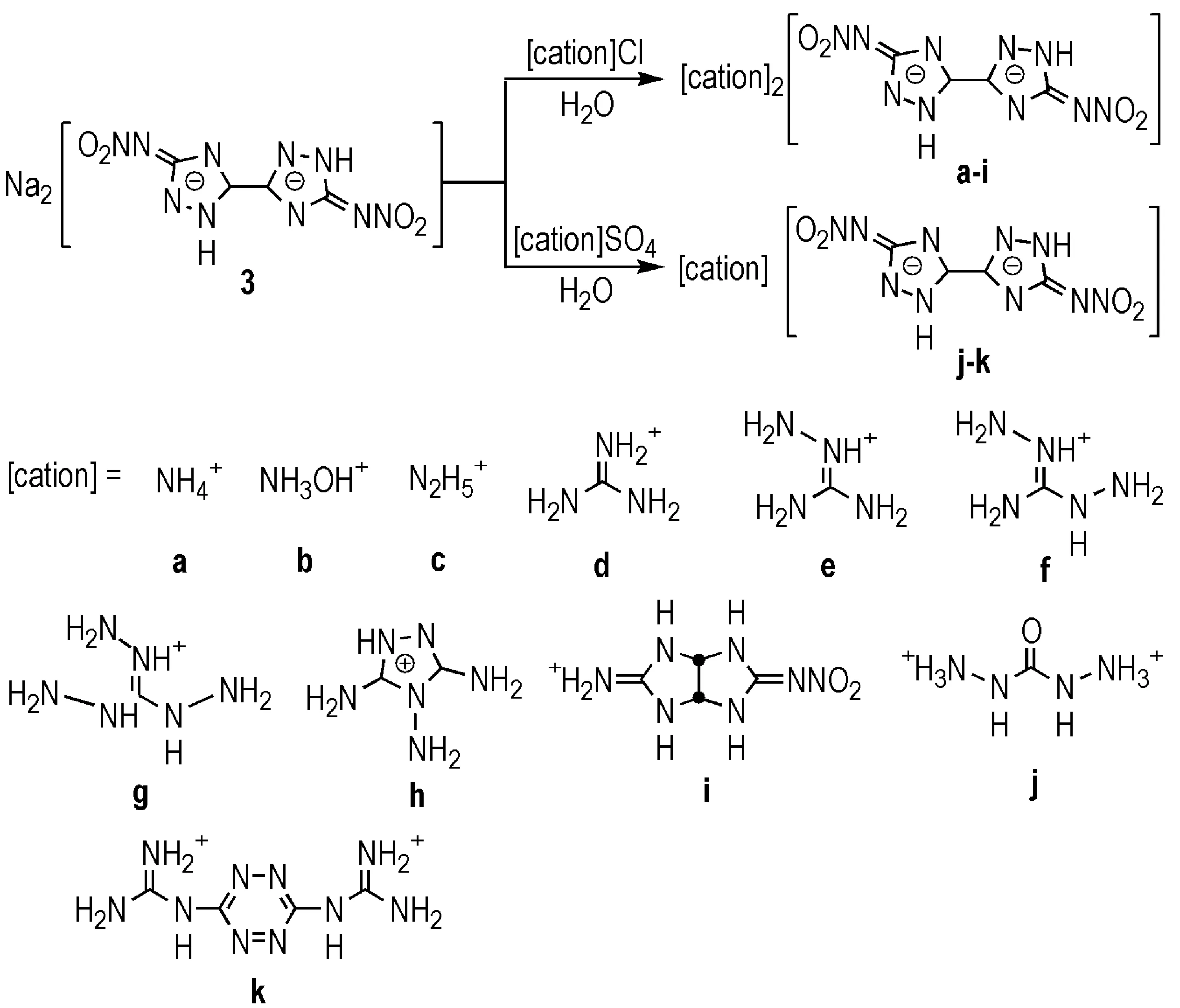
Scheme 4[18]
2与3的氧平衡水平较低,分别为-35.4%和-37.5%。使用合适的氧化剂将1,2,4-三唑环上活性较强的N—H键氧化,引入羟基或配位氧,是提高氧平衡的有效方法。目前,关于这方面的研究报道较少,常用的氧化体系有双氧水/邻苯二甲酸酐、间氯过氧苯甲酸和三氟醋酸等,但以上方法的收率较低,且容易形成多种同分异构体[19]。因而,对氧化体系的选择显得尤为重要。Dippold等[20]以Oxone(过硫酸氢钾复合盐)为氧化剂,成功使2转化为5,收率为81%(Scheme 5)。该法步骤简单,反应条件温和,对唑环N—H键的氧化具有较强的通用性。与2相比,5的密度、氧平衡、爆速和产气量均有较大幅度的提升。因为硝基具有较强电负性的缘故,5有一定的酸性,可以进一步与富氮阳离子组成含能离子盐(部分化合物性质见表1)。
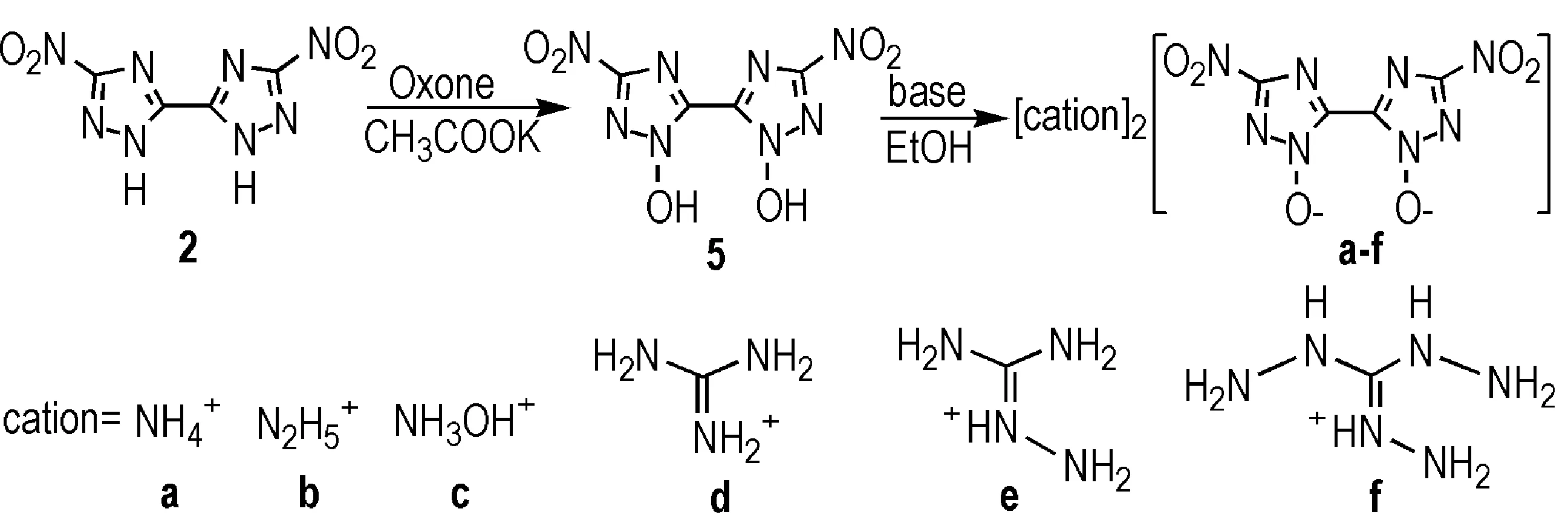
Scheme 5[20]
Dippold等[13]设计以氰化钠为原料,在乙醇中与氯气反应得到乙二亚胺酸二乙酯,再与肼反应得到1,2-二肼基乙烷二亚胺,然后与3-乙氧基-3-亚氨基丙酸乙酯的盐酸盐反应得到中间体3,3′-二乙酸乙酯基-5,5′-联-1,2,4-三唑,最后经硝化得到3,3′-二偕二硝甲基-5,5′-联-1,2,4-三唑(6)(Scheme 6)。6的密度为1.95 g·cm-3,理论爆速为8499 m·s-1,理论爆压为341 kbar,撞击感度为20 J,摩擦感度为360 N,各项指标均优于RDX,在钝感高能炸药领域具有潜在的应用价值(详细性质见表1)。另外与2和3相比,6的氧平衡水平要高于两者(-27.9%)。
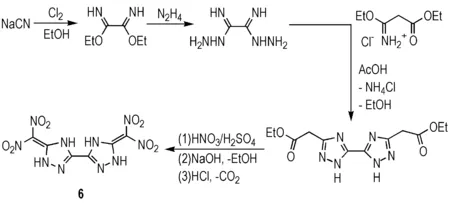
Scheme 6[13]
2.2 不对称取代的联-1,2,4-三唑类含能化合物及其含能离子盐
为考察不同取代基团对联-1,2,4-三唑类含能化合物感度及爆轰性能的影响,Dippold等[21]以2为母体,分别以氨基、硝胺基和叠氮基取代一个硝基,合成了三种不对称取代的联-1,2,4-三唑化合物——5-(5-氨基-1,2,4-三唑-3)-3-硝基-1,2,4-三唑(7)、5-(5-叠氮基-1,2,4-三唑-3)-3-硝基-1,2,4-三唑(8)和5-(5-硝胺基-1,2,4-三唑-3)-3-硝基-1,2,4-三唑(9),并选择合适的富氮阳离子与9组成了三种阳离子盐(Scheme 7)。
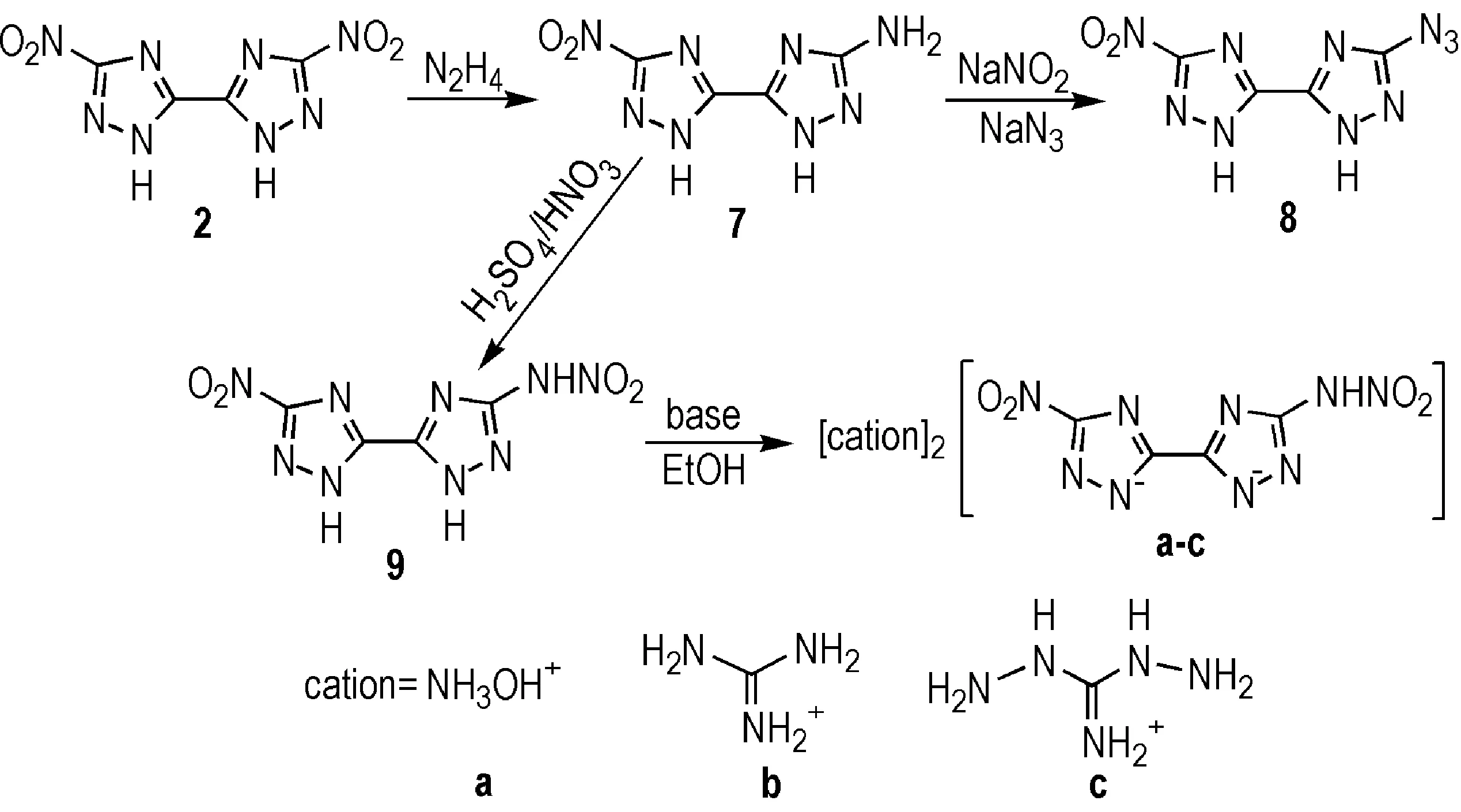
Scheme 7[21]
表1 部分联-1,2,4-三唑类化合物性质与RDX的对比
Table 1 properties of seleected bis-1,2,4-triazoles in comparison to RDX
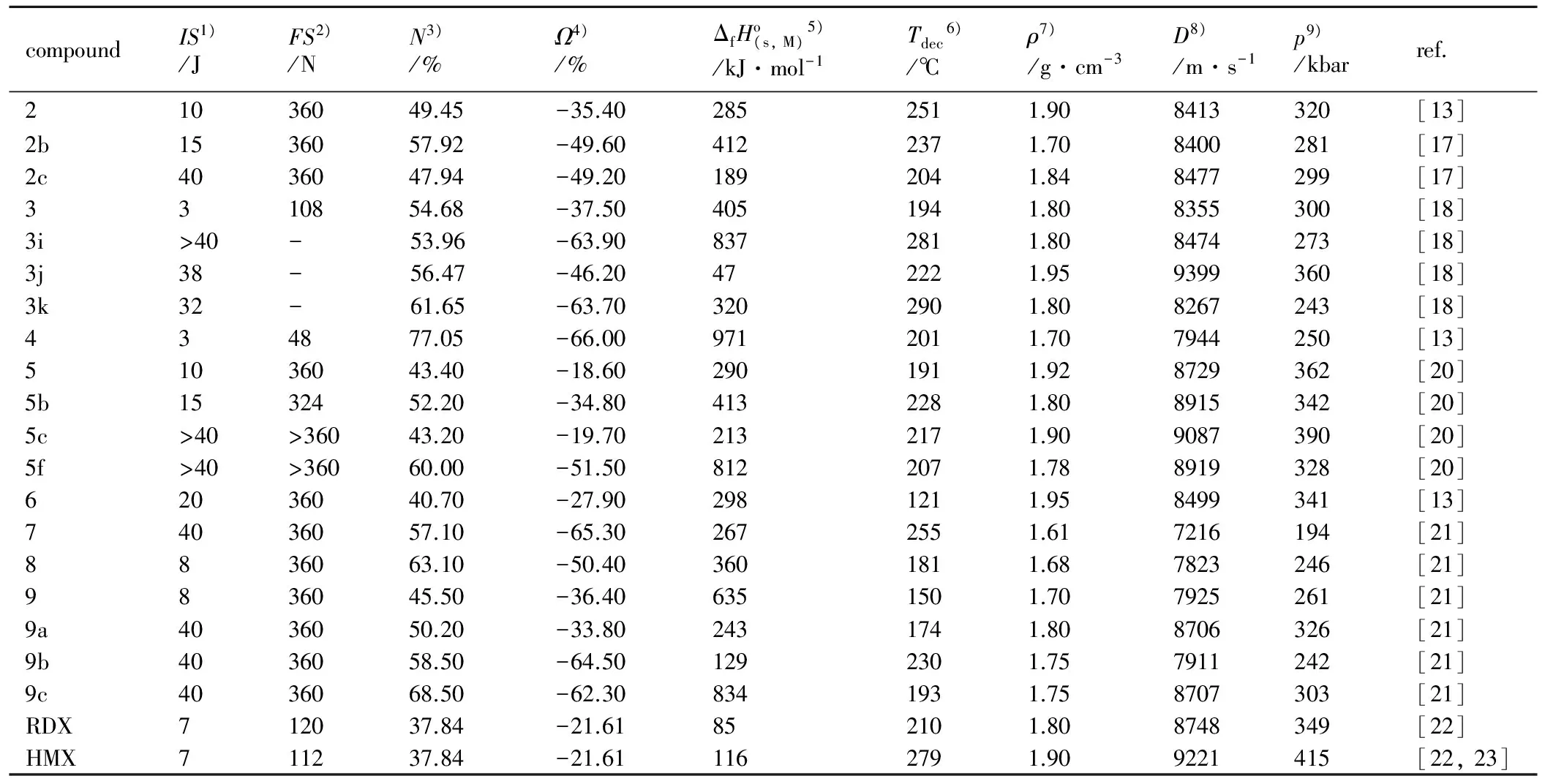
compoundIS1)/JFS2)/NN3)/%Ω4)/%ΔfHo(s,M)5)/kJ·mol-1Tdec6)/℃ρ7)/g·cm-3D8)/m·s-1p9)/kbarref.21036049.45-35.402852511.908413320[13]2b1536057.92-49.604122371.708400281[17]2c4036047.94-49.201892041.848477299[17]3310854.68-37.504051941.808355300[18]3i>40-53.96-63.908372811.808474273[18]3j38-56.47-46.20472221.959399360[18]3k32-61.65-63.703202901.808267243[18]434877.05-66.009712011.707944250[13]51036043.40-18.602901911.928729362[20]5b1532452.20-34.804132281.808915342[20]5c>40>36043.20-19.702132171.909087390[20]5f>40>36060.00-51.508122071.788919328[20]62036040.70-27.902981211.958499341[13]74036057.10-65.302672551.617216194[21]8836063.10-50.403601811.687823246[21]9836045.50-36.406351501.707925261[21]9a4036050.20-33.802431741.808706326[21]9b4036058.50-64.501292301.757911242[21]9c4036068.50-62.308341931.758707303[21]RDX712037.84-21.61852101.808748349[22]HMX711237.84-21.611162791.909221415[22,23]
Note:1) Impact sensitivity(BAM drophammer).2) Friction sensitivity(BAM friction tester).3) Nitrogen content.4) Oxygen balance.5) Molar enthalpy of formation(calculated for all compounds at the CBS-4 M level of theory).6) Decomposition temperature.7) From X-ray diffraction.8) Detonation velocity.9) Detonation pressure.(Detonation velocity and pressure were calculated using the EXPLO5.05 program).
与对称取代的联三唑2~4相比,7~9的虽然在分解温度、密度和爆速等方面有所下降(可能是由于两边取代基团的差异使晶格空间排列发生改变的原因造成的[13,21]),但感度也得到了较大幅度的改善(撞击感度分别为40,8 J和8 J,摩擦感度均达到360 N)。三种含能离子盐9a,9b,9c与9相比,不仅保持了钝感的特性,而且进一步提升了分解温度、密度、氮含量和爆轰性能,是潜在的钝感含能材料(部分化合物性质见表1)。
3 联四唑类含能化合物及其含能离子盐
3.1 5,5′-联四唑类化合物及其含能离子盐
有关5,5′-联四唑(10)的合成在20世纪初就已相关报道,因其极高的氮含量(81.1%),在含能材料领域得到了广泛的关注。早期10的合成以乙二腈和叠氮酸为原料,但这两种物质具有较高的危险性,后经Nelson和Chavez等人[24-25]改进,逐步形成了以叠氮化钠和氰化钠为原料,在酸性条件下经二氧化锰的作用,发生闭环反应,再经酸化合成10的工艺(Scheme 8)。由于四唑有较强的吸电子能力,四唑环上两个氢原子较易电离,因而10的酸性较强,并且由于自身的高氮含量致使感度也较高。这两点原因造成10不能直接作为含能材料使用。Fischer等[26]将不同有机阳离子加入到10的水溶液中反应得到了8种含能离子盐,以期改善10在性能上的不足(Scheme 8)。
实验发现含能离子盐10a-10h的虽然在爆轰性能和密度等方面参数并不理想,但感度普遍较低(与RDX相比),且爆轰气体体积值较高(超过800 L·kg-1),可用于低特征信号推进剂或气体发生剂等领域(化合物性质见表2)。
10的氧平衡水平较低,可在四唑环上引入羟基来进一步提高其氧含量[10,27]。Tselinskii等[28]以乙二醛为首原料,先与羟胺反应得到二氯乙二肟,再经叠氮化得到二叠氮基乙二肟,最后在酸性条件下合环得到了一种不含典型致爆基团的联四唑类化合物——1,1′-二羟基-5,5′-联四唑(11) (Scheme 9)。毕福强等[29]通过理论计算预估了11的爆轰性能和密度:爆速为8475 m·s-1,爆压为324 kbar,密度为1.789 g·cm-3,与RDX相当。Fischer等[30]改进了相关工艺,减少了对反应过程中危险中间体二叠氮基乙二肟的分离步骤,使整个工艺达到了可工业化的水平,并进一步合成出了二羟胺盐(12)(Scheme 9)。12的密度为1.918 g·cm-3,爆速为9698 m·s-1,爆压为424 kbar,撞击感度为20 J,摩擦感度为120 N(爆轰性能超越了HMX和ε-CL-20,感度与RDX相当)。12是目前已报道性能优良的含能材料之一,不仅具有较高的氮含量、密度、生成焓及爆轰性能,而且对热和机械感度作用钝感,有望作为硝胺类含能化合物的优良替代物,在固体推进剂和高能炸药领域均具有潜在的应用前景。
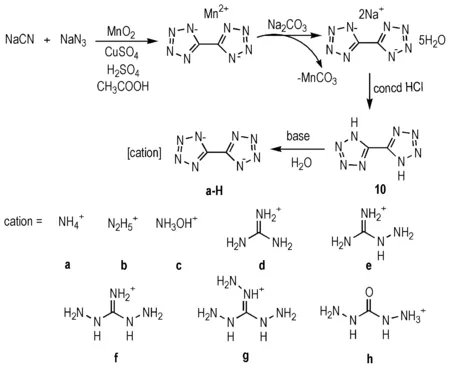
Scheme 8[24-25]
Fischer等[31]还设计从10出发,以期经过氧化得到11,再进一步得到12,但经实验发现Oxone氧化9会得到三种同分异构体——1,1′-二羟基-5,5-联四唑(11)、1,2-二羟基-5,5-联四唑(13)和2,2′-二羟基-5,5-联四唑(14)(Scheme 10)。14的密度为1.953 g·cm-3,理论爆速为9376 m·s-1,理论爆压为409 kbar(与二羟胺盐12相当,优于11),但感度较高。Fischer等引入7种富氮阳离子与14结合成含能离子盐,使其在保有较优爆轰性能的同时,感度大大降低; 另外还发现,以14为母体的含能离子盐的爆速及爆压水平表现出随N/H含量增加而提高的趋势 (部分化合物性质见表3)。
表2 部分5,5′-联四唑类化合物性质[26]
Table 2 Properties of selected 5,5′-bisterazolates[26]
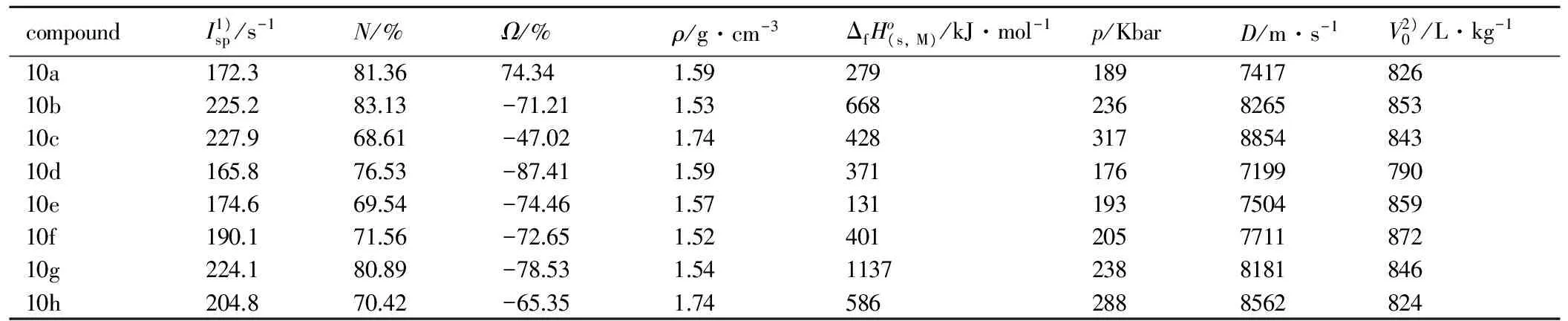
compoundI1)sp/s-1N/%Ω/%ρ/g·cm-3ΔfHo(s,M)/kJ·mol-1p/KbarD/m·s-1V2)0/L·kg-110a172.381.3674.341.59279189741782610b225.283.13-71.211.53668236826585310c227.968.61-47.021.74428317885484310d165.876.53-87.411.59371176719979010e174.669.54-74.461.57131193750485910f190.171.56-72.651.52401205771187210g224.180.89-78.531.541137238818184610h204.870.42-65.351.745862888562824
Note:1) Specific impulse.2)Volume of detonation gas.
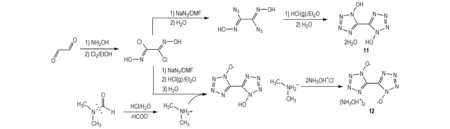
Scheme 9[24-25]
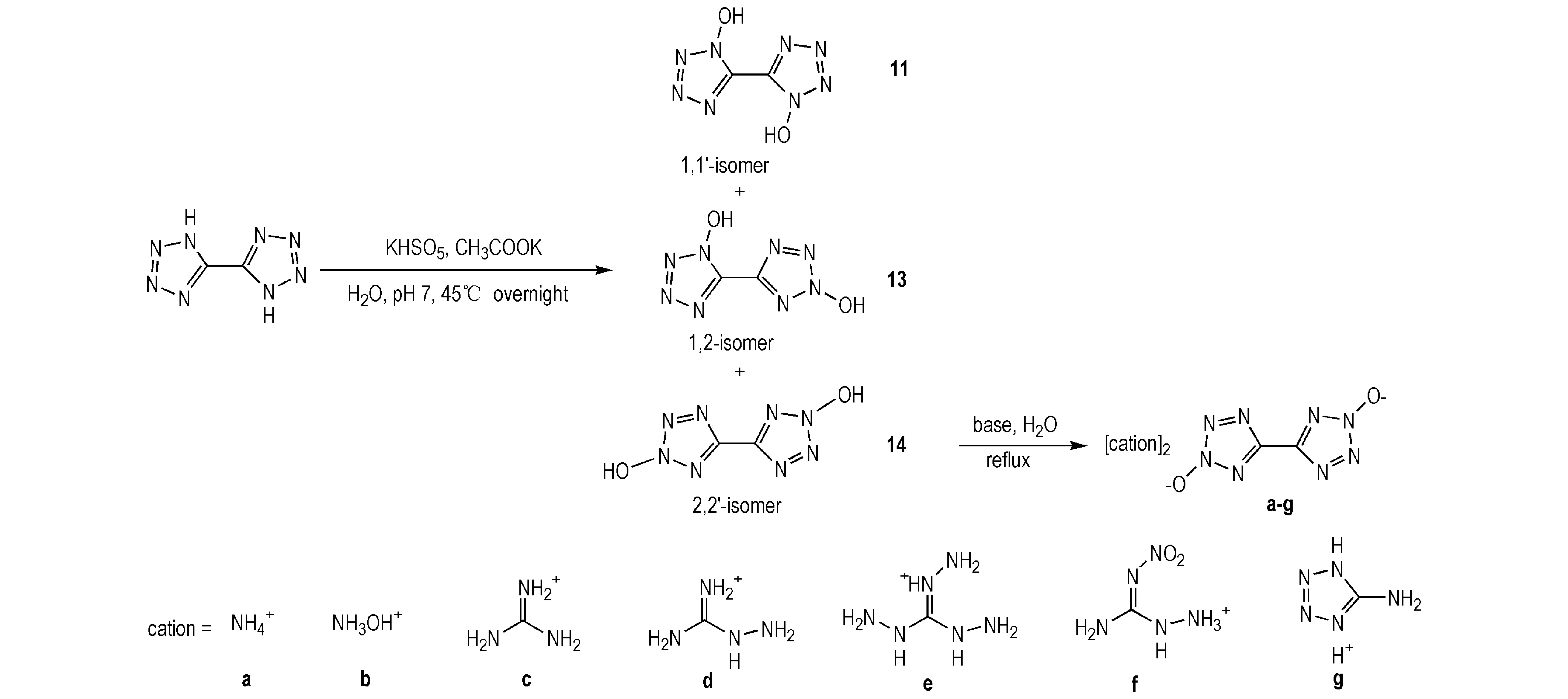
Scheme 10[31]
表3 部分5,5′-联四唑类和1,5′-联四唑类化合物性质与RDX和CL-20的对比
Table 3 Properties of selected 5,5′-bisterazolates in comparison to RDX and CL-20
compoundIS/JFS/NN%Ω/%ΔfHo(s,M)/kJ·mol-1Tdec./℃ρ/g·cm-3D/m·s-1p/kbarref.11--65.88-28.225862311.798475324[29]122012059.30-27.104472211.929698424[30]143565.88-28.225601651.959364409[31]14b36059.31-27.103911721.829264372[31]14f104861.76-31.3510441631.609350382[31]15<1<581.14-57.906221451.728355282[33]15a1030081.27-67.05622201.577900229[33]RDX712037.80-21.60852101.808748349[22]CL⁃2044838.30-10.953652152.089455467[22,34]
3.2 1,5-联四唑类化合物及其含能离子盐
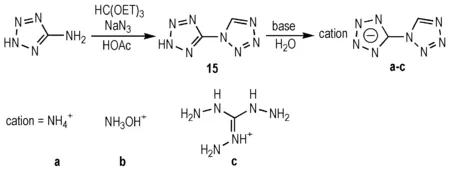
1,5-联四唑(15)于2008年首先合成得到,由于其高氮含量,被认为是推进剂的潜在组分[32]。Fischer等[33]通过5-氨基四唑、三乙基原甲酸酯和叠氮化钠在醋酸中发生合环反应得到化合物15,并进一步得到了3种含能离子盐(Scheme 11)。该方法合成步骤简单,通用性强,可为胺基转换为四唑环的反应提供借鉴。
Scheme 11[33]
4 5-(3-1,2,4-三唑-)四唑类化合物及其含能离子盐
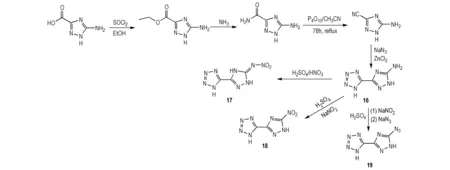
四唑环具有极高的氮含量和生成焓,因而四唑类含能化合物一般具有较优的爆轰性能。1,2,4-三唑环与之相比,稳定性较高,且更易于引入各种致爆基团。若将四唑与1,2,4-三唑通过C—C键相连,可能合成出兼具优良爆轰性能和较低感度的含能化合物。Dippold等[35]以5-氨基-1H-1,2,4-三唑-3-羧酸为原料,经酯化得到5-氨基-1H-1,2,4-三唑-3-羧酸甲酯,再与氨气反应得到5-氨基-1H-1,2,4-三唑-3-甲酰胺,然后采用五氧化二磷脱水得到5-氨基-1H-1,2,4-三唑-3-甲腈,在氯化锌的催化作用下与叠氮化钠发生合环反应得到重要的中间体5-(5-氨基-1H-1,2,4-三唑-3)-1H-四唑(16)。16通过Sandmeyer反应、直接硝化和重氮化可分别得到5-(5-硝胺基-1H-1,2,4-三唑-3)-1H-四唑(17)、5-(5-硝基-1H-1,2,4-三唑-3)-1H-四唑(18)和5-(5-叠氮基-1H-1,2,4-三唑-3)-1H-四唑(19)(Scheme 12)。17-19均表现出了一定高能钝感的特性,但密度较小,可能是由于分子结构的不对称性影响其空间堆积。18的理论爆速为8020 m·s-1,理论爆压为265 kbar,摩擦感度为288 N,撞击感度为25 J,是潜在的高能钝感含能单体(部分化合物性质见表4)。
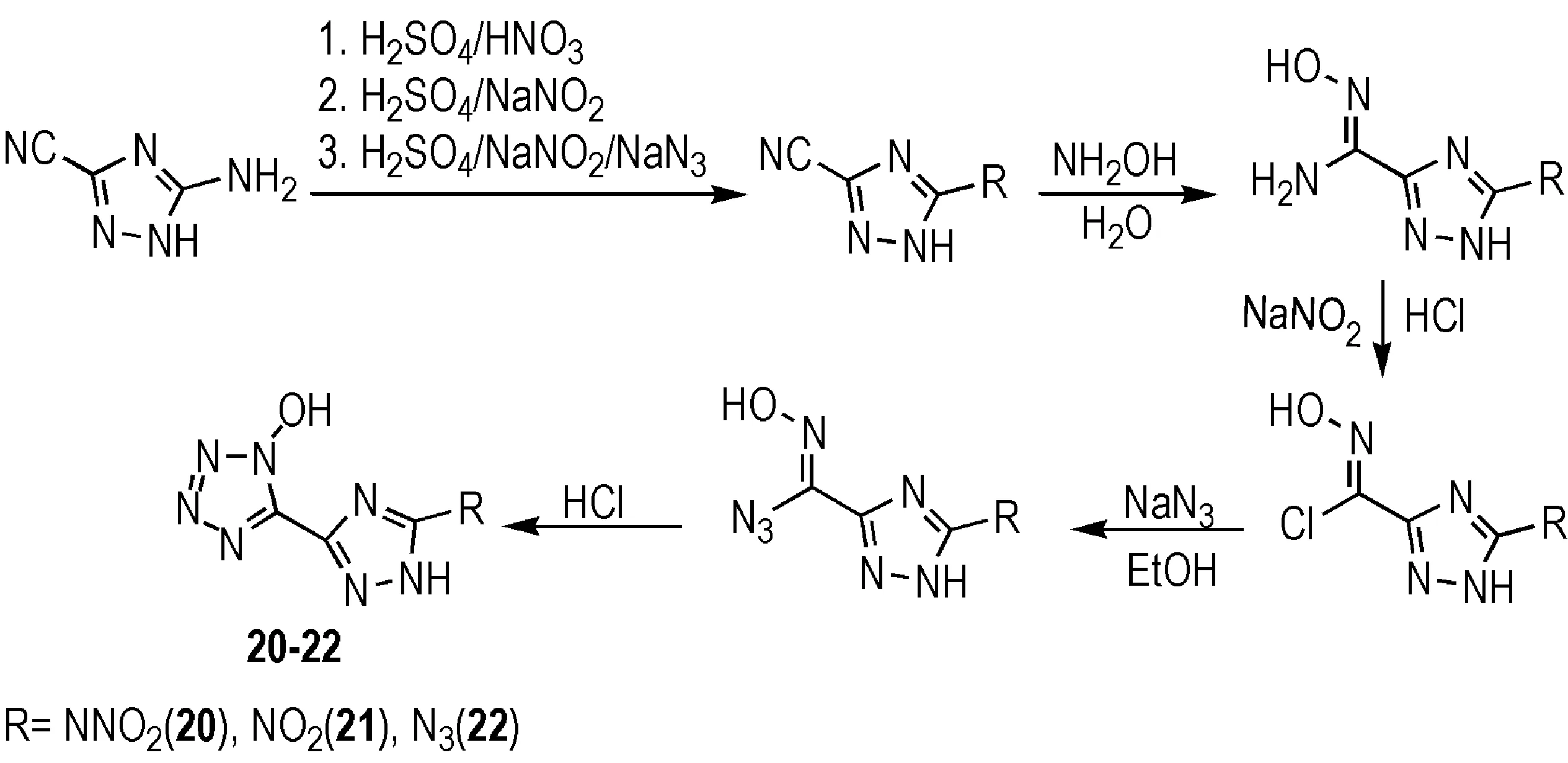
在四唑环上引入配位氧或羟基,可以有效提高化合物的能量密度,但通过Oxone氧化等方法,反应的选择性较差,往往得到多种同分异构体[31]。Dippold等[36]以5-氨基-1H-1,2,4-三唑-3-甲腈为原料,首先通过Sandmeyer反应、直接硝化和重氮化分别得到5-硝胺基-1H-1,2,4-三唑-3-甲腈、5-硝基-1H-1,2,4-三唑-3-甲腈和5-叠氮基-1H-1,2,4-三唑-3-甲腈三种中间体,然后再经羟胺加成、叠氮基取代及在酸性条件下合环等三步反应,得到1-羟基-5-(5-硝胺基-1H-1,2,4-三唑-3-)四唑(20)、1-羟基-5-(5-硝基-1H-1,2,4-三唑-3-)四唑(21)和1-羟基-5-(5-叠氮基-1H-1,2,4-三唑-3-)四唑(22)(Scheme 13)。四唑环上N—O键的引入,可将密度提高至1.80 g·cm-3以上,爆速提高至8700 m·s-1以上,且感度水平基本不变(与17-19相比),与RDX水平相当(部分化合物性质见表4)。
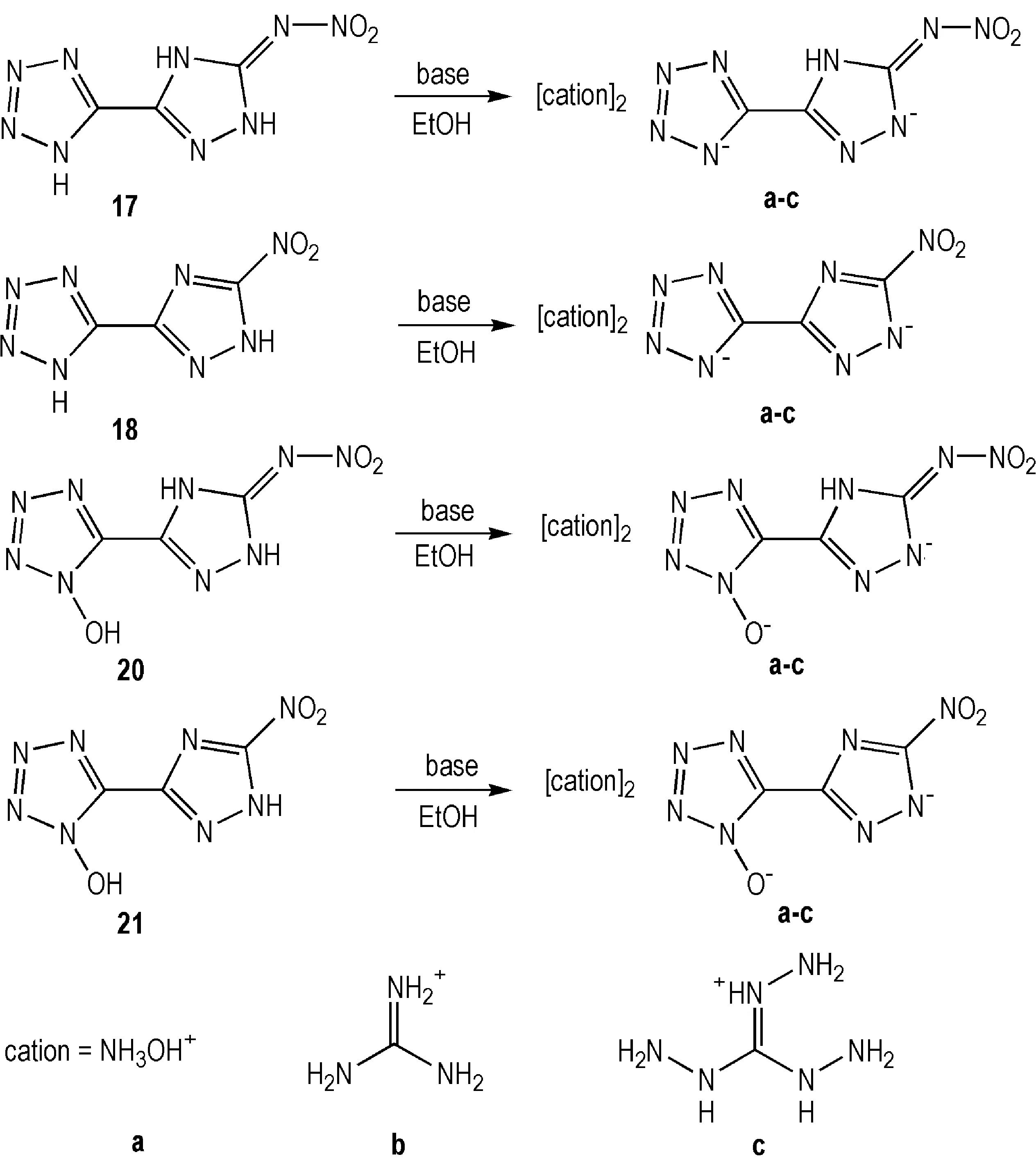
Dachs等[37]将化合物17、18、20和21分别离子化,在乙醇中与富氮阳离子结合形成12种含能离子盐(Scheme 14)。
与其母体相比,含能离子盐无论是在感度,还是能量密度等方面都有一定的改善。其中20a的理论爆速超过9000 m·s-1,理论爆压为293 kbar,撞击感度为8 J,摩擦感度为288 N,是潜在的高能钝感含能材料。
Scheme 12[35]
Scheme 13[36]
Scheme 14[37]
另外,从这一组含能离子盐的爆轰参数可以看出,提高化合物的氧平衡和N/H含量都能在一定程度上提高爆轰性能(部分化合物性质详见表4)。
5 结论与展望
5.1 结论
目前,研究人员通过改变取代基团以及引入不同的富氮阳离子,已合成出种类繁多的联唑类化合物及其含能离子盐,这些化合物在诸多性能上都表现出传统含能化合物所不具备的优势:
(1)因分子结构离域而具有平面结构,从而促进分子空间的紧密排布,得到高堆积密度的晶体结构,而且不同阳离子的引入更加强了氢键结构网络,因而具有低感度和高热稳定性;
(2)分解产物主要为氮气,具有低特征信号和环境友好的特点;
(3)1,2,4-三唑环和四唑环结构的生成焓较高,因而具有良好的爆轰性能;
(4)具有较多的化学修饰位点,通过引入不同基团或成盐等方式,可以合成出一系列物化性能变化范围较广的含能化合物。因而,联唑类化合物及其含能离子盐有望在新型炸药、低特征信号推进剂、气体发生剂、低烟或无烟烟火方面得到广泛的应用。在本文所介绍的化合物中,3j、5c和12已达到新型高能钝感含能化合物的标准(爆速>9000m·s-1,爆压>360 kbar,密度>1.90 g·cm-3,撞击感度>7 J和摩擦感度>120 N)[32],并与目前所广泛使用的RDX、HMX和CL-20等高能炸药相比,在原料成本、反应过程控制和爆轰产物对环境影响等方面更具优势,是理想的替代品。
表4 部分5-(3-1,2,4-三唑-)四唑类化合物性质与RDX的对比
Table 4 Properties of selected 5-(5-Azid-1H-1,2,4-triazol-3-yl)tetrazolates in comparison to RDX
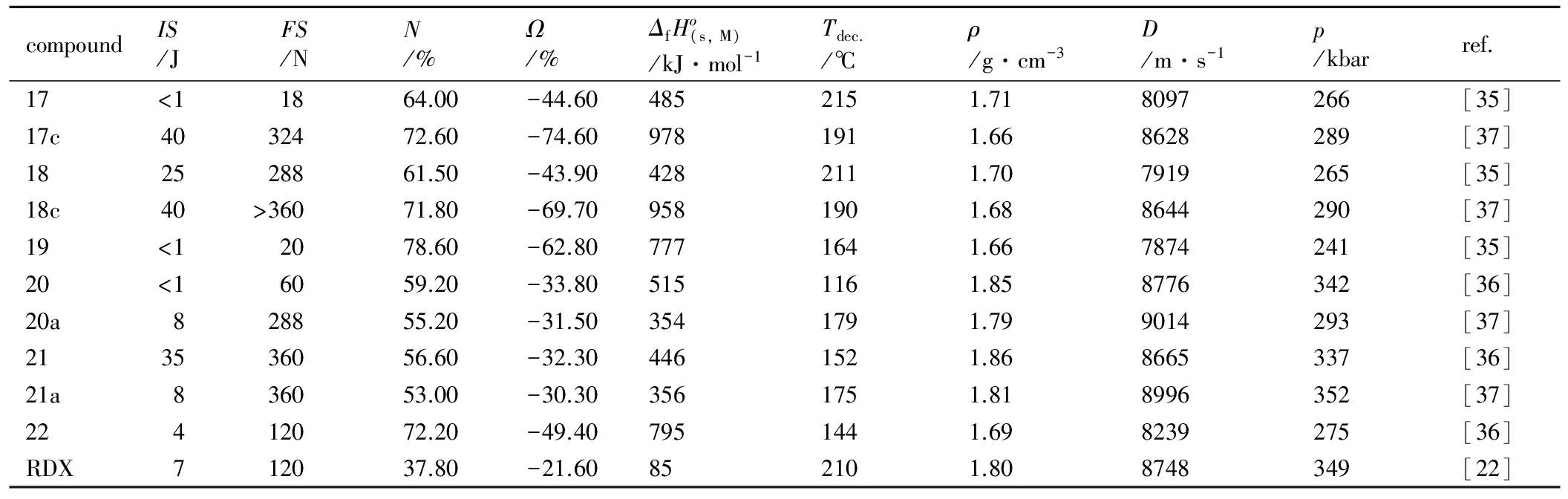
compoundIS/JFS/NN/%Ω/%ΔfHo(s,M)/kJ·mol-1Tdec./℃ρ/g·cm-3D/m·s-1p/kbarref.17<11864.00-44.604852151.718097266[35]17c4032472.60-74.609781911.668628289[37]182528861.50-43.904282111.707919265[35]18c40>36071.80-69.709581901.688644290[37]19<12078.60-62.807771641.667874241[35]20<16059.20-33.805151161.858776342[36]20a828855.20-31.503541791.799014293[37]213536056.60-32.304461521.868665337[36]21a836053.00-30.303561751.818996352[37]22412072.20-49.407951441.698239275[36]RDX712037.80-21.60852101.808748349[22]
5.2 展望
文中所列举的实例表明在一般情况下,富氮阳离子的引入对联唑类化合物爆轰性能的提高和感度的降低确有积极的影响,然而也存在某些富氮阳离子在与特定母体结合时,出现减弱爆轰性能及提高感度的现象,例如NH3OH+与化合物2、5和11等结合时,爆轰性能和感度都得到了极大的改善,但与3结合时,感度却显著提高。以现有知识体系很难对这一现象进行合理的解释,而且目前这一领域的研究尚未进一步展开。因而,为填补这一领域研究的空白,应借鉴共晶含能材料设计的经验[38-40],从晶体空间结构角度出发,对联唑类含能离子化合物爆轰性能和感度的变化规律进行理论研究[41-42]:(1)建立联唑类含能离子化合物的分子力场模型,收集物化参数并建立相应的数据库; (2)利用相关软件及组合原理等手段系统研究不同联唑类化合物与富氮阳离子之间的构效关系,为新型联唑类含能离子化合物的设计提供依据; (3)加强物化性能理论预估方面的研究,特别是开发出较为准确的感度预估方法[43]。
化合物1因其具有合成方法简单、良好的化学稳定性和热稳定性、芳香性的共平面结构以及较多的化学修饰位点等优点,是合成高能钝感含能化合物的优良反应母体。在上文所列举的合成方法中,有关1的合成反应主要针对1,2,4-三唑环上的5位—NH2进行硝化或取代反应而引入含能官能团,这样所得到的化合物种类较为有限。
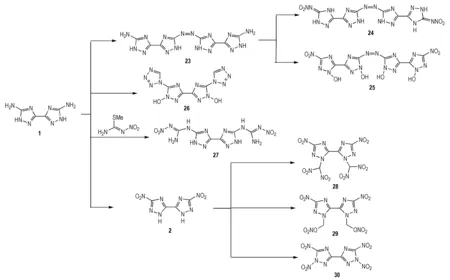
为进一步合成出综合性能更加优良的联唑类含能化合物,以1为母体设计了7种尚未见报道的新型联1,2,4-三唑类含能化合物(24-30) (Scheme 15):
(1) 1,2,4-三唑环5位—NH2发生偶氮反应得到23,进而再分别引入硝基和硝胺基,得到24和25[13,44-45]。
(2) 1,2,4-三唑环上5位—NH2可发生合环反应[26],从而在5位上引入两个四唑环,再使1位—NH发生氧化得到26[36]。
(3) 1,2,4-三唑的吸电子效应使5位—NH2具有负电性,使用1-硝基-S-甲基异硫脲作为亲电试剂(S-甲基异硫脲硫酸盐经硝化得到)进攻—NH2[2,46],得到27。
Scheme 15[37]
(4) 1引入硝基可得到2,1,2,4-三唑环1位的N—H键的反应活性将得到进一步增强,有利于亲电试剂溴丙酮的进攻,再在发生硝化反应,可在三唑环上引入偕二硝甲基,得到28[47]。
(5) 2可与甲醛发生亲核加成反应而引入羟甲基[48],再反应得到29。
(6) 由于N2O5对氮杂环上的N—H键的硝化有特殊的选择性[49],使用N2O5直接硝化2得到30。
化合物15的密度、爆轰性能和感度水平等物化性质虽然不如5,5-联四唑,但其2位的N—H键是理想的修饰位点,存在引入致爆基团或配位氧的可能,可以进一步提高综合性能; 另外从空间结构角度考虑,2位N—H键受相邻四唑环的位阻作用较弱,便于化学反应的进行。
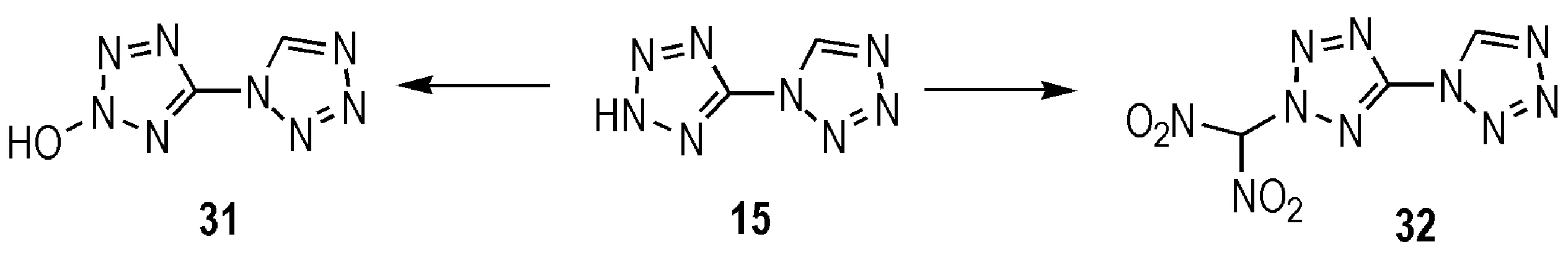
以15为母体设计了两种尚未见报道的新型联唑类含能化合物(31-32) (Scheme 16):
Scheme 16[37]
(1) 与5,5-联四唑类似,15发生氧化反应,从而在2位上引入羟基,得到31[10,27,31]。
(2) 2位的N—H表现出一定的酸性,有利于溴丙酮的进攻,从而引入丙酮基,再硝化得到32[47]。
以上两种化合物的氧平衡水平相比于15都得到了显著提高。
根据密度泛函理论(DFT),在B3LYP/6-31G**基组水平之上[50-51],对以上设计的新型含能化合物(24-32)进行结构优化,采用Monte-Carlo方法[52]、CBS-4M方法[53,54]以及Kamlet-Jacobs公式[55]对含能化合物的生成焓、密度、爆速和爆压等物化性质进行预估,数据见表5。
表5中的数据表明,所设计的大部分含能化合物均具有高密度、高氮含量、高氧平衡水平和高爆速等特点,其中28和30的综合性能最优,理论密度>1.95 g·cm-3,理论爆速>9500 m·s-1,理论爆压>400 kbar,而且达到零氧平衡水平,可作为下一步重点研究对象。
由于联唑类化合物的研究历程较短,在许多方面尚存在不足,下一步的工作重点为研究富氮阳离子对联唑类化合物的感度和爆轰性能的影响规律,以及进一步合成出综合性能更好的联唑类含能化合物。
表5 化合物24-32的预估性能
Table 5 Prediction of properties for 24-32
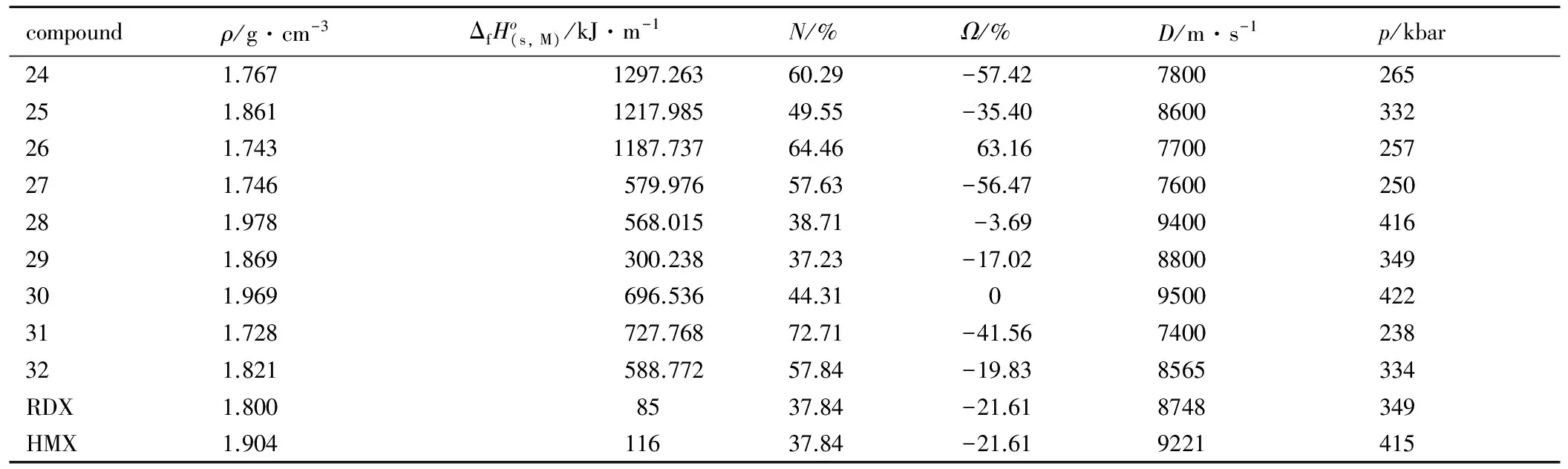
compoundρ/g·cm-3ΔfHo(s,M)/kJ·m-1N/%Ω/%D/m·s-1p/kbar241.7671297.26360.29-57.427800265251.8611217.98549.55-35.408600332261.7431187.73764.4663.167700257271.746579.97657.63-56.477600250281.978568.01538.71-3.699400416291.869300.23837.23-17.028800349301.969696.53644.3109500422311.728727.76872.71-41.567400238321.821588.77257.84-19.838565334RDX1.8008537.84-21.618748349HMX1.90411637.84-21.619221415
参考文献:
[1] 徐复铭,王泽山.重视创新,实现火炸药的跨越式发展[J].火炸药学报,2001,24(2):1-5.
XU Fu-ming,WANG Ze-shan.Stressing innovation for overleaping development of explosives and propellants[J].ChinJExplosPropell,2001,24(2),1-5.
[2] Wang R,Guo Y,Zeng Z,et al.Nitrogen-rich nitroguanidyl-functionalized tetrazolate energetic salts[J].ChemCommun,2009 (19):2697-2699.
[3] 毕福强,樊学忠,许诚,等.不敏感四唑非金属含能离子化合物的研究进展[J] .含能材料,2012,20(6):805-811.
BI Fu-qiang,FAN Xue-zhong,XU Cheng,et al.Review on insensitive non metallic energetic ion compound of tetrazolate anions[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2012,20(6):805-811.
[4] 李志敏,张建国,张同来,等.硝基四唑及其高氮化合物[J].化学进展,2010,22(4):639-647.
LI Zhi-min,ZHANG Jian-guo,ZHANG Tong-lai,et al.Nitro-tetrazole and its high nitrogen-contented compounds[J].ProgChem,2010,22(4):639-647.
[5] 李冠琼,李玉川,马巧丽,等.富氮唑环类化合物的环加成合成研究进展[J].有机化学,30(10):1431-1440.
LI Guan-qiong,LI Yu-chuan,MA Qiao-li,et al.Research progress in synthesis of nitrogen-rich zole-ring compounds by cycloaddition reaction[J].ChinJOrgChem,2010,30(10):1431-1440.
[6] 李亚南,唐婷,廉鹏,等.1,4-二氨基-3,6-二硝基吡唑[4,3-c]并吡唑的合成,热性能及量子化学研究[J] .有机化学,2012,32(3):580-588.
LI Ya-nan,TANG Ting,LIAN Peng,et al.Synthesis,Thermal performance and quantum chemistry study on 1,4-diamino-3,6-dinitropyrazolo [4,3-c] pyrazole [J] .ChinJOrgChem,2012,32 (3),580-588.
[7] Zhang Q,Shreeve J N M.Growing Catenated Nitrogen Atom Chains[J].AngewChemIntEd,2013,52 (34):8792-8794.
[8] Storm C,Hiskey M,Coburn M.An improved synthesis of 5-amino-3-nitro-1 H-1,2,4-triazole (ANTA),a useful intermediate for the preparation of insensitive high explosives[J].JenergMater,1991,9 (5):415-428.
[9] Östmark H,Bergman H,Åqvist G.The chemistry of 3-mtro-1,2,4-triazol-5-one (NTO):thermal decomposition [J].Thermochimacta,1993,213:165-175.
[10] Göbel M,Karaghiosoff K,Klapötke T M,et al.Nitrotetrazolate-2N-oxides and the strategy ofN-oxide introduction[J].JAmChemSoc,2010,132(48):17216-17226.
[11] Li Y C,Qi C,Li S H,et al.1,1′-Azobis-1,2,3-triazole:A high-nitrogen compound with stable N8 structure and photochromism [J].JAmChemSoc,2010,132 (35):12172-12173.
[12] Li S H,Shi H G,Sun C H,et al.Synthesis and Crystal Structure of Nitrogen-rich Compound:2,5,2′-triazido-1,1′-azo-1,3,4-triazole[J].JChemCrystallogr,2009,39(1):13-16.
[13] Dippold A A,Klapötke T M.Nitrogen-rich bis-1,2,4-triazoles-a comparative study of structural and energetic Properties[J].ChemEurJ,2012,18(52):16742-16753.
[14] Gao H,Shreeve J N M.Azole-based energetic salts[J].ChemRev,2011,111(11):7377-7436.
[15] Shreve R N.Charlesworth R K.5,5-diamino-1H,1H-3,3-bi-1,2,4-triazole:US 2744116[P],1956.
[16] Danoun G,Bayarmagnai B,Grünberg M F,et al.Sandmeyer Trifluoromethylation of Arenediazonium Tetrafluoroborates[J].JAngewChemIntEd,2013,52 (31):7972-7975.
[17] Dippold A A,Klapötke T M,Winter N.Insensitive nitrogen-rich energetic compounds based on the 5,5′-dinitro-3,3′-bi-1,2,4-triazol-2-ide qnion[J].Europeanjournalchemistry,2012,18(21):3474-3484.
[18] Wang R,Xu H,Guo Y,et al.Bis [3-(5-nitroimino-1,2,4-triazolate)]-based energetic salts:Synthesis and promising properties of a new family of high-density insensitive materials[J].JAmChemSoc,2010,132 (34):11904-11905.
[19] Petrie M A,Koolpe G,Malhotra R,et al.Performance-enhancing materials for future generation explosives and propellants [J].DTICDocument,2012,AN:ADA561743.
[20] Dippold A A,Klapötke T M.A Study of dinitro-Bis-1,2,4-triazole-1,1′-diol and derivatives-design of high performance insensitive energetic materials by the introduction of N-oxides[J].JAmChemSoc,2013:135(26),9931-9938.
[21] Dippold A A,Klapötke T M,Oswald M.Asymmetrically substituted 5,5′-bistriazoles-nitrogen rich materials with various energetic functionalities [J].Dalton Trans,2013,42:11136-11145.
[22] Meyer R,Homburg A.Explosives[M].Wiley.2007:156-157.
[23] Deschamps J R,Frisch M,Parrish D.Thermal expansion of HMX[J].JChemCrystallogr,2011,41(7):966-970.
[24] Nelson J H,Takach N E,Henry R A,et al.13C and15N nuclear magnetic resonance studies of selected tetrazoles:Relationships with the chemistry of tetrazoles[J].MagnResonChem,1986,24(11):984-994.
[25] Chavez D,Hiskey M,Naud D.High-nitrogen fuels for low-smoke pyrotechnics[J].JPyrotech,1999,10:17-36.
[27] Klapötke T M,Piercey D G,Stierstorfer J.The taming of CN7-:the azidotetrazolate 2-oxide anion[J].ChemEurJ,2011,17(46):13068-13077.
[28] Tselinskii I,Mel′nikova S,romanova T.synthesis and reactivity of carbohydroximoyl azides:I.aliphatic and aromatic carbohydroximoyl azides and 5-substituted 1-hydroxytetrazoles based thereon[J].RussJOrgChem,2001,37(3):430-436.
[29] 毕福强,樊学忠,许诚,等.1,1′-二羟基-5,5′-联四唑的合成及理论研究[J].火炸药学报,2013,36(4):22-25.
BI Fu-qiang,FAN Xue-zhong,XU Cheng,et al.Synthesis and theoretical study of 1,1′-dihydroxy-5,5′-bitetrazole[J].ChinJExplosPropell,2013,36(4):22-25.
[30] Fischer N,Fischer D,Klapötke T M,et al.Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].JMaterChem,2012,22(38):20418-20422.
[31] Fischer N,Gao L,Klapötke T M,et al.Energetic salts of 5,5′-bis (tetrazole-2-oxide) in a comparison to 5,5′-bis (tetrazole-1-oxide) derivatives[J].Polyhedron,2013,51:201-210.
[32] Klapötke T M,Sabaté C M.Bistetrazoles:nitrogen-rich,high-performing,insensitive energetic compounds[J].ChemMater,2008,20(11):3629-3637.
[34] Turcotte R,Vachon M,Kwok Q S,et al.Thermal study of HNIW (CL-20)[J].ThermochimActa,2005,433(1):105-115.
[35] Dippold A A,Klapötke T M.Synthesis and Characterization of 5-(1,2,4-Triazol-3-yl) tetrazoles with various energetic functionalities[J].ChemAsiaJ,2013,8(7):8463-8471.
[37] Dachs M,Dippold A A,Gaar J,et al.A comparative study on insensitive energetic derivatives of 5-(1,2,4-triazol-c-yl)-tetrazoles and their 1-hydroxy-tetrazole analogues[J].ZAnorgAllgChem,2013,630(12-13):2171-2180.
[38] Landenberger K B,Matzger A J.Cocrystals of 1,3,5,7-tetranitro-1,3,5,7-tetrazacyclooctane (HMX)[J].CrystGrowthDes,2012,12(7):3603-3609.
[39] Landenberger K B,Matzger A J.Cocrystal engineering of a prototype energetic material:supramolecular chemistry of 2,4,6-trinitrotoluene[J].CrystGrowthDes,2010,10(12):5341-5347.
[40] 林鹤,张琳,朱顺官,等.HMX/FOX-7共晶炸药分子动力学模拟[J].兵工学报,2012,33(9):1025-1030.
LIN He,ZHANG Lin,ZHU Shun-guan,et al.Molecular dynamic simulation of cyclotetramethylene tetranitramine /1,1-diamino-2.2-dDinitroethylene co-crystal explosive[J].JChinaOrdnance,2012,33(9):1025-1030.
[41] Shen J P,Duan X H,Luo Q P,et al.Preparation and characterization of a novel cocrystal explosive[J].CrystGrowthDes,2011,11(5):1759-1765.
[42] Rice B M,Hare J J.A quantum mechanical investigation of the relation between impact sensitivity and the charge distribution in energetic molecules[J].JPhysA:MathGen,2002,106 (9):1770-1783.
[43] 刘冬梅,赵丽,肖继军,等.不同温度下HMX和RDX晶体的感度判别和力学性能预估——分子动力学比较研究[J].高等学校化学学报,2013,34 (11):2558-2565.
LIU Dong-mei,ZHAO Li,XIAO Ji-jun,et al.Sensitivity criterion and mechanical properties prediction of HMX and RDX crystals at different temperatures-comparative study with molecular dymamics simulation[J].ChemJChinUniv,2013,34 (11):2558-2565
[44] Ye C,Xiao J C,Twamley B,et al.Energetic salts of azotetrazolate,iminobis (5-tetrazolate) and 5,5′-bis (tetrazolate)[J].ChemCommun,2005,21:2750-2752.
[45] Thottempudi V,Gao H,Shreeve J N M.Trinitromethyl-substituted 5-nitro-or3-azo-1,2,4-triazoles:synthesis,characterization,and energetic properties[J].JAmChemSoc,2011,133 (16):6464-6471.
[46] Fishbein L,Gallaghan J A.The preparation and reactions of 2-alkyl-1-(or 3)-nitro-2-thiopseudourea.Part I.reaction with amines[J].JAmChemSoc,1954,76 (7):1877-1879.
[47] 张敏,葛忠学,毕福强,等.2-偕二硝甲基-5-硝基四唑的合成与性能[J].含能材料,2013,21(5):688-690.
ZHANG Min,GE Zhong-xue,BI Fu-qiang.Synthesis and perfomance of 2-dinitromethyl-5-nitrotetrazole[J].ChinJEnergMater(HannengCailiao),2013,21(5):688-690.
[48] Li Y,Liu W,Pang S.Synthesis and characterization of 5-nitro-2-nitratomethyl-1,2,3,4-tetrazole:a high nitrogen energetic compound with good oxygen balance[J].Molecules,2012,17 (5):5040-5049.
[49] 何志勇,罗军,吕春绪,等.N2O5硝解DPT制备HMX[J].火炸药学报,2010,33(2):1-4.
HE Zhi-yong,LUO Jun,LV Chun-xu,et al.Synthesis of HMX from DPT by green nitrolysis with dinitrogen pentoxide[J].ChinJExplosPropell,2010,33(2):1-4.
[50] Del Bene J E,Person W B,Szczepaniak K.Properties of hydrogen-bonded complexes obtained from the B3LYP functional with 6-31G(d,p) and 6-31+ G(d,p) basis Sets:comparison with MP2/6-31+G(d,p) results and experimental data[J].JPhysChem,1995,99(27):10705-10707.
[51] Slanina Z,Uhlík F,Zhao X,et al.Enthalpy-entropy interplay for C36 cages:B3LYP/6-31G*calculations[J].JChemPhys,2000,113(12):4933-4937.
[52] Pastore S,Wiringa R,Schiavilla R,et al.Quantum Monte Carlo calculations of electromagnetic transitions in8Be with meson-exch-ange currents derived from chiral exective field theory[J].BullAmPhysSoc,2014,59(5):5-8.
[53] Wu Q,Zhu W,Xiao H.Theoretical design of energetic nitrogen-rich derivatives of 1,7-diamino-1,7-dinitrimino-2,4,6-trinitro-2,4,6-triazaheptane[J].JMolModel,2013,19(8):2945-2954.
[54] Dobek F J,Ranasinghe D S,Throssell K,et al.Evaluation of the heats of formation of corannulene and C60 by means of Inexpensive theoretical procedures[J].JPhysChemA,2013,117(22):4726-4730.
[55] Zhang Y,Wang J,Xue D G.A DFT study of cage compounds:3,5,8,10,11,12-hexanitro-3,5,8,10,11,12-hexaazatetracyclo [5.5.1.12,6.04,9] dodecane and its derivatives as high energetic materials[J].StructChem,2013,24(4):1339-1346.
