太湖3个典型水域红鳍原鲌(Cultrichthyserythropterus)δ13C和δ15N值的变化规律*
2015-05-10王晓玲徐东坡段金荣施炜纲
王晓玲,徐东坡,刘 凯,段金荣,施炜纲,
(1:南京农业大学无锡渔业学院,无锡 214081)
(2:农业部长江下游渔业资源环境科学观测实验站,中国水产科学研究院淡水渔业研究中心,无锡214081)
太湖3个典型水域红鳍原鲌(Cultrichthyserythropterus)δ13C和δ15N值的变化规律*
王晓玲1,徐东坡2,刘 凯2,段金荣2,施炜纲1,2**
(1:南京农业大学无锡渔业学院,无锡 214081)
(2:农业部长江下游渔业资源环境科学观测实验站,中国水产科学研究院淡水渔业研究中心,无锡214081)
运用稳定性同位素分析技术研究红鳍原鲌δ13C和δ15N值变化规律,进一步探讨贡湖湾、鲤山湾和东太湖3个典型水域的红鳍原鲌食性差异.结果显示,红鳍原鲌的δ13C值与体长、δ15N值与体长呈显著正相关关系,大个体的红鳍原鲌(体长>138mm)δ13C值和营养级显著高于小个体红鳍原鲌(体长<138mm),表明红鳍原鲌在生长过程中随着口裂的增大和捕食能力的加强发生了食性转变现象:食物来源由小型浮游动物向鱼类转变.红鳍原鲌的δ13C在3个水域中具有明显的空间异质性,东太湖(-25.17‰±2.56‰)作为养殖活动影响区均显著低于贡湖湾(-23.11‰±1.05‰)和鲤山湾(-22.73‰±1.31‰),而且个体普遍偏小,说明红鳍原鲌种群分布可能存在一定的区域性,会根据栖息环境选择食物来源.红鳍原鲌在高浓度蓝藻的环境下,偏向摄食较大个体的动物性饵料,减轻对浮游动物的摄食压力,间接控制水体富营养化的发展.另外,还讨论了红鳍原鲌对生态系统的影响,为其资源保护和合理配置利用提供理论依据.
太湖;红鳍原鲌;δ13C;δ15N;体长;营养级位置
红鳍原鲌(Cultrichthyserythropterus)属于鲤形目(Cypriniformes),鲤科(Cyprinidae),鲌亚科(Culterinae),原鲌属(Culterichthys)[1-2],头部较小,头后背部显著隆起,背鳍起点距尾柄基部距离近于吻端,口上位,多栖息于水生植物较多的湖泊中[3].鲌鱼作为湖泊、水库的重要顶级消费者,对鱼类和其他生物群落具有重要调控作用,特别是近年来,红鳍原鲌的种群和数量随着许多湖泊、河流水体中鱼类区系的改变而发生了极大的变化,其生物学特性和在渔业中的作用也越来越受到关注[4].
在鱼类生态学中,食性研究能够揭示鱼类群体的行动规律和种群的数量变动[5],消化道分析法对食性的研究是应用最为广泛的方法,其优点在于能够准确直观地反映鱼类所摄食饵料组成和分类特征[6],但是消化道分析法只能体现捕食者短时期内的摄食情况[7],不能全面有效地反映捕食者长期的食物来源.近年来,稳定性同位素分析技术被应用在许多研究领域,并且在水生生态领域研究中被广泛运用.稳定同位素的优点是从生物内部特征反映化学、物理及生物作用对生物体的影响过程,在水生生态系统中研究生物追踪、宿主和寄生虫的关系等[8-10].另外在河流生态系统中,运用稳定性C、N同位素分析技术研究河流富营养化的污染源、河流体系中的营养行为[11]等.稳定同位素在食物链和动物迁移的分析研究中是一个强大的工具[12],通常消费者中的13C价值标准被认为比它们的食物高1‰,因此它能够提供能量和营养物质来源有关的信息[13];另一方面,不同生物对15N富集程度不同[14],这能够进行营养级位置的评估[8].
太湖是典型的大型浅水富营养湖泊[15],红鳍原鲌作为太湖的传统经济鱼类具有一定的捕捞量,鱼类相对重要性指数值(IRI)排第8位(40.4)[16].到目前为止,红鳍原鲌食性研究仅见传统消化道法的分析[17],被证明是杂食性鱼类,红鳍原鲌食性空间异质性的研究还未见报道.本文运用稳定性同位素技术对太湖鲤山湾保护区、东太湖养殖区和贡湖湾饮水开放区3个典型水域的红鳍原鲌δ13C和δ15N值进行分析,比较红鳍原鲌食性在这3个水域的差异性,探讨红鳍原鲌种群结构变化对湖泊生态系统的影响,为其资源保护和合理配置利用提供理论依据.
1 材料和方法
1.1 研究水域概况
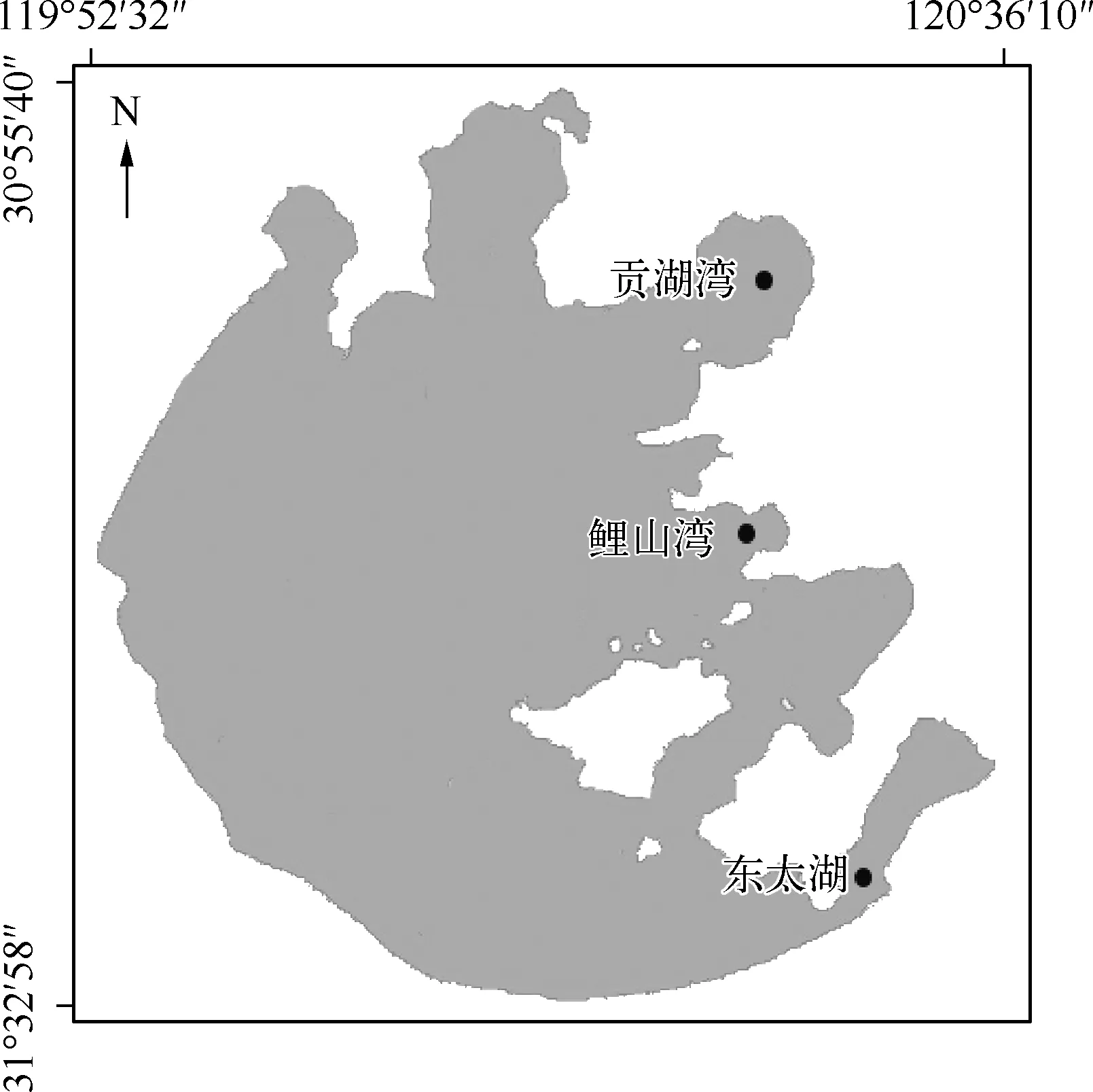
图1 太湖红鳍原鲌采样点分布Fig.1 Sampling sites distribution of Cultrichthys erythropterus in Lake Taihu
本研究依据不同的水质环境和地理位置,在太湖3个不同的典型生境选取采样点(图1).贡湖湾是太湖东北部的湖湾,为饮水开放区,面积150km2,水深1.8m,水生植物贫乏,属半草型生态系统,为轻度富营养[18].东太湖位于东山半岛的东南面,有大面积的围网养殖,是草型生态系统,水体富营养化程度较轻[19].鲤山湾作为保护区,沉水植物丰富,水质较好.3个典型的水域能较好地反映红鳍原鲌在不同生存环境中的食性特征.
1.2 样品采集及实验处理
2013年6-7月在3个水域利用刺网采集红鳍原鲌.在鲜活状态下进行生物学测量,筛选不同体长范围的红鳍原鲌进行解剖,取背部白肌,白肌中脂肪含量极低,去脂与否对δ13C和δ15N值富集度影响不大[20].每个地点利用地笼网采集铜锈环棱螺(Bellamyaaeruginosa),取腹足肌肉,并用蒸馏水冲洗干净.全部样品放入培养皿中在60℃下烘干48h至恒重.用研钵把各种样品研磨成均一粉末,放入离心管中,置入干燥器保存待测.
用于统计分析的红鳍原鲌标本共计344尾,其中用于稳定性同位素分析的标本共67尾.
1.3 稳定同位素分析
所有样品的稳定同位素δ13C、δ15N均在国家海洋局第三海洋研究所测定,由同位素比率质谱仪(Delta V advantage)与元素分析仪(Flash EA 1112 HT)耦合而成.13C和15N的比值公式为:
δX(‰)=(Rsample/Rstandard-1)×1000
(1)
式中,X为13C或15N,R为同位素比值13C/12C或15N/14N,Rsample为所测的同位素比值,Rstandard为标准物质的同位素比值.C的同位素比值参考的标准物质为国际标准美洲箭石VPDB(Vienna Pee Dee Belemnite)的C同位素丰度,N的同位素比值参考的标准物质为标准大气N同位素丰度.每测定10个样品插入1个标准样品,并随机挑1~2个样品进行复测,δ13C和δ15N值重复测量的标准误差分别小于0.2‰和0.3‰.
Post等证明了2种初级消费者——滤食贝类和螺类的稳定性同位素含量能够在水生生态系统中作为基线值,准确估算更高级别消费者的营养位置[8,21],本实验采用初级消费者铜锈环棱螺作为基线生物,其15N作为基线值.根据生物对基线生物N稳定同位素比值的相对值计算该生物的营养级,公式为:
TLconsumer=λ+(δ15Nconsumer-δ15Nbaseline)/Δδ15N
(2)
式中,TLconsumer为消费者的营养级;λ=2;δ15Nconsumer为红鳍原鲌N稳定性同位素比值;δ15Nbaseline为铜锈环棱螺N稳定性同位素比值;Δδ15N为一个营养级的N稳定同位素富集度,通常取值3.4‰[8].
1.4 统计分析
采用Excel 2013和SPSS 19.0软件进行统计分析.用偏相关分析方法对红鳍原鲌肌肉中δ13C和δ15N与体长的关系进行相关性分析,通过单因子方差分析方法对红鳍原鲌肌肉中δ13C和δ15N值在不同水域的差异性进行分析[22],地点作为因子,肌肉中δ13C和δ15N值作为因变量,对红鳍原鲌时间序列和空间位置上的分布特征与食性进行相关分析,可以探究食性在季节和空间上的变化规律.
2 结果与分析
2.1 红鳍原鲌体长与体重的关系
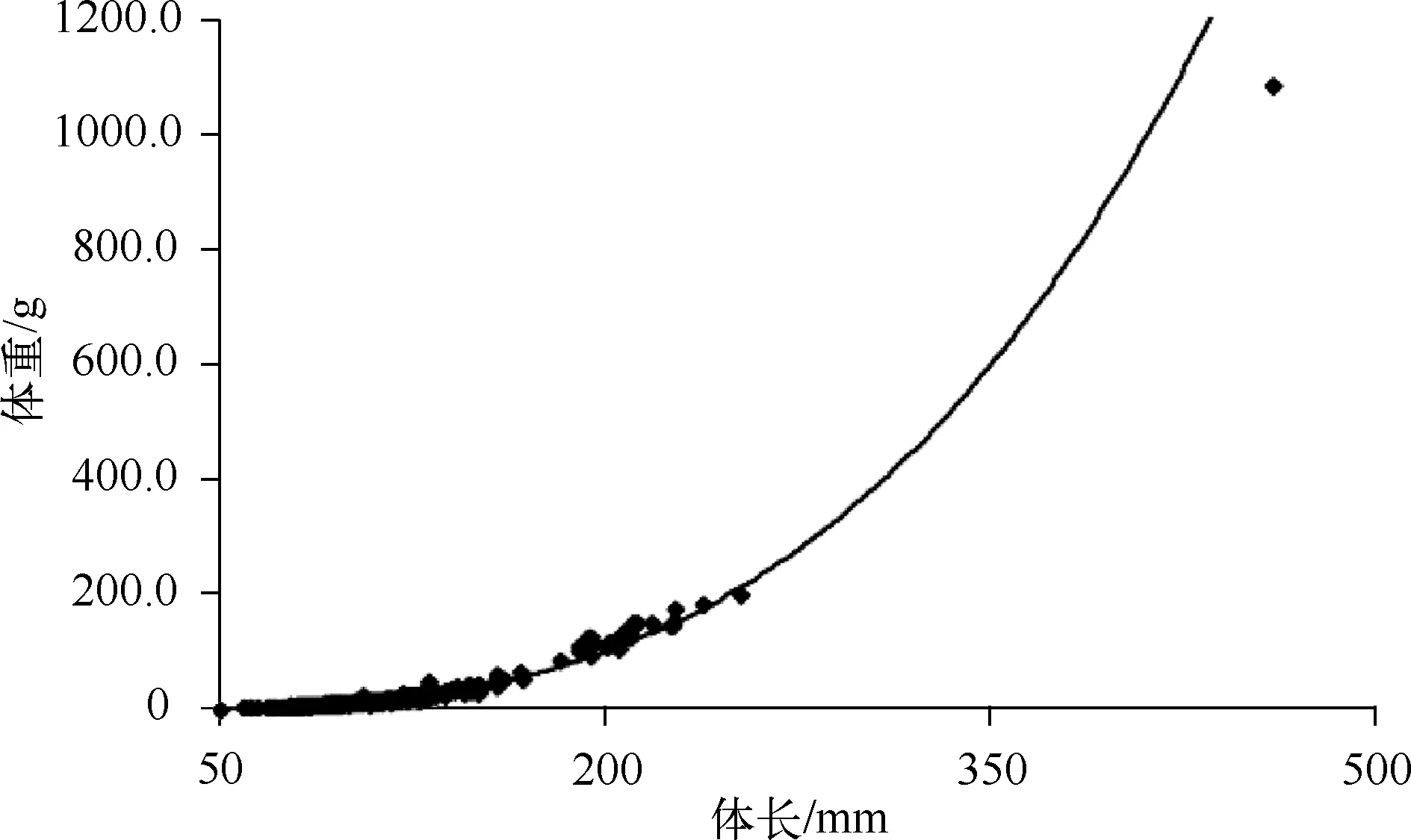
图2 红鳍原鲌体长与体重的关系(n=344)Fig.2 Relationship between the weight and length of Cultrichthys erythropterus based on 344 samples
对344条红鳍原鲌进行生物学测量,红鳍原鲌体长范围为51.38~570.00mm,体重范围为1.4~1079.5g.红鳍原鲌体长与体重之间呈现幂函数增长关系(图2),用W=aLb表示[23],根据每条红鳍原鲌的体长和相应体重求得关系式:W=5×10-6L3.1901(R2=0.9795,P<0.01).
2.2 红鳍原鲌δ13C和δ15N与体长的关系
结合偏相关分析方法对67个红鳍原鲌肌肉样品δ13C、δ15N值与体长进行分析(图3),可知红鳍原鲌δ13C值与体长呈极显著正相关(P<0.01);红鳍原鲌δ15N值与体长呈显著正相关(P<0.05);红鳍原鲌δ13C与δ15N值相关性显著(P<0.05).
以20mm为体长间隔,将38.00~257.00mm体长范围的红鳍原鲌分为11组,体长>258.00mm的红鳍原鲌作为1组.由图4a可知,贡湖湾红鳍原鲌δ13C值与体长呈显著正相关(R2=0.518,P<0.05),体长<138mm的个体δ13C值明显偏低,平均值为-23.91‰,体长>138mm的个体δ13C平均值为-22.55‰,两者差异极显著(P<0.01);δ15N值随着体长变化,体长<138mm的个体δ15N平均值为18.18‰,体长>138mm的个体δ15N平均值为18.71‰,两者差异不显著(P>0.05).
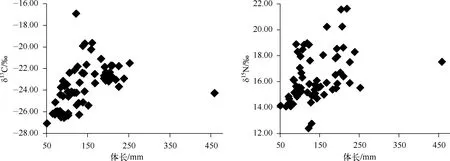
图3 红鳍原鲌δ13C和δ15N值与体长的关系(n=67)Fig.3 Relationships between δ13C, δ15N values and length of Cultrichthys erythropterus based on 67 samples
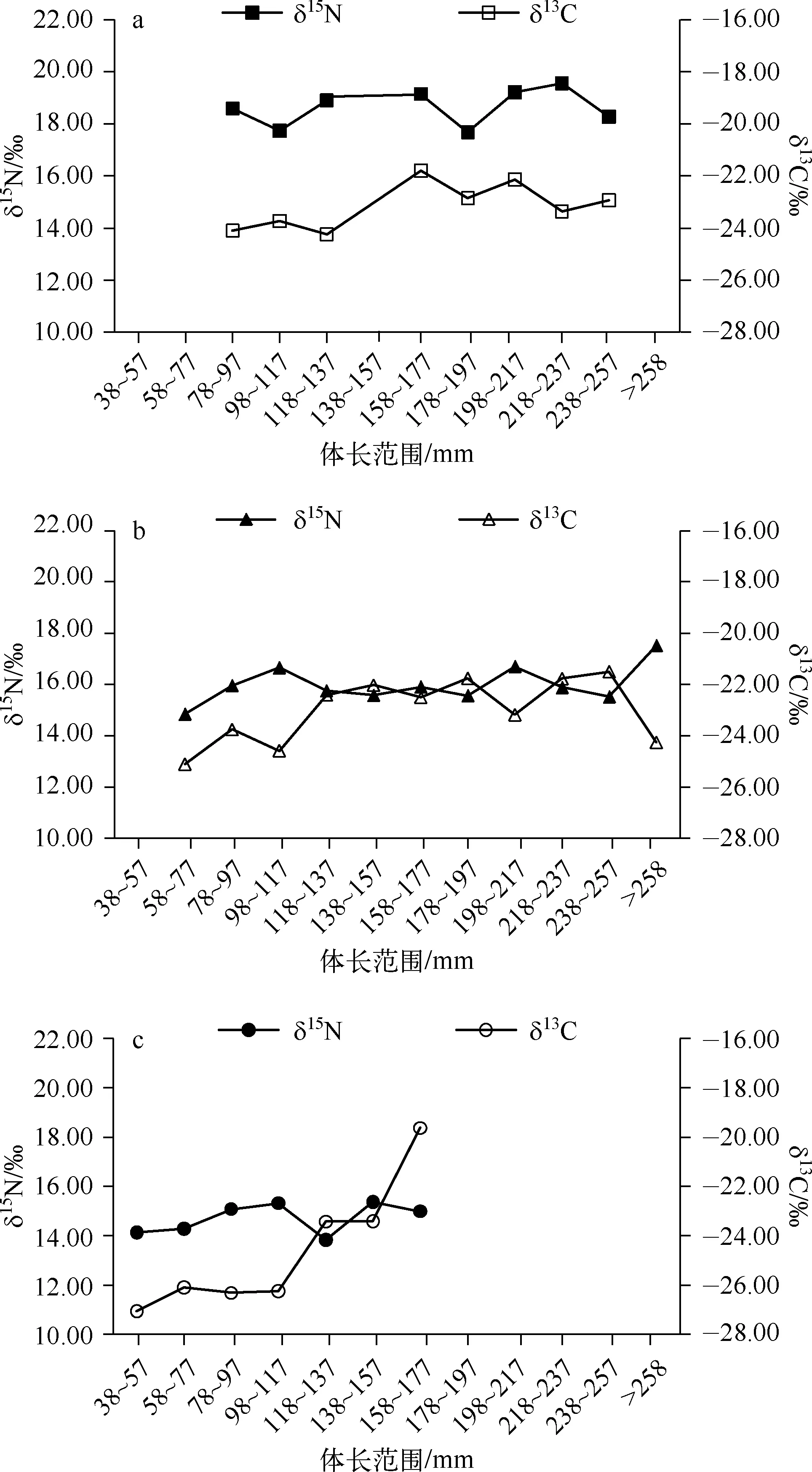
图4 贡湖湾(a)、鲤山湾(b)和东太湖(c)红鳍原鲌δ13C和δ15N值与体长的变化关系Fig.4 Variation in δ13C and δ15N values and length of Cultrichthys erythropterus in Gonghu Bay(a), Lishan Bay(b) and east Lake Taihu(c)
鲤山湾红鳍原鲌δ13C值基本随着体长的增加而增加,体长<138mm个体的δ13C平均值为-23.40‰,体长>138mm的个体δ13C平均值为-22.22‰,两者之间差异显著(P<0.05),体长为459.00mm的个体δ13C平均值为-24.27‰,明显低于其他个体的δ13C平均值;δ15N值与体长呈正相关,体长<138mm个体的δ15N平均值为18.18‰,体长>138mm个体的δ15N平均值为18.71‰,两者之间差异不显著(P>0.05),体长为459.00mm个体的δ15N值为17.53‰(图4b).
东太湖红鳍原鲌δ13C值与体长呈极显著正相关(R2=0.580,P<0.01),体长<138mm个体的δ13C平均值为-25.71‰,体长>138mm个体的δ13C平均值为-22.47‰,两者之间差异显著(P<0.05);δ15N值随着体长变化趋势不明显,体长<138mm的个体δ15N平均值为14.62‰,体长>138mm的个体δ15N平均值为15.26‰(图4c),两者差异不显著(P>0.05).
2.3 红鳍原鲌δ13C和δ15N的空间分布特征
贡湖湾红鳍原鲌的δ13C平均值为-23.11‰±1.05‰,鲤山湾红鳍原鲌δ13C平均值为-22.73‰±1.31‰,东太湖红鳍原鲌δ13C平均值为-25.17‰±2.56‰,3个水域δ13C值差异极显著(P<0.01).在相同体长范围内,鲤山湾和贡湖湾红鳍原鲌δ13C值无明显差异,东太湖最低;贡湖湾红鳍原鲌的δ15N值明显偏高,鲤山湾次之,东太湖最低(图4).
2.4 红鳍原鲌营养级
贡湖湾铜锈环棱螺δ15N值最高(15.49‰),鲤山湾(11.43‰)和东太湖(11.50‰)的δ15N值相近.根据样本红鳍原鲌δ15N值以及营养级的计算公式,计算得出贡湖湾红鳍原鲌营养级为2.65~3.20,平均值为2.93;鲤山湾红鳍原鲌营养级为3.00~3.79,平均值为3.34;东太湖红鳍原鲌营养级为2.69~3.14,平均值为2.95.3个水域红鳍原鲌的营养级基本随着体长的增加而增大(图5).在相同体长范围内,鲤山湾红鳍原鲌营养级与其他水域呈极显著差异(P<0.01),明显偏高,东太湖和贡湖湾无显著差异(P>0.05).

图5 贡湖湾、鲤山湾和东太湖红鳍原鲌营养级的空间变化Fig.5 Spatial variations in trophic level of Cultrichthys erythropterus in Gonghu Bay, Lishan Bay and east Lake Taihu
3 讨论
3.1 红鳍原鲌δ13C和δ15N随体长的变化规律
在同一水域,红鳍原鲌δ13C值随着体长的增加而变大(图3、4),大个体(体长>138mm)的δ13C和δ15N值与小个体(体长<138mm)的差异显著(P<0.05),说明红鳍原鲌的食物来源发生了转变.周德勇等[17]和陈银瑞等[4]分别对太湖梅梁湾和云南滇池的红鳍原鲌消化道进行分析,发现红鳍原鲌的食物组成随体长增加变化明显,体长<130mm的红鳍原鲌主要摄食枝角类和虾,体长>130mm的红鳍原鲌主要摄食小型鱼类和虾,食物来源由小型浮游动物向鱼类转变.稳定性同位素法和消化道分析法相结合,进一步证明红鳍原鲌是杂食性鱼类.鲌属鱼类的成鱼一般生活在敞水区的中上层,幼鱼一般在水流缓慢的浅水区活动[24],红鳍原鲌种群分布也有可能存在这种现象,成鱼和幼鱼会根据栖息环境选择食物来源.另外,个体在不同发育阶段的食物组成和摄食量存在很大差异[25],红鳍原鲌摄食强度在产卵繁殖期6-7月减弱[26],食性发生转换.红鳍原鲌口裂会随着体长的增加而相应增大[17],在激烈的种间竞争和较强的种内竞争双重作用下,其捕食能力也逐渐增强,会选择较大的浮游动物或者小型鱼虾等大个体的食物以获得更多的净能量来满足生长需求.对不同体长范围红鳍原鲌食性进行研究可以加深了解其种群结构变化对湖泊食物网结构和生态系统的影响,同时为其生物调控提供参考.
3.2 不同水域红鳍原鲌营养级的变化规律
大型底栖动物螺、贝类因生命周期较长,迁移能力差,机体组织周转率低[27-28],在水生生态系统中常做基线值.研究结果显示,铜锈环棱螺δ15N值在3个区域间有空间异质性,贡湖湾的铜锈环棱螺δ15N值远大于鲤山湾和东太湖,鲤山湾与东太湖的δ15N值较低而且无显著差异.这种差异性可能是贡湖湾较其他2个水域接纳了较多人类活动所产生的高δ15N值污染物所致[29];另外也有可能与铜锈环棱螺所摄取的食物有关,贡湖湾已由草型生态系统向藻型生态系统转变,鲤山湾和东太湖都属于草型生态系统,铜锈环棱螺可能根据栖息环境选择摄食了较多的水生植物碎屑.3个水域的研究结果显示,红鳍原鲌的营养级基本随着体长的增加而增加,大个体与小个体相差0.79个营养级,说明大个体偏向摄食较大的动物性饵料,或者较大的动物性饵料在食物组成中所占的比例较大,反映出大个体捕食能力的增强.鲤山湾红鳍原鲌的营养级最高,说明饵料资源丰富,食物网复杂程度显著高于其他水域.3个水域红鳍原鲌营养级具有明显的空间异质性.
3.3 不同水域红鳍原鲌δ13C的变化规律
贡湖湾和鲤山湾红鳍原鲌δ13C差异不显著,说明红鳍原鲌的食物组成相似,食物来源接近.鲤山湾保护区红鳍原鲌种群个体分布比较均匀,种群资源保护成效显著.东太湖捕获的红鳍原鲌个体偏小,种群资源明显趋于小型化,这可能与东太湖水域中围网养殖或者渔船作业影响其摄食有关;另一方面,红鳍原鲌的种群分布可能存在一定的区域性,小个体的红鳍原鲌可能在此区域面临的生存压力较小.东太湖红鳍原鲌的δ13C值明显偏低,表明此区域红鳍原鲌碳源与其他区域差异较大,反映出生存环境中的食物组成可能不同,红鳍原鲌摄食在此生存环境的优势群体或者更易捕食的群体以更好地适应生存环境;也可能围网养殖区域人工投饵残渣被红鳍原鲌或者其饵料鱼所摄食,进而影响同位素比值.红鳍原鲌的食性与其捕食能力有关,另外也与不同生境中饵料的种类有密切关系[17,30].
为了解太湖鱼类群落结构和多样性的分布特征,毛志刚等[16]和沈振华等[31]对太湖水域的鱼类资源进行调查,发现太湖鱼类的物种数量下降,渔业资源小型化趋势明显,对浮游动物形成巨大的捕食压力,浮游动物的减少加速了太湖蓝藻的暴发[32].红鳍原鲌捕食对象主要为麦穗鱼(Pseudorasboraparva)和鮈亚科鱼类等,它对小杂鱼的发展具有一定的抑制作用[26,33].红鳍原鲌可通过增加对小型鱼类的摄食强度及生态位的竞争来减小对浮游动物的捕食压力,另外陈银瑞等[4]发现红鳍原鲌能影响太湖新银鱼的资源变动,而且能减轻鲢、鳙等滤食性鱼类面临的生态位竞争,增强控藻效果[34].水环境因子的季节变化会影响水体中饵料资源的分布与丰度,进而影响高营养级鱼类的摄食[35],因此对不同季节内红鳍原鲌食性的转变有待进一步研究.
大型鲌鱼是太湖的主要肉食性鱼类,随着翘嘴鲌(Culteralburnus)、蒙古鲌(C.mongolicus)等大型凶猛鱼类的过量捕捞和产卵场破坏[36],红鳍原鲌种群发展迅速,在数量和分布上发生了很大的变化.红鳍原鲌的人工繁殖技术已逐渐成熟[37],其粗蛋白含量和必须氨基酸含量显著高于翘嘴鲌[38],属于高蛋白低脂肪营养价值高的优质鱼类.因此对红鳍原鲌的深度开发利用不仅有较高的经济价值,而且能充分发挥其调整鱼类种间关系的生态功能.积极采取增殖保护措施,通过合理的驯化和选育,可以减小捕捞压力,进一步开发红鳍原鲌资源.
致谢:感谢江苏省太湖渔业管理委员会办公室渔政大队同志在采样过程中的协助,感谢南京农业大学2011级本科生在样品处理过程中的帮助,感谢徐东坡副研究员对实验的帮助和指导.
[1] 陈宜瑜.中国动物志·硬骨鱼纲·鲤形目(中卷).北京:科学出版社,1998: 182-183.
[2] 罗云林.鲌属和红鲌属模式种的订正.水生生物学报,1994,18(1): 45-49.
[3] 冯广朋,谢从新,李钟杰等.湖北牛山湖红鳍原鲌的个体生殖力.水利渔业,2006,26(2): 42-43.
[4] 陈银瑞,杨君兴,周 伟等.滇池红鳍原鲌生物学及对太湖新银鱼渔业的影响.动物学研究,1994,15(增刊): 88-95.
[5] 薛 莹,金显仕.鱼类食性和食物网研究评述.海洋水产研究,2003,24(2): 76-86.
[6] Cortes E. A critical review of methods of studying fish feeding based on analysis of stomach contents: applications to elasmobranch fishes.CanadianJournalofFisheriesandAquaticSciences, 1997, 54(3): 726-738.
[7] Landry MR, Peterson WK, Fagerness VL. Mesozooplankton grazing in the Southern California Bight. I. Population abundances and gut pigment contents.MarineEcologyProgressSeries, 1994, 115: 55-71.
[8] Post DM. Using stable isotopes to estimate trophic position:models, methods, and assumptions.Ecology, 2002, 83(3): 703-718.
[9] Navarro J, Coll M, Louzao Metal. Comparison of ecosystem modelling and isotopic approach as ecological tools to investigate food webs in the NW Mediterranean Sea.JournalofExperimentalMarineBiologyandEcology, 2011, 401(1/2): 97-104.
[10] Faye D, Tito De Morais L, Raffray Jetal. Structure and seasonal variability of fish food webs in an estuarine tropical marine protected area(Senegal): Evidence from stable isotope analysis.Estuarine,CoastalandShelfScience, 2011, 92(4): 607-617.
[11] 蔡德陵,李红燕.稳定碳、氮同位素在河流系统研究中的应用.海洋科学进展,2004,22(2): 225-232.
[12] Grey J, Thaekeray S, Jones R. Ferox trout(Salmotrutta)as ‘Russian dolls’: complementary gut content and stable isotope analyses of the Loch Ness food web.FreshwaterBiology, 2002, 47(7): 1235-1243.
[13] Peterson B, Fry B. Stable isotopes in ecosystem studies.AnnualReviewofEcologyandSystematics, 1987, 18: 293-320.
[14] 卢伙胜,欧 帆,颜云榕等.应用氮稳定同位素技术对雷州湾诲域主要鱼类营养级的研究.海洋学报,2009,31(3): 167-174.
[15] 林 琳,吴敬禄,曾海鳌等.人类活动对太湖水环境影响的稳定氮同位素示踪.湖泊科学,2012,24(4): 546-552. DOI 10.18307/2012.0407.
[16] 毛志刚,谷孝鸿,曾庆飞等.太湖鱼类群落结构及多样性.生态学杂志,2011,30(12): 2836-2842.
[17] 周德勇,叶佳林,王卫民等.太湖梅梁湾红鳍原鲌(Cultrichthyserythropterus)食性与个体大小的关系:对生物调控与管理的启示.湖泊科学,2011,23(5): 796-800. DOI 10.18307/2011.0519.
[18] 甘升伟,张红举,冯赟昀.无锡水源地贡湖饮水改善水质效果分析.人民长江,2012,43(5): 72-75.
[19] 瞿文川,王苏民,张平中等.生物标志化合物对东、西太湖不同湖泊类型的判识.海洋与湖沼,2000,31(5): 530-534.
[20] Mccutchan JJH, Lews V, Kendall C. Variation in trophic shift for stable isotope ratios of carbon, nitrogen,and sulfur.Oikos, 2003, 102(2): 378-390.
[21] Post DM, Layman CA, Arrington DAetal. Getting to the fat of the matter: models, methods and assumptions for dealing with lipids in stable isotope analyses.Oecologia, 2007, 152(1): 179-189.
[22] Xu J, Zhang M, Xie P. Stable isotope changes in freshwater shrimps(ExopalaemonmodestusandMacrobrachiumnipponensis): trophic pattern implications.Hydrobiologia, 2008, 605: 45-54.
[23] 邵 力,郏国生,卢建伟等.四明湖水库翘嘴红鲌年龄和生长的研究.浙江水产学院学报,1990,9(2): 95-102.
[24] 覃 亮,熊邦喜,王基松等.鲌属鱼类在天然水域中的生态功能及资源增殖对策.湖北农业科学,2009,48(1): 233-236.
[25] 于谨磊,何 虎,李宽意等.太湖贡湖湾鲚(CoiliaectenestaihuensisYen et Lin)食物组成的季节变化.湖泊科学,2012,24(5): 765-770. DOI 10.18307/2012.0518.
[26] 车玉春.尚屯水库红鰭鲌的生物学.淡水渔业,1978,(4): 16-22.
[27] Zabden M, Rasmussen J. Primary consumer δ13C and δ15N and the trophic of position of aquatic consumers.Ecology, 1999, 80(4): 1395-1404.
[28] Vizzini S, Mazzola A. The effects of anthropogenic organic matter inputs on stable carbon and nitrogen isotopes in organisms from different trophic levels in a southern Mediterranean coastal area.ScienceoftheTotalEnvironment, 2006, 368(2/3): 723-731.
[29] 何 虎,于谨磊,章 铭等.太湖不同湖湾中铜锈环棱螺(Bellamyaaeruginosa)的氮稳定性同位素特征.湖泊科学,2012,24(2): 282-286. DOI 10.18307/2012.0217.
[30] Keast A. Trophic and spatial interrelationships in the fish species of an Ontario temperate lake.EnvironmentalBiologyofFishes, 1978, 3(1): 7-31.
[31] 沈振华,杨建忠,毛志刚等.太湖渔获物资源分析及渔业管理.安徽农业科学,2014,42(1): 117-120.
[32] 谷孝鸿,朱松泉,吴林坤等.太湖自然渔业及其发展策略.湖泊科学,2009,21(1): 94-100. DOI 10.18307/2009.0112.
[33] 杨瑞斌,谢从新,杨学芬.梁子湖6种凶猛鱼食物组成的研究.水利渔业,2002,22(3): 1-3.
[34] 胡海彦,狄 瑜,赵永峰等.蠡湖4种鲌鱼形态特征的比较研究.云南农业大学学报,2011,26(4): 488-494.
[35] 沙永翠,张培育,张 欢等.栖息地环境对种群营养生态位影响的研究——以黄颡鱼为例.生态学报,2015,35(5): 1-12.
[36] 刘恩生.太湖鱼类群落变化规律、机制及其对环境的影响分析.水生态学杂志,2009,2(4): 8-14.
[37] 朱存良,张 玉.红鳍鲌的生物学特性及人工繁殖和苗种培育技术.北京水产,2007,(5): 25-26.
[38] 陈清华,刘 伟,唐富江.兴凯湖4种野生鲌类营养成分的比较分析.大连海洋大学学报,2011,26(1): 88-92.
The change of δ13C and δ15N values inCultrichthyserythropterusfrom three typical areas within Lake Taihu
WANG Xiaoling1, XU Dongpo2, LIU Kai2, DUAN Jinrong2& SHI Weigang1,2
(1:WuxiFisheriesCollege,NanjingAgriculturalUniversity,Wuxi214081,P.R.China)
(2:ScientificObservingandExperimentalStationofFisheryResourcesandEnvironmentintheLowerReachesoftheChangjiangRiver,FreshwaterFisheriesResearchCenter,ChineseAcademyofFisherySciences,MinistryofAgriculture,Wuxi214081,P.R.China)
The aim of this study was to explore the feeding habits ofCultrichthyserythropterusby analyzing the changes and regularity of δ13C and δ15N in Gonghu Bay, Lishan Bay, and east Lake Taihu, using the stable isotope technology. The results showed that the values of δ13C and δ15N were positively correlated with the body length, and the δ13C and δ15N values. The trophic level in largeC.erythropterus(>138mm) individuals was significantly higher than that in the smaller ones(<138mm), which indicated thatC.erythropterusunderwent size-related diet shift switching from small zooplankton to fish due to predation ability strengthening and mouth crack increasing. Obvious spatial heterogeneity could be observed in the δ13C and δ15N values ofC.erythropterusin the three areas.C.erythropterusin east Lake Taihu(-25.17‰±2.56‰), affected by aquaculture, presented lower values of δ13C than those in Gonghu Bay(-23.11‰±1.05‰) and Lishan Bay(-22.73‰±1.31‰), and were generally smaller in body sizes, revealing that there were certain correlations between the population distributions and geographic locations. TheC.erythropteruswas fed on diets according to different habits, and preferred to large animal bait under the environment of high concentrations of blue-green algae in order to reduce the feeding pressure of zooplankton, and indirectly controlled the development of eutrophication. Furthermore, we also studied the influence ofC.erythropteruson ecosystem. The results of this study can provide the theoretic basis for the protection and rational allocation of resources of the region.
Lake Taihu;Cultrichthyserythropterus; δ13C; δ15N; body length; trophic level
*中央级公益性科研院所基本科研业务费专项资金项目(2013JBFT03)资助.2014-10-12收稿;2014-12-05收修改稿.王晓玲(1986~),女,硕士研究生;E-mail:sdwfwang1109@163.com.
J.LakeSci.(湖泊科学), 2015, 27(5): 925-931
DOI 10.18307/2015.0520
©2015 byJournalofLakeSciences
**通信作者;E-mail: shiwg@ffrc.cn.
