淡水浮游植物计数与定量方法*
2015-05-10钱奎梅陈宇炜
钱奎梅,刘 霞,陈宇炜
(中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
淡水浮游植物计数与定量方法*
钱奎梅,刘 霞,陈宇炜**
(中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
显微镜计数法是淡水浮游植物计数最常用的经典方法,是浮游植物生物量测定的基本方法,也是衡量其他测定方法准确性的依据.随着科技的发展,可见分光光度法、荧光分光光度法、流式细胞显微镜计数法、库尔特计数法等新型细胞计数法相继问世.对各种方法的特点进行比较,结果表明:光密度法、流式摄像机计数法、流式细胞仪法、叶绿素a法等仅能够分析测定浮游植物生物量,而显微镜法是测量浮游植物粒径的经典方法,不仅可以测定浮游植物生物量,还可以进行浮游植物的种类及群落结构分析.以上这些方法都可以用于浮游植物的计数与定量,可以根据不同的需求来选择最佳的浮游植物计数方法,如分析方便性、样本处理速率、样本大小等.但显微镜计数法在淡水生态学中具有不可替代的作用.
浮游植物;细胞计数;生物量;显微镜;定量
浮游植物是一个生态学概念,是指在水体中营浮游生活的微小植物,通常浮游植物就是指浮游藻类,包括蓝藻门、绿藻门、硅藻门、金藻门、黄藻门、甲藻门、隐藻门和裸藻门8个门类的浮游种类,已知全世界藻类植物约有40000种,其中淡水藻类有25000种左右,而中国已发现的淡水藻类约9000种[1].浮游植物是水域生态系统的重要初级生产者,其种类组成和数量分布的生态学特征是水生生态系统的重要研究内容[2].由于浮游植物对其所处生境的水质状况反应灵敏,能够对水体营养状态的变化迅速做出响应[3],其群落结构能够真实地反映水质状况,是评价水体健康状况的重要指示生物[4].
浮游植物现存量是指某一瞬间单位水体中所存在的浮游植物的总量[5].这个量用数量表示称为丰度,用重量表示称为生物量.由于不同水体、不同种类的藻类在个体上差异较大(这种差异有时可达数百、数千倍),有些在丰度上较高的种类由于个体微小,生物量可能低于丰度小而个体大的种类,所以用细胞丰度来表示生物量会过高估计细胞体积小的物种的贡献,过低估计细胞体积大的物种的贡献,因此,仅用丰度就很难全面评价不同水体浮游植物的真实情况,而且细胞丰度对于分析浮游植物现存量在食物链和营养对策等方面所起的作用也是有限的,应该以测算生物量为目标.
浮游植物生物量还可以通过测定叶绿素、ATP、碳含量、氮含量等方法(如化学分类方法、基于光谱的检测方法以及分子生物学鉴定与检测技术等)获得[6-7],也可通过间接从细胞体积转化为生物量而获得.除细胞体积转化外,其它方法可从不同角度获得较精确的浮游植物现存量,但它们无法反映浮游植物的群落结构和不同种及同种不同大小的浮游植物生物量的贡献,从而无法解释现存量时空变化的内在原因.只有通过测量浮游植物细胞个体大小获得细胞体积转化后的生物量,才能既较准确地反映浮游植物现存量,又能清楚地了解浮游植物的群落结构、种类组成、优势种、种类交替及不同大小细胞对浮游植物生物量的贡献.
随着科技的发展,浮游植物细胞定量计数方法除传统的显微镜计数[5]外,可见分光光度法、荧光分光光度法、流式细胞显微镜计数法[8-10]、库尔特计数法[11]等相继问世,这些方法很多都源于海洋浮游植物分析,可在淡水中推广应用,因此,本文对这些方法进行综述.
1 浮游植物分析方法
1.1 基于形态学特征的分析方法
运用光学显微镜对浮游植物进行定性、定量分析是当前鉴别和计量浮游植物最直接和可信的方法,是浮游植物分类鉴定的基础[5,12],也是检验其他测定方法有效性的依据.1931年Utermöhl在结合Volk的静置沉淀法与Kolkwitz的计数框基础上发明了Utermöhl计数法[13].1958年,Utermöhl又规范了计数框的观测面积[14].自1978年联合国教科文组织(UNESCO)将Utermöhl计数法编入《浮游植物手册》[15]以来,它在世界范围内被接受并普遍使用,是目前国际上浮游植物调查研究最通用的方法之一.为减少浓缩时间,Paxinos等[16]曾改进Utermöhl的静置沉降浓缩为压滤浓缩,其计数结果与传统的Utermöhl沉降浓缩结果具有很好的相关性(R2=0.98);水样中不必加入鲁哥试剂进行固定,有利于被检测的活性生物保持活性;浓缩过程只需2h左右.为缩短浓缩时间,王瓒等[17]采用滤膜过滤方法浓缩收集水体中的藻细胞,经超声振荡后在显微镜下进行计数,与传统方法的对比实验结果表明,该方法水样用量少、操作方便、准确快捷.膜过滤的缺点是细胞不能用明场照明,因为膜过滤法会扭曲图像,并且很难识别不同物种和门类.因此,该方法的样本处理速率取决于过滤的体积、样品过滤的比例以及样品中细胞浓度和杂质的量等[18].
由于藻类无法直接称重,而藻类细胞形态较为规则,且细胞比重接近于1,故可用形态相似的几何体积直接换算为生物量(湿重)[19-21],即生物量为浮游植物的丰度乘以各自的平均体积,单位为mg/L.单细胞的生物量主要根据浮游植物个体形状测量分析.因浮游植物体积在不同地区、不同季节都有较大变化,最好对其进行直接测量,对于数量多或体积大的种类,特别是优势种,更应实际测量.测量时应根据藻类体型,按最近似的几何图形测量其长度、宽度、直径等,分别求得平均值,然后按求积公式计算出体积.有的种类形状较特殊,可分解为几部分,分别按相似几何图形求算相加.显微镜法耗时较长,对专业知识要求较高,载玻片和盖玻片的间距使细胞呈现出多种形态,水样中的非藻颗粒物也可对样品分析造成干扰[22],同时,显微镜放大倍数的局限可造成微型及超微型浮游植物的漏检.但由于显微镜计数法观测面积大、准确度高、变异系数小,能较为全面地反映样品的种类分布情况,目前仍然为国际上浮游植物计数最通用的方法.该方法适用于浓度低、种类多的样品[23].
血球计数法[24]虽然方便、快捷,但是如果计数室内有杂物或未洗净的微生物时,会影响观察和计数结果.因此,使用血球计数器之后必须将其清洗干净.该方法适合于实验室纯种培养的高浓度样品.库尔特计数[11]是通过测量细胞体积和个数,得出各颗粒的大小,统计出粒度的分布,其重现分析功能可分析到单个脉冲信号,灵敏度较高,该方法适合于实验室纯种培养的样品.
基于形态学特征对藻种进行鉴定的另一个重要研究方向就是利用计算机辅助完成的图像分析和识别技术.目前广泛使用的流式摄像机(flow cytometer and microscope,FlowCAM)综合了显微镜法、叶绿素荧光法和流式细胞仪法的功能,能够给出每一种浮游植物的尺寸和图像;可以对浮游植物自动计数,并对其图像进行处理,经图库比对后对浮游植物进行分类测量和识别;可以根据浮游植物形态及光学特性,自动识别部分特征性浮游植物,能用于大量样品的监测分析;可以连续24h自动在线监测或巡航监测;非常适合检测基于天然叶绿素荧光的浮游植物样品,具有快速识别和计数的特点[25-29].FlowCAM为藻类分类鉴定提供了良好的图像及数据,可进行种类鉴定的藻类直径应不小于5μm,FlowCAM要求样品浓度不能太低,否则仪器进样时可能会因藻类混合不匀而导致较大的误差[30-31].由于浮游植物种类繁多,不同种类的藻细胞可能在形态结构上具有很大的相似性,同一种类在不同生长时期或以不同视角所捕获的照片在形态学上也可能有较大的差异,使鉴别的准确度大大降低.此外,技术上的限制可能使获取的照片分辨率较低,增大了准确识别的难度.目前真正实现自动识别的系统并不多,可识别的物种也比较少[8-10,32].
1.2 基于色素的化学分析方法
基于色素的化学分析方法是利用浮游植物不同类群间色素组成和含量的不同来确定群落组成和丰度.其中,优势比较明显的是高效液相色谱(HPLC)技术[33],一次操作可以分离50多种色素[34].二极管阵列检测器的使用使色素检测更加准确、便捷[35].基于HPLC的光合色素分析技术能够有效地进行大量的现场样品分析,即使在样品处理中存在过滤产生损失或处理过程导致样品破坏的情况,但从HPLC的光合色素产生信号峰的差异仍然能辨析出其类群组成.在野外样品检测方面,原来因为显微计数中样品过滤或预处理所造成的种类缺失,现在通过HPLC色素峰也能清楚地辨别出来[36].此外,HPLC方法还使每个航次分析几百个样品成为可能[37].目前,该方法仅局限在纲一级水平,如果要进行种属水平的鉴定,还需要寻找新的特征色素或色素组合[38-39].某些形态上相似的种类,可能在光合色素等生物标志物上存在差异,从而可以有效地鉴定[40].应用光合色素作为分类技术手段的缺点是尚不能完全实现属和种之间的准确分类.此外,环境变化以及不同的细胞生长周期也会导致浮游植物的光合色素含量发生一些变化,从而导致分类的结果受到影响[41].所以,应用该方法对浮游植物进行定性和定量分析还很难实现.
1.3 基于光学特性的分析方法
借助光学特性对浮游植物进行检测的方法主要有活体荧光分析技术[42]以及基于现场表观光谱和固有光谱的浮游植物检测技术[43-45].荧光测定技术不需破碎细胞,不伤害生物体,因此通过研究叶绿素荧光来间接研究光合作用的变化是一种简便、快捷、可靠的方法[46-49].现场荧光分析法主要集中于海水样品和蓝藻监测中对光合色素的检测[47-50].可以区分浮游植物种类的便携式激光诱导荧光系统已经研制成功[51].此外,由于不同种类浮游植物光合色素含量和组成有一定差别,因此还可以根据吸收光谱图的差异区分不同植物类群[52].现场荧光检测法的优势在于它可以对水下灯现场环境进行快速、连续、大面积测定,但不能实现对浮游植物的分类.借助现场表观光谱和固有(反射、散射、吸收)光谱的浮游植物检测方法[53-54]简单且容易实现,但是探测精度受环境条件限制,对浮游植物的识别也比较粗糙.研究认为与藻细胞粒径、色素结构有关的色素综合效应是造成浮游植物比吸收系数变化的重要原因,同时也影响着浮游植物吸收系数的光谱形状[55].因此,基于水色遥感的浮游植物总生物量反演[56-62]能实现对水域的大面积监测,提供浮游植物总量信息,但不能对种类组成进行鉴定.叶绿素a浓度测定法能够确定细胞生物量,准确度高,但操作较复杂、耗时长.不同种类浮游植物的叶绿素a相对浓度随浮游植物群落的变化而变化,同时在不同环境条件下的叶绿素a相对浓度也有所不同[63].在纯种藻培养中,叶绿素a与细胞浓度的比率随细胞生理学和藻类生长阶段而变化[64].因此,叶绿素a浓度只是浮游植物浓度的近似值.
1.4 基于免疫分析的检测技术
基于免疫学分析的检测方法已有几十年的历史.早期人们只是将其作为一种常规分类学手段的补充方法,能准确识别的种类也不多.近20年来,随着科学技术的突飞猛进,基于免疫分析的检测技术也有了长足发展.应用抗体探针的免疫测定主要有免疫荧光分析[65]、酶联免疫吸附分析(enzyme-linked immune-sorbent assay, ELISA)[66]及流式细胞免疫分析[67]等.免疫分析方法无需对样品进行预处理,设备普及度高,易实现商品化.但它需要制备高度专一的特异性抗体,尤其在对同一种属进行区分的时候需要制备单克隆抗体,但是传统的制备单克隆抗体的方法——杂交瘤细胞技术的费用较高且操作繁琐,对特异性抗体的研发造成了一定的限制.目前,制备特异性强的多克隆抗体已成为可行的替代方法.目前已有关于藻类多抗制备和特异性鉴定的报道,并已成功制备出多种高特异性的多克隆抗体.将多克隆抗体技术与适当的免疫学检测方法相结合可以实现对目标藻的定性和定量分析[68-69].
1.5 基于核酸分析的检测技术
目前基于核酸的浮游植物定性定量分析方法主要有功能基因研究、分子指纹分析技术、分子探针技术等.功能基因的研究主要包括核糖体基因(ribosomal RNA gene, rDNA)、细胞色素b基因(Cytoclme b,cytb)、增殖细胞核抗原基因(PCNA)、Hsp90(热休克蛋白)基因、质体rbcL(二磷酸核酮糖羧化酶大亚基基因)等的研究.其中,rDNA凭借其为细胞所共有、功能同源且最为古老的独特优点,成为目前应用最广泛的分子指标[70-72].虽然rDNA序列分析是对浮游植物定性、定量检测的一种较为可靠的方法,但其耗时费力,不太适合常规测定,而且,用于序列比对的美国国立生物技术研究中心数据库(national center for biotechnology information,NCBI)里收录的序列在研究者上传后并未经过严格的审核和验证,其准确性无法得到保证.同时,对某一种类来说序列信息往往呈片段化,缺乏完整的rDNA基因序列信息,这就给序列比对的准确度造成了一定的影响[70-72].
基于DNA多态性的分子指纹分析技术方法简单,重现性好,无需测序,在藻类的系统比较和分类鉴定中起着重要作用.但是,藻类基因组数据库的不完整性限制了这些方法的应用[73].
由于分子探针技术具有专一性强、准确、快速等特点,在分子生物学研究中得到了广泛应用[74-75].近年来,荧光原位杂交(fluorescenceinsituhybridization,FISH)技术凭借其分析速度快和灵敏性高等优点在藻类检测和生态学研究等领域得到广泛应用[76].FISH的优势在于能准确识别出样品中的目标生物,还能对群落结构进行研究.同时,样品的全细胞形态为验证探针检测结果提供了一个重要补充.不过,该方法也存在一定缺陷,如对链状形式聚生的细胞(拟菱形藻Pseudonitzschia、骨条藻Skeletonema、赤潮异弯藻Heterosigmaakashiwo等)以及在保存时容易聚集的细胞鉴定、计数较难,对裸甲藻等一些甲板不明显微藻全细胞形态的固定和保存也有一定难度,还有其它一些因素也可能影响着荧光原位杂交的效果,如固定方法、脱色条件、低温保存以及RNA降解等[77-78].
实时荧光PCR不仅具有普通PCR的高灵敏度,而且应用了荧光探针,既增加了检测特异性,又可以通过光电传导系统直接探测PCR过程中荧光信号的变化,因此还具有DNA杂交的高特异性和光谱技术的高精确性.实时荧光定量PCR技术不仅实现了对核酸模板的定量,而且具有灵敏度和特异性高、能实现多重反应、自动化程度高、无污染、实时和准确等特点.因此,实时荧光PCR也被运用到藻类学研究中[79-80].但在浮游藻类定性定量检测方面,该技术尚处于起步阶段,其最大的限制在于很难获得高纯度的DNA样品.
夹心杂交技术无需进行样品纯化、恒温杂交、操作简单.不过,该技术存在的致命缺陷是,它直接检测极易降解的RNA,而夹心杂交中包含抗原抗体反应和许多洗涤操作,增加了RNA降解的机会,使分析结果的准确度和稳定性不理想.此外,反应中缺少温度控制也给特异性探针的设计带来很大难度.为了克服夹心杂交技术的缺点,有研究者[81-82]将酶保护分析方法与夹心杂交方法相结合,采用双特异分子探针技术并将其应用于浮游植物的检测,但也只能对样品中十余种藻类进行定性、定量分析.
2 淡水浮游植物计数及定量方法比较
能够分析计算浮游植物总生物量的方法有显微镜法、光密度法、FlowCAM计数法、流式细胞仪法、叶绿素a法等(表1).目前很多研究者[83-88]探讨了不同计数方法衡量某一种类微藻生物量的可行性,结果表明,分光光度法和荧光法是相对简便、快捷、准确的分析方法.然而,由于不同种类微藻细胞个体大小不同,运动能力不同,而且细胞生长过程中可能存在着某些物质浓度(如叶绿素、荧光物质等)的变化,而上述研究只针对特定种类取某一生长期培养液进行稀释测定,因此实验结果适用范围存在一定的局限性.
浮游植物计数的方法中分光光度法和库尔特计数法操作简单、耗时短,测定结果重现性好、误差小,测定时可以不破坏样品,特别适于连续测定,是比较简便、快捷、有效的测定方法.但分光光度法计数细胞若采用叶绿素的最大吸收波长,其测定容易受细胞生长和生理状态的影响,而采用浊度比色又受细胞生长后期细胞碎片和有机颗粒等非细胞因素的影响[89].FlowCAM计数法虽然准确,号称“小流式细胞计数”,但操作比较繁琐、耗时长,而且数据后期处理需经过2次校正.仪器计数要求细胞条件较高,最好是处在指数生长阶段中的细胞,而人为计数(如显微镜和FlowCAM)能分辨细胞生长后期的细胞碎片甚至死细胞.库尔特计数采用小孔电阻原理,测量颗粒的大小和数量,统计出粒度的分布,其重现分析功能可分析到单个脉冲信号,同时分析不同类型细胞相当方便;其灵敏度较高,但线性范围较小[90].因此,当藻密度较小时或实验室纯种培养、浓度高、种类单一时,采用库尔特法效果较好;当藻密度较大时,可采用可见分光光度法[89].库尔特计数结果一般会高于显微镜计数结果,因其会计数一些非细胞形态的颗粒,但校正后准确度仍然较高.在显微镜计数以外的计数方法中,库尔特计数法较好,其次为分光光度计数法和FlowCAM计数法[88].库尔特法是一种相对简便、快捷和可靠的细胞计数方法.流式细胞仪法使单样品操作时间较短,能灵敏检测细胞死/活状态,测定梯度配比的热处理致死细胞的结果与配比值吻合良好,该方法用于紫外消毒处理水样中的藻细胞计数及死/活状态分析灵敏有效.显微镜计数法不仅能较为全面地反映样品的种类分布情况,而且准确度高、变异系数小,目前仍然为国际上浮游植物调查研究最通用的方法.
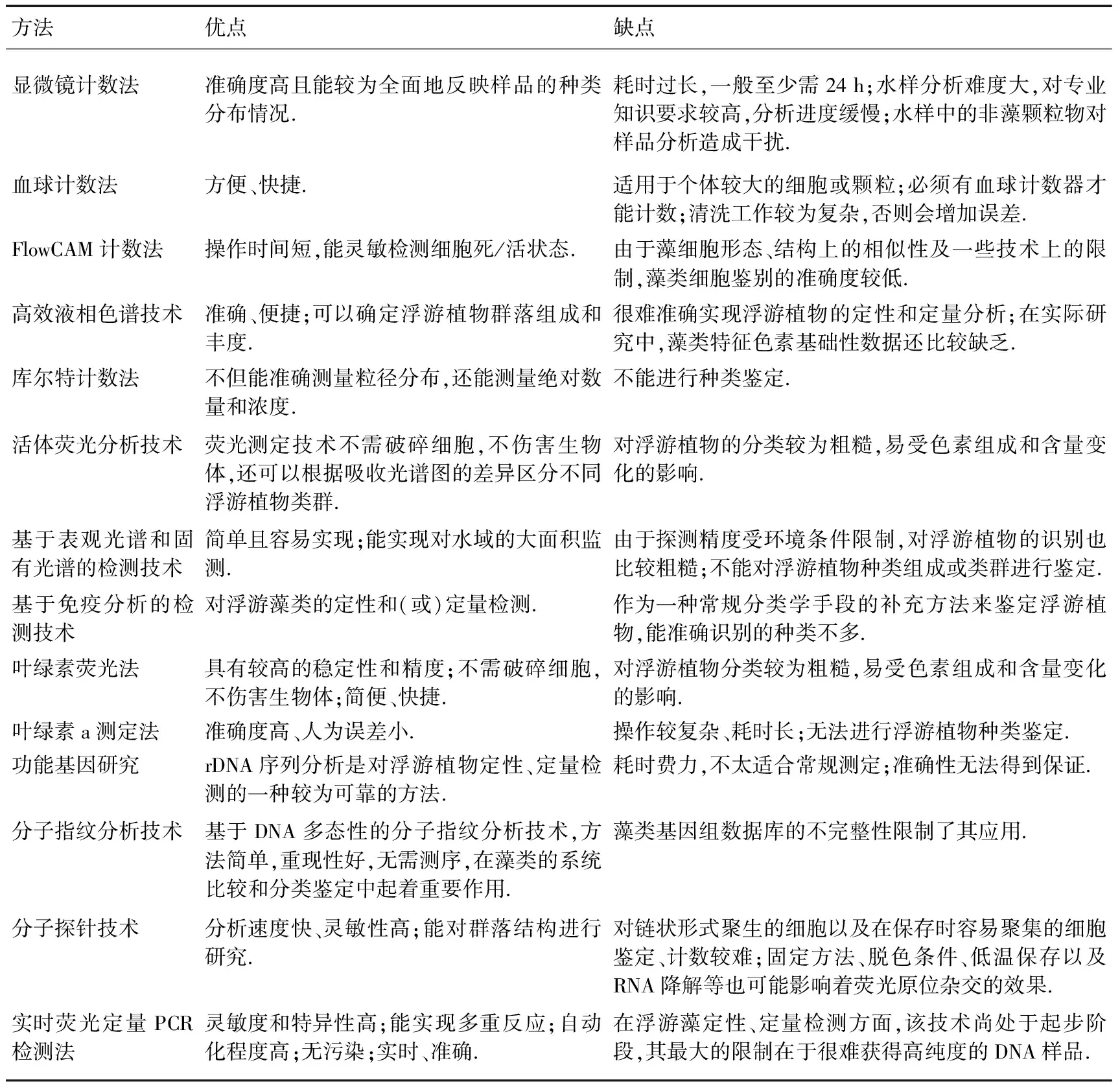
表1 各种浮游植物计数和定量分析方法的优缺点比较
浮游植物种类及群落结构分析对于深入研究淡水浮游植物生理特性、群落结构与功能、在淡水生态系统中的作用等都具有重要的科学意义.目前显微镜计数法[91-92]、库尔特计数法[11]、流式细胞仪法[93-94]等均可测量水体浮游植物粒径.库尔特计数法虽然简单快速,可以方便地测量其粒径分布,但不能进行种类鉴定.显微镜计数法是测量浮游植物粒径的经典方法,具有直观、准确等优点,并可进行种类鉴定[95].能够鉴定浮游植物种类的藻类计数法有显微镜法、PCR法,而PCR法在浮游藻定性、定量检测方面尚处于起步阶段,其最大的限制在于很难获得高纯度的DNA样品[96].
选择适当的浮游植物计数方法对浮游植物的相关研究十分重要.以上这些方法都可以用于浮游植物的计数与定量,可以根据不同的需求来选择最佳计数方法,如样本大小、便于分析、样本处理率等.显微镜细胞定量计数法作为浮游植物定量和计数最经典的方法,是衡量浮游植物定量、计数及其它方法是否准确的标准,在淡水生态学中具有不可替代的作用.
[1] 魏印心,胡鸿钧.中国淡水藻类——系统、分类及生态.北京:科学出版社,2006:1023.
[2] Watson SB, Mccauley E, Downing JA. Patterns in phytoplankton taxonomic composition across temperate lakes of differing nutrient status.AmericanSocietyofLimnologyandOceanography, 1997, 42(3): 487-495.
[3] Suikkanen S, Laamanen M, Huttunen M. Long-term changes in summer phytoplankton communities of the open northern Baltic Sea.Estuarine,CoastalandShelfScience, 2007, 71: 580-592.
[4] Stevenson JR, Peterson CG, Kirschtel DBetal. Density-dependent growth, ecological strategies, and effects of nutrients and shading on benthic diatom succession in streams.JournalofPhycology, 1991, 27(1):59-69.
[5] 章宗涉,黄祥飞.淡水浮游生物研究方法.北京:科学出版社,1991:426.
[6] Boyce DG, Lewis MR, Worm B. Global phytoplankton decline over the past century.Nature, 2010, 466: 591-596.
[7] Welschmeyer NA. Fluorometric analysis of chlorophyll-a in the presence of chlorophyll-b and pheopigments.LimnologyandOceanography, 1994, 39: 1985-1992.
[8] Asai R,Matsukawa R, Ikebukuro Ketal. Highly sensitive chemiluminescence flow-injection detection of the red tide phytoplanktonHeterosigmacarterae.AnalyticaClimicaActa, 1999, 390(1/2/3): 237-244.
[9] Becker A, Meister A, Wilhelm C. Flow cytometric discrimination of various phycobilin-containing phytoplankton groups in a hypertrophic reservoir.Cytometry, 2002, 48(1): 45-57.
[10] Stauber JL, Franklin NM, Adams MS.Applications of flow cytometry to ecotoxicity testing using microalgae.TrendsBiotechnol, 2002, 20(4): 141-143.
[11] 曹为民.介绍一种先进的粒度测量仪器——库尔特计数器.电力环境保护,1989,(1): 50-52.
[12] Hallegraeff GF, Hara Y. Taxonomy of harmful marine raphidophytes. In: Hallegraeff GM, Anderson DM, Cerebella AD eds. Manual on harmful marine microalgae. Paris: UNESCO, 1995: 365-371.
[13] Utermöhl H. Neue wege in der quantitativan erfassung des planktons(Mit besondere Berücksichtigung des Ultraplanktons).VerhIntVereinTheorAngewLimnol, 1931, 5: 567-595.
[14] Utermöhl H. Zur vervollkomnung der quantitativen phytoplankton methodik.MittIntVereinTheorAngewLimnol, 1958, 9: 1-38.
[15] Sournia A. Phytoplankton manual. Paris: UNESCO, 1978.
[16] Paxinos R, Mitchell JG. A rapid utermöhl method for estimating algal numbers.JournalofPlanktonResearch, 2000, 22(12): 2255-2262.
[17] 王 瓒,乔俊莲,王国强等.浓缩过滤——超声振荡法检测水中藻类.中国给水排水,2008,24(14): 86-87.
[18] Steinberg MK, First MR, Lemieux EJetal. Comparison of techniques used to count single-celled viable phytoplankton.JournalofAppliedPhycology, 2012, 24(4): 751-758.
[19] Sun J, Liu DY. Geometric models for calculating cell biovolume and surface area for phytoplankton.JournalofPlanktonResearch, 2003, 25(11): 1331-1346.
[20] Hillebrand H, Dürselen CD, Kirschtel Detal. Biovolume calculation for pelagic and benthic microalgae.JournalofPhycology, 1999, 35: 403-424.
[21] Ravi kumar MS, Ramaiah N, Tang DL. Morphometry and cell volumes of diatoms from a tropical estuary of India.IndiaJournalofMarineSciences, 2009, 38(2): 160-165.
[22] Truby EW. Preparation of single-celled marine dinoflagellates for electron microscopy.MicroscopyResearchandTechnique, 1997, 36: 337-340.
[23] 陈 坤,张前前,史海燕等.浮游植物计数方法比较研究.海洋环境科学,2007,26(4): 383-385.
[24] Guillard RRL. Growth measurements. Division rates. In: Stein JR ed. Handbook of phycological methods. Cambridge: Cambridge University Press, 1973.
[25] Siemcki CK, Sieracki ME, Yentsch CS. An imaging-in-flow system for automated analysis of marine microplankton.MarineEcologyProgressSeries, 1998, 168: 285-296.
[26] Wert EC, Dong MM, Rosario-Ortiz FL. Using digital flow cytometry to assess the degradation of three cyanobacteria species after oxidation processes.WaterResearch, 2013, 47(11): 3752-3761.
[27] Eigemann F, Hilt S, Schmitt-Jansen M. Flow cytometry as a diagnostic tool for the effects of polyphenolic allelochemicals on phytoplankton.AquaticBotany, 2013, 104: 5-14.
[29] Monaldi AC, Romero GG, Alanís EEetal. Digital holographic microscopy for microalgae biovolume assessment.OpticsCommunications, 2015, 336(1): 255-261.
[30] Malkassian A, Nerini D, van Dijk MAetal. Functional analysis and classification of phytoplankton based on data from an automated flow cytometer.CytometryA, 2011, 79: 263-275.
[31] Picot J, Guerin CL, le van Kim Cetal. Flow cytometry: retrospective, fundamentals and recent instrumentation.Cytotechnology, 2012, 64: 109-130.
[32] Moberg EA, Sosik HM. Distance maps to estimate cell volume from two-dimensional plankton images.LimnologyandOceanography:Methods, 2012, 10: 278-288.
[33] Mackey DJ, Blanchot J, Higgins HWetal. Phytoplankton abundances and community structure in the equatorial Pacific.DeepSeaResearchPartII, 2002, 49(13/14): 2561-2582.
[34] Latasa M, Bidigare RR, Ondrusek MEetal. HPLC analysis of algal pigments: a comparison exercise among laboratories and recommendations for improved analytical performance.MarineChemistry, 1996, 51(4): 315-324.
[35] Wright SW, Jeffrey SW, Mantoura RFCetal. Improved HPLC method for the analysis of chlorophylls and carotenoids from marine phytoplanklon.MarineEcologyProgressSeries, 1991, 77: 183-196.
[36] Brotas V, Plantc-Cuny MR. Identification and quantification of chlorophy Ⅱ and carotenoid pigments in marine sediments: A protocol for HPLC analysis.OceanographicActa, 1996, 19(6): 623-634.
[37] Kwan WC, Kiln WC. HPLC pigment analysis of marine phytoplankton during a red tide occurrence in Tolo Harbour, Hong Kong.Chemosphere, 2003, 52(9): 1633-1640.
[38] Zapata M, Jeffrey SW, Wright SW.Photosynthetic pigments in 37 species(65 strains) of Haptophyta: implications for oceanography and chemotaxonomy.MarineEcologyProgressSeries, 2004, 270: 83-102.
[39] 姚 鹏.胶州湾浮游藻的色素分析和基于色素的分类方法研究[学位论文].青岛:中国海洋大学,2005.
[40] Hodgson DA, Wright SW, Davies N. Mass Spectrometry and reverse phase HPLC techniques for the identification of degraded fossil pigments in lake sediments and their application in palaeolimnology.JournalofPaleolimnology, 1997, 18(4): 335-350.
[41] Hou JJ, Huang BQ, Cao ZRetal. Effects of nutrient limitation on pigments inThalassiosiraweissflogiiandProrocentrumdonghaiense.JournalofIntegrativePlantBiology, 2007, 49(5): 686-697.
[42] Catherine A, Escoffier N, Belhocine Aetal. On the use of the Fluoro Probe, a phytoplankton quantification method based on fluorescence excitation spectra for large-scale surveys of lakes and reservoirs.WaterResearch, 2012, 46(6): 1771-1784.
[43] Chang DW, Hobson P, Burch Metal. Measurement of cyanobacteria using in-vivo fluoroscopy-Effect of cyanobacterial species, pigments, and colonies.WaterResearch, 2012, 46(16): 5037-5048.
[44] Medina-Cobo M, Domínguez JA, Quesada Aetal. Estimation of cyanobacteria biovolume in water reservoirs by MERIS sensor.WaterResearch, 2014, 63: 10-20.
[45] Lunetta RS, Schaeffer BA, Stumpf RPetal. Evaluation of cyanobacteria cell count detection derived from MERIS imagery across the eastern USA.RemoteSensingofEnvironment, 2015, 157: 24-34.
[46] Chekalyuk A, Landry M, Goericke Retal. Laser fluorescence analysis of phytoplankton across a frontal zone in the California current ecosystem.JournalofPlanktonResearch, 2012, 34(9): 761-777.
[47] Lee T, Tsuzuki M, Takeuchi Tetal. Quantitative determination of cyanobacteria in mixed phytoplankton assemblages by an in vivo fluorimetric method.AnalyticaChimicaActa, 1995, 302(1): 81-87.
[48] Beutler M, Wiltshire KH, Arp Metal. A reduced model of the fluorescence from the cyanobacterial photosynthetic apparatus designed for theinsitudetection of cyanobacteria.BiochimicaetBiophysicaActa, 2003, 1604(1): 33-46.
[49] Beutler M, Wiltshire KH, Meyer Betal. A fluorometric method for the differentiation of algal populationsinvivoandinsitu.PhotosynthesisResearch, 2002, 72(1): 39-53.
[50] 王书涛,王玉田,车仁生等.基于小波变换的叶绿素荧光光谱测量系统研究.应用光学,2005,26: 49-52.
[51] Chen P, Pan D, Mao Z. Application of a laser fluorometer for discriminating phytoplankton species.Optics&LaserTechnology, 2015, 67: 50-56.
[52] Koehne B, Elli G, Jennings RCetal. Spectroscopic and molecular characterization of a long wavelength absorbing antenna ofOstreobiumsp.BiochimicaetBiophysicaActa, 1999, 1412(2): 94-107.
[53] Carder KL, Steward RG. A remote-sensing reflectance model for red-tide dinoflagellate off West Florida.LimnologyandOceanography, 1985, 30: 286-298.
[54] Ahn YH, Shanmugam P, Ryu JHetal. Satellite detection of harmful algal bloom occurrences in Korean waters.HarmfulAlgae, 2006, 5(2): 213-231.
[55] Brewin RJW, Hardman-Mountford NJ, Lavender SJetal. An intercomparison of bio-optical techniques for detecting dominant phytoplankton size class from satellite remote sensing.RemoteSensingofEnvironment, 2011, 115(2): 325-339.
[56] Alikas K, Kangro K, Reinart A. Detecting cyanobacterial blooms in large North European lakes using the Maximum Chlorophyll Index.Oceanologia, 2010, 52: 237-257.
[57] Wynne TT, Stumpf RP, Tomlinson MCetal. Characterizing a cyanobacterial bloom in western Lake Erie using satellite imagery and meteorological data.LimnologyandOceanography, 2010, 55: 2025-2036.
[58] Matthews MW, Bernard S, Robertson I. An algorithm for detecting trophic status(chlorophyll-a), cyanobacteria-dominance, surface scums and floating vegetation in inland and coastal waters.RemoteSensingofEnvironment, 2012, 124: 637-652.
[59] Duan H, Ma R, Hu C. Evaluation of remote sensing algorithms for cyanobacterial pigment retrievals during spring bloom formation in several lakes of east China.RemoteSensingofEnvironment, 2012, 126: 126-135.
[60] Hunter PD, Tyler AN, Carvalho Letal. Hyperspectral remote sensing of cyanobacterial pigments as indicators for cell populations and toxins in eutrophic lakes.RemoteSensingofEnvironment, 2010, 114: 2705-2718.
[61] Ruiz-Verdú A, Simis SGH, Hoyos CDetal. An evaluation of algorithms for the remote sensing of cyanobacterial biomass.RemoteSensingofEnvironment, 2008, 112: 3996-4008.
[62] Gómez JAD, Alonso CA, García AA. Remote sensing as a tool for monitoring water quality parameters for Mediterranean Lakes of European Union water framework directive(WFD) and as a system of surveillance of cyanobacterial harmful algae blooms(SCyanoHABs).EnvironmentalMonitoringandAssessment, 2011, 181: 317-334.
[63] de Jonge VN, Colijn F. Dynamics of microphytobenthos biomass in the Ems estuary.MarineEcologyProgressSeries, 1994, 104: 185-196.
[64] Wirtz KW, Pahlow M. Dynamic chlorophyll and nitrogen: carbon regulation in algae optimizes instantaneous growth rate.MarineEcologyProgressSeries, 2010, 402: 81-96.
[65] Cho ES, Costas E. Rapid monitoring for the potentially ichthyotoxic dinoflagellateCochlodiniumpolykrikoidesin Korean coastal waters using fluorescent probe tools.JournalofPlanktonResearch, 2004, 26(2): 175-180.
[66] Fabienne G, Laetitia P, Béatrice Betal. Monoclonal antibody against the surface ofAlexandriumminutumused in a whole-cell ELISA.HarmfulAlgae, 2009, 8(3): 538-545.
[67] Vrieling EG, Poll WH, Vriezekolk Getal. Immuno-flow cytometric detection of the ichthyotoxic dinoflagellatesGyrodiniumaureolumandGymnodiniumnagasakiense: independence of physiological state.JournalofSeaResearch, 1997, 37(1/2): 91-100.
[68] Xin ZY, Yu ZG, Wang TCetal. Identification and quantification of the toxic dinoflagellateGymnodiniumsp. with competitive enzyme-linked immunosorbent assay(cELISA).HarmfulAlgae, 2005, 4(2): 297-307.
[69] 向军俭,凌钦婕,吕颂辉等.四种赤潮藻多克隆抗体的制备及特异性分析.暨南大学学报:自然科学版,2006,26(5): 700-704.
[70] Zechman FW, Zimmer EA, Theriot EC.Use of ribosomal DNA internal transcribed spacers for phylogenetic studies in diatoms.JournalofPhycology, 1994, 30: 507-512.
[71] 王 波,米铁柱,吕颂辉等.几株原甲藻核糖体大亚基RNA基因的部分克隆及序列分析.海洋学报:中文版,2007,29(1): 120-126.
[72] 侯建军.赤潮生物的分子探针检测方法及其应用研究[学位论文].厦门:厦门大学,2005.
[73] Steffen MM, Zhu Z, McKay RMLetal. Taxonomic assessment of a toxic cyanobacteria shift in hypereutrophic Grand Lake St. Marys(Ohio, USA).HarmfulAlgae, 2014, 33: 12-18.
[74] Dueymes C, Decout JL, Peltie Petal. Fluorescent deazaitavin oligonucleotide probes for selective detection of DNA.AngewandteChemieInternationalEdition, 2002, 41(3): 486-489.
[75] Amann R, Ludwig W, Ribosomal RNA-targeted nucleic acid probes for studies in microbial ecology.FEMSMicrobiologyReviews, 2000, 24(5): 555-565.
[76] Kim CJ, Kim CH, Sako Y. Development of molecular identification method for genusAlexandrium(Dinophyceae) using whole-cell FISH.MarineBiotechnology, 2005, 7(3): 215-222.
[77] Miller PE, Scholin CA. On detection ofPseudo-nitzschia(Baeillariophyceae) species using whole cell hybridization: Sample fixation and stability.JournalofPhycology, 2000, 36: 238-250.
[78] Hosoi-Tanabe S, Sako Y. Rapid detection of natural ceils ofAlexandriumtamarenseandA.catenella(Dinophyceae) by fluorescence in situ hybridization.HarmfulAlgae, 2005, 4: 319-328.
[79] Tengs T, Bowers HA, Ziman APetal. Genetic polymorphism inGymnodiniumgalatheanumchloroplast DNA sequences and development of a molecular detection assay.MelecularEcology, 2001, 10: 515-523.
[80] He SY, Yu ZG.A real-time PCR method for rapid detection ofGymnodiniumsanguineum.JournalofZhejiangUniversity:Agric&LifeSci, 2009, 35(2): 119-126.
[81] Cai QS, Li RX, Zhen Yetal. Detection of twoProrocentrumspecies using sandwich hybridization integrated with nuclease protection assay.HarmfulAlgae, 2006, 5(3): 300-309.
[82] 朱 霞.应用电致化学发光分子探针技术对微小原甲藻的检测[学位论文].青岛:中国海洋大学,2011.
[83] 董正臻,董振芳,丁德文.快速测定藻生物量的方法探讨.实验与技术,2004,28(11): 1-5.
[84] 胡先文,董元彦,张新萍等.可见分光光度法测定水华鱼腥藻.华中农业大学学报,2002,21(3): 295-297.
[85] 陈纬栋,王 崇,胡晓芳等.应用荧光分析技术检测蓝藻生物量.净水技术,2010,29(6): 80-84.
[86] 杨晓冬.浅析荧光法测定蓝藻生物量的可行性.环境科学导刊,2011,30(5): 89-91.
[87] 沈萍萍,李朝晖,齐雨藻等.光密度法测定微藻生物量.暨南大学学报:自然科学版,2001,(3): 115-119.
[88] 侯建军,黄邦钦,戴相辉.赤潮藻细胞计数方法比较研究.中国公共卫生,2004,20(8): 907-910.
[89] 周永欣,章宗涉.水生生物毒性试验方法.北京:农业出版社,1998: 170-190.
[90] 张 奇.库尔特微粒分析仪颗粒测试方法的探讨.分析测试学报,1994,13(4): 42-44.
[91] Popp BN, Laws EA, Bidigare RRetal. The effect of phytoplankton cell geometry on carbon isotopic-fractionation.GeochinicaetCosmochimicaActa, 1998, 62(1): 69-77.
[92] 彦昌敬.植物组织培养手册.上海:上海科学技术出版社,1990: 453.
[93] Brussaard C, Thyrhaug R, Dominigue Metal. Flow cytometric analyses of viral infection in two marine phytoplankton species,Micromonaspusilla(Prasinophyceae) andPhaeocystispouchetii(Prymnesiophyceae).JournalofPhycology, 1999, 35(5): 941-948.
[94] 张利华,张 经,晁 敏.流式细胞术对微微型浮游植物识别初探.海洋科学,2002,26(3): 60-65.
[95] Montagnes DJS, Berges JA, Harrison PJetal. Estimating carbon, nitrogen, protein, and chlorophyll a from volume in marine phytoplankton.LimnologyandOceanography, 1994, 39(5): 1044-1060.
[96] 杨茹君,王修林,石晓勇等.海洋浮游植物粒径分布方法研究.高技术通讯,2004,14(6): 89-94.
A review on methods of cell enumeration and quantification of freshwater phytoplankton
QIAN Kuimei, LIU Xia & CHEN Yuwei
(StateKeyLaboratoryofLakeScienceandEnvironment,NanjingInstituteofGeographyandLimnology,ChineseAcademyofSciences,Nanjing210008,P.R.China)
Phytoplankton cell enumeration made under a light microscope is a basic and classic method for freshwater phytoplankton cell counting and biomass calculation, and also a basis for testing the accuracy of other methods. With the development of technology, some methods on phytoplankton cell enumeration and biomass evaluation, such as visible spectrophotometry, fluorescence spectroscopy, flow microscope counting method, coulter cell counting method, have been developed. Comparing the characteristics of these methods, the results show that the optical density method, FlowCAM counting, flow cytometry, and chlorophyll-a determination method can only analyze phytoplankton biomass. As a classical method to measure the particle size of phytoplankton cell, phytoplankton analysis under a light microscope can analyze not only phytoplankton biomass, but also phytoplankton species and community structure. Since all the methods were generally appropriate for freshwater phytoplankton biomass analysis, ancillary considerations(e.g., easiness of analysis, sample processing rate, sample size, etc.) become critical factors for the determination of optimal phytoplankton counting method. The study indicates that cell enumeration and biomass calculation under a light microscope has an irreplaceable role in phytoplankton biomass evaluation in modern ecology.
Phytoplankton; cell enumeration; biomass, microscope; quantification
*江苏省博士后科研资助计划项目(1401158C)资助.2014-11-20收稿;2015-02-10收修改稿.钱奎梅(1982~),女,博士;E-mail:qiankuimei@163.com.
J.LakeSci.(湖泊科学), 2015, 27(5): 767-775
DOI 10.18307/2015.0502
©2015 byJournalofLakeSciences
**通信作者;E-mail:ywchen@niglas.ac.cn.
