双呋咱并[3,4-b: 3′,4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯及衍生物的合成和表征
2015-05-10夏成波郑春梅张涛胥立文魏文杰王风云雷武夏明珠
夏成波, 郑春梅, 张涛, 胥立文, 魏文杰, 王风云, 雷武, 夏明珠
(南京理工大学化工学院, 江苏 南京 210094)
1 引 言
高能量密度材料(HEDMs)可用于推进剂、炸药和火工品三大领域,是国内外学者研究的热点[1-2]。组成HEDMs的结构单元主要是指氮含量相对较高的氮杂环含能化合物[3-4],如呋咱类含能化合物[5-6]。
1968年,Coburn[7]首次提出了将硝基呋咱用作炸药。2002年,西安近代化学研究所首次报道并合成出3,4-双(4′-硝基呋咱-3′-基)氧化呋咱(BNFF),并成功申请了国防专利[8]。2005年,俄罗斯报道了以3-氨基-4-甲基呋咱为原料,仅用3步法合成BNFF[9]。BNFF是由呋咱、氧化呋咱和硝基构成的含能化合物,熔点较低[10],可用作熔铸炸药中的液相载体炸药[11]。尽管BNFF广泛应用于高能量密度材料[12-13],但对其化学性质的研究报道却很少。BNFF中的硝基基团在SN2反应中作为离去基团的活性和F原子相似,很容易与O、S、N等亲核试剂发生亲核取代反应。其中Stepanov等[5,14]以伯胺作为亲核试剂与BNFF进行反应,合成出氮杂环庚三烯衍生物。
本研究在Stepanov等[5,14]的基础上,以BNFF为原料与9种不同伯胺生成氮杂环庚三烯衍生物(a~ i, Scheme 1),并探讨了其亲核取代反应机理以及选择性。由于在氮环庚三烯体系中引入多硝基苯环结构可以增大芳香环的共轭π电子作用,降低分子的位能,提高含能化合物的热稳定性,因此,选取其中的一种氮杂环庚三烯衍生物7-(2-氨基-1-乙基)-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(c,Scheme 1)作为原料,进一步与2,4-二硝基氯苯、2,4,6-三硝基-3-氨基氯苯反应合成出了两个未见文献报道的含能化合物(j, k, Scheme 2),通过差示扫描量热法(DSC)研究这两种物质的热性能,同时预测了其爆轰性能。
2 实验
2.1 试剂与仪器
试剂: BNFF(自制[10],纯度99.7%),3,4-二氨基呋咱(自制[15],纯度99.3%),2,4-二硝基氯苯、2,4,6-三硝基-3-氨基氯苯(自制[16],纯度>99.0%),碳酸钠、1,3-丙二胺、甲胺、乙胺、烯丙基胺、苄胺、苯胺、对硝基苯胺、2-氨基吡啶、2,6-二氨基吡啶、无水乙腈、甲醇为分析纯,购于国药试剂,水合肼、乙二胺、乙醇胺、氨水、乙酸乙酯、石油醚为化学纯,购于南京试剂厂,蒸馏水,实验室自制。
仪器: Bruker-Avance DRX 500 MHz 核磁共振仪(瑞士Bruker公司); Finnigan TSQ Quantum ultra AM 型质谱仪(美国Finnigan公司); Bruker Tensor 27傅里叶红外变换光谱仪 (瑞士Bruker公司); DSC 823e差示扫描量热仪(瑞士Mettler Toledo公司); DAD 230高效液相色谱仪(大连伊利特); WRS-1B数字熔点仪(上海精密仪器公司)。
2.2 实验步骤
2.2.1 氮杂环庚三烯的合成
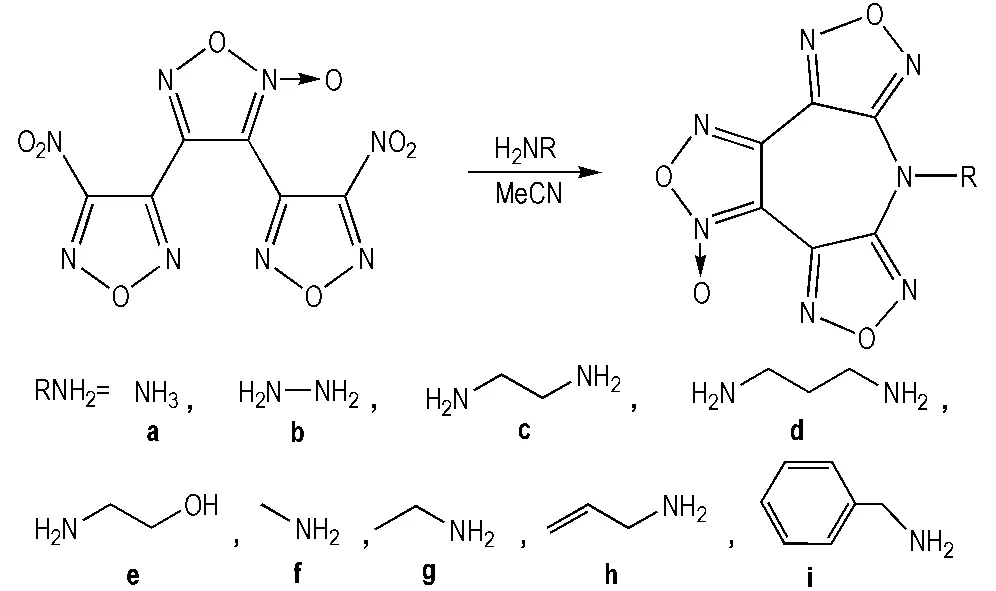
Scheme 1 Synthesis of azepine derivatives
在250 mL的三口烧瓶中加入20 mL无水乙腈,加入0.03 mol的伯胺,搅拌下分批加入3.12 g(0.01 mol) BNFF,控制温度在0~5 ℃,滴加完毕后搅拌1 h,随后升温到40 ℃反应35 min,冷却至室温,旋蒸除去溶剂,加入15 mL蒸馏水析出固体,过滤真空干燥,MeOH重结晶,得到化合物a~i。
7-H-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(a)
产率48.3%,m.p.: 225~226 ℃。1H NMR(DMSO-d6,500 MHz)δ: 12.41(s,NH);13C NMR(DMSO-d6,125 MHz)δ: 152.91,152.46,145.80,138.20,135.92,106.54; IR (KBr,ν/cm-1): 3591,3523(N—H),1648(furazan),1603,1578,1537(furoxan); ESI-MS,m/z: 233.90[M-H]-。
7-氨基-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(b)
产率78.7%,m.p.: 170~172 ℃。1H NMR(DMSO-d6,500 MHz)δ: 6.16(s, NH);13C NMR(DMSO-d6,125 MHZ)δ: 156.26,155.85,145.31,136.44,134.35,106.15; IR (KBr,ν/cm-1) : 3342(N—H),1653(furazan),1597,1559,1533(furoxan); ESI-MS,m/z: 249.89[M-H]-。
7-(2-氨基-1-乙基)-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(c)
产率80.2%,m.p.: 171~173 ℃。1H NMR(DMSO-d6,500 MHz)δ: 4.17(t,CH2,2H),2.94(t,CH2,2H),2.48(s,NH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 154.10,153.73,145.41,137.62,135.44,106.10,54.72,37.57; IR(KBr,ν/cm-1) : 3345,3331(—NH2),2924,2861(—CH2),1647(furazan),1608,1554,1529(furoxan),1228 (C—N); ESI-MS,m/z: 279.11[M+H]+。
7-(3-氨基-1-丙基)-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(d)
产率62.6%,m.p.: 186~187 ℃。1H NMR(DMSO-d6,500 MHz)δ: 4.23(t,CH2,2H),2.83(s,NH2, 2H),2.70(t,CH2,2H),1.91(t,CH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 153.75,153.40,145.40,137.61,135.44,106.06,54.41,39.19,28.90;IR(KBr,ν/cm-1): 3363,3304(—NH2),2947,2871 (—CH2),1652 (furazan),1592,1568,1537(furoxan),1233 (C—N); ESI-MS,m/z: 293.02[M+H]+。
7-(2-羟基-1-乙基)-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(e)
产率68.2%,m.p.: 194~195 ℃。1H NMR(DMSO-d6,500 MHz)δ: 4.91(s,OH,1H),4.23(t,CH2,2H),3.76(t,CH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 154.08,153.71,145.46,137.66,135.37,106.08,56.10,53.86; IR (KBr,ν/cm-1): 3621(—OH),2978,2935(—CH2),1653(furazan),1601,1563,1535(furoxan),1278(C—O); ESI-MS,m/z: 295.90[M+H2O-H]-。
7-甲基-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(f)
产率74.8%,m.p.: 200~203 ℃。1H NMR(DMSO-d6,500 MHz)δ: 3.79(s,CH3);13C NMR(DMSO-d6,125 MHz)δ: 154.37,154.00,145.62,137.60,135.42,100.08,38.36; IR (KBr,ν/cm-1): 2993(—CH3),1652(furazan),1613,1587,1541(furoxan),1473(—CH3),1233(C—N); ESI-MS,m/z: 265.89[M+H2O-H]-。
7-乙基-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(g)
产率70.7%,m.p.: 217~218 ℃。1H NMR(DMSO-d6,500 MHz)δ: 4.20(dd,CH2,2H),1.35(s,CH3, 3H);13C NMR(DMSO-d6,125 MHz)δ: 153.38,153.00,145.31,137.65,135.47,106.08,47.29,12.85; IR (KBr,ν/cm-1) : 2992(C—H),1645(furazan),1608,1590,1536(furoxan),1481(—CH3),1271(C—N); ESI-MS,m/z: 279.95[M+H2O-H]-。
7-烯丙基-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(h)
产率58.6%,m.p.: 221~222 ℃。1H NMR(DMSO-d6,500 MHz)δ: 5.98(m,CH,1H),5.51(d,CH2, 1H),5.22(d,CH2,1H),4.81(d,CH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 153.53,153.17,145.41,137.58,135.43,129.20,118.77,106.09,53.86; IR (KBr,ν/cm-1): 3087(C—H),2991(CH2),1655(furazan),1592,1569,1535(furoxan),1611(CC),1390(C—H),1231(C—N); ESI-MS,m/z: 291.94[M+H2O-H]-。
7-苄基-双呋咱并[3,4-b′:4′-f]氧化呋咱并[3″,4″-d]氮杂环庚三烯(i)
产率47.3%,m.p.: 173~175 ℃。1H NMR(DMSO-d6,500 MHz)δ: 7.46(d,Ar—H,2H),7.35(t,Ar—H, 2H),7.29(t,Ar—H,1H),5.38(s,CH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 154.09,153.73,145.58,137.73,135.57,134.44,128.95,128,17,127,61,106.24,55.16; IR (KBr,ν/cm-1): 3081(Ar—H),2935(—CH2), 1645(furazan),1593,1590,1536(furoxan),1591,1523,716; ESI-MS,m/z: 323.91[M-H]-。
2.2.2 c和多硝基氯苯反应
在250 mL的三口烧瓶中,将15 mmol的多硝基氯苯溶解在40 mL无水乙腈中,加入1.5 g的Na2CO3固体,搅拌下分批加入2.78 g(10 mmol)化合物c,溶解完全后升温到回流,反应35 min。过滤,滤液减压除去溶剂,将固体物加入到30 mL的无水甲醇中,过滤干燥,得到化合物j和k。
j: 产率66.71%,纯度99.5%。1H NMR(DMSO-d6,500 MHz)δ: 8.95(t,NH,1H),8.86(d,Ar—H,1H),8.39(d,Ar—H,1H),7.48(d,Ar—H,1H),4.51(t,CH2,2H),4.00(d,CH2,2H);13C NMR(DMSO-d6,125M)δ: 154.01,153.64,148.52,144.99,137.46,135.70,135.26,130.64,130.49,123.86,115.52,105.71,49.93,40.34; IR (KBr,ν/cm-1): 3311(N—H),3087(Ar—H),2923(C—H),1623(—NH2),1592(CC),1535,1341(—NO2); ESI-MS,m/z: 442.91[M-H]-。
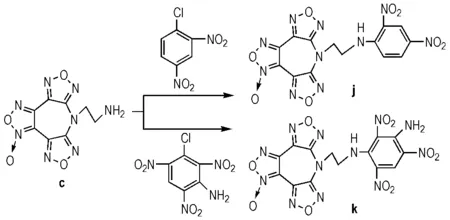
Scheme 2 Synthesis of compound j and k
k: 产率59.71%,纯度99.1%。1H NMR(DMSO-d6,500 MHz)δ: 9.16(t,NH,1H),9.03(s,Ar—H,1H),8.51(s,NH2,2H),4.60(t,CH2,2H),3.45(d,CH2,2H);13C NMR(DMSO-d6,125 MHz)δ: 153.95,153.55,145.26,145.00,144.80,137.50,135.33,130.33,124.97,123.04,122.89,105.68,50.80,42.79; IR (KBr,ν/cm-1): 3427,3309(N—H),3077(Ar—H),2924(C—H),1616(—NH2),1591(CC),1536,1361(—NO2); ESI-MS,m/z: 502.88[M-H]-。
3 结果与讨论
3.1 七元环的成环机理探究
文献[17]研究表明,BNFF的三个呋咱环各自成一个稳定的共轭体系,且在空间成椅形结构,两端的两个硝基相互独立互不影响,为后面的成环反应创造了有利的条件。
BNFF和伯胺可能的反应机理见Scheme 3。在SN2反应中,硝基的强电负性导致BNFF两端的C—NO2键中的电子向N原子偏移,使得碳原子显正电性,从而形成过渡态Ⅰ。同时,强碱性伯胺中N原子的一对孤对电子进攻BNFF两端的碳原子,形成过渡态Ⅱ,之后脱掉2分子的亚硝酸形成环状产物Ⅲ。化合物a~ i的核磁和质谱数据也表明,BNFF和伯胺反应均得到环状产物,从而充分验证了该反应机理的正确性。

Scheme 3 Reaction mechanism of BNFF with primary amine
3.2 参与反应的伯胺的选择性
选取几种比较常见的伯胺与BNFF反应,研究BNFF与不同伯胺反应的选择性,结果如表1所示。由表1可知,当伯胺为脂肪类时,氨基碱性较强,能很好和BNFF发生成环反应,随着氨基碱性变弱,成环反应产率降低。当伯胺为芳香类时,氨基很难与BNFF发生反应,无法得到产物。
表1 BNFF和不同伯胺反应的结果
Table 1 Results of BNFF reaction with different primary amines
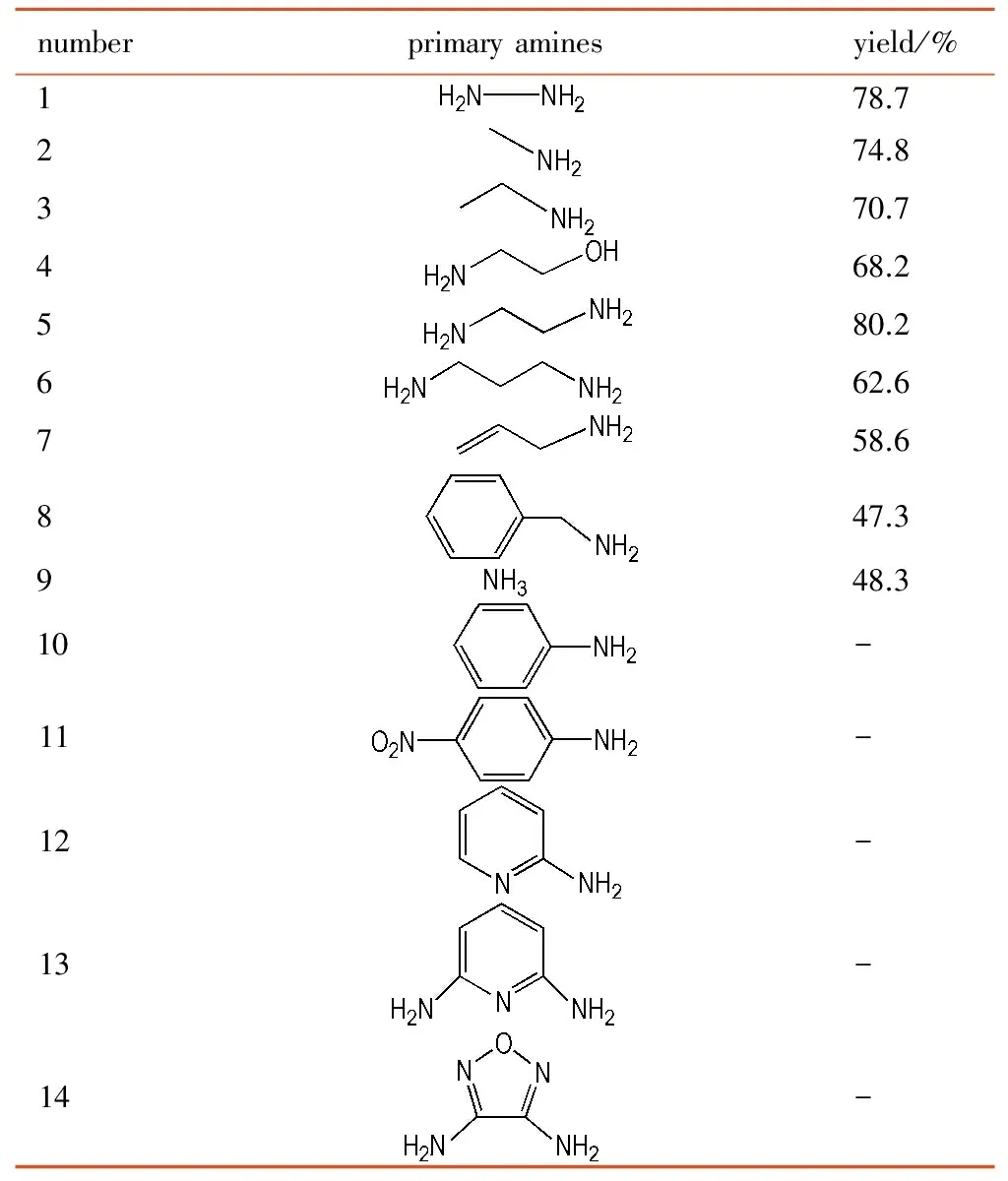
numberprimaryaminesyield/%178.7274.8370.7468.2580.2662.6758.6847.3948.310-11-12-13-14-
3.3 化合物j和k的热性能分析
化合物j和k的DSC曲线见图1,由图1可知,化合物j和k均有2个明显的放热峰, 258.03 ℃和 275.35 ℃为化合物j和k的第1阶段的热分解放热峰; 329.92 ℃和360.24 ℃为第2阶段的热分解放热峰。j和k的热稳定性优于BNFF,可与常规炸药RDX(210 ℃)、CL-20(210 ℃)、HMX(280 ℃)[2]相媲美。这可能是因为硝基苯环是热稳定性较好的基团,将硝基苯环引入到氮杂环庚三烯衍生物分子中,降低分子的位能,可以有效改善此类化合物的热稳定性。与化合物j相比,化合物k中苯环的氨基通过与邻位硝基相互作用形成的分子内氢键,使电荷平均分布,分子结构更加稳定,热稳定性更好,因此,化合物k比j的第一阶段分解温度升高了17.69 ℃,第二阶段分解温度升高了27.64 ℃。
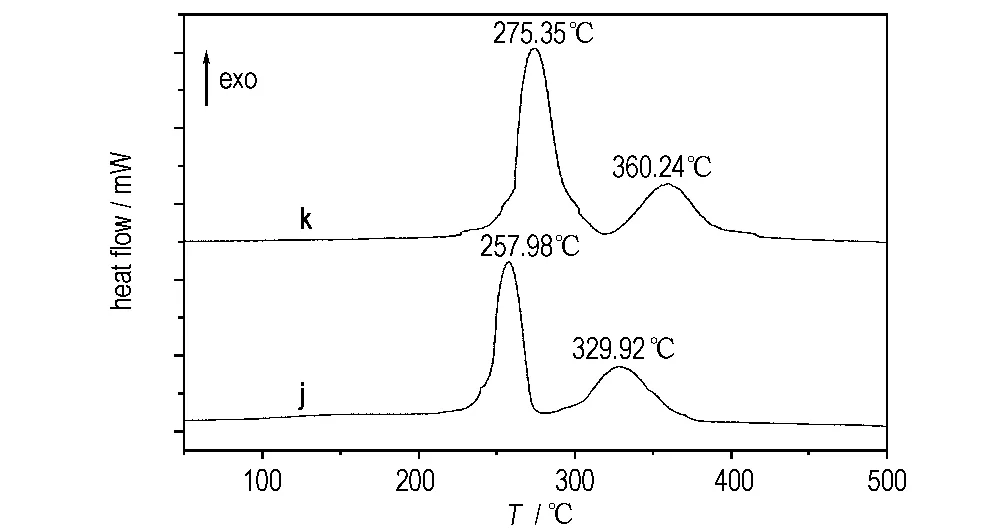
图1 化合物j和k的DSC曲线
Fig.1 DSC curves of compound j and k
3.4 爆轰性能预估
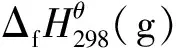
由表2可知,化合物j和k的爆轰性能与2,4,6-三硝基甲苯(TNT)、1,3-二硝基苯和1-氨基-2,4,6-三硝基苯等传统含能化合物相当,符合常规含能材料的性能要求。
表2 化合物j和k的爆轰性能预估
Table 2 Detonation performances of compound j and k

explosiveΔfHθ298(s)/kJ·mol-1ρ/g·cm-3Q/J·g-1D/m·s-1p/GPaj664.271.685444694521k616.291.744703643818TNT[25]-1.6350666928191,3⁃dinitrobenzene[25]-1.5846056100191⁃amino⁃2,4,6⁃trinitrobenzene[25]-1.724986730022
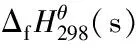
4 结 论
(1) 以BNFF为原料与9种脂肪族伯胺反应,生成氮杂环庚三烯产物a~i,采用核磁、红外、质谱等分析手段对所合成化合物进行表征。
(2) 将9种脂肪族伯胺和5种芳香族伯胺与BNFF的反应,分析BNFF和伯胺反应机理以及选择性,发现脂肪族的伯胺由于—NH2的强碱性,能很好和BNFF进行成环反应; 随着脂肪族伯胺中—NH2基团碱性增强,成环反应产率有所提高; 芳香族的伯胺中—NH2的碱性较弱,成环反应难以发生。
(3) 将c和2,4-二硝基氯苯、2,4,6-三硝基-3-氨基氯苯反应,将多硝基苯环结构引入到氮杂环庚三烯体系,得到化合物j和k,DSC分析表明,与原料相比,化合物j和k的热稳定性增强,同时,由于k分子中存在分子内氢键,增加了分子结构的稳定性,使 k和j相比,第一阶段和第二阶段分解峰温分别升高了17.69 ℃和27.64 ℃。
(4) 化合物j的理论密度为1.68 g·cm-3,标准摩尔生成焓为664.27 kJ·mol-1,其爆速和爆压分别为6945 m·s-1和21 GPa; 化合物k的理论密度为1.74 g·cm-3,标准摩尔生成焓为616.29 kJ·mol-1,其爆速和爆压分别为6438 m·s-1和18 GPa。
参考文献:
[1] Fischer D, Klapötke T M, Reymann M, et al. Dense energetic nitraminofurazanes[J].Chemistry-AEuropeanJournal, 2014, 20(21): 6401-6411.
[2] ZHANG Jia-heng, Shreeve J M. 3, 3′-Dinitroamino-4, 4′-azoxyfurazan and its derivatives: an assembly of diverse N-O building blocks for high-performance energetic materials[J].JournaloftheAmericanChemicalSociety, 2014, 136(11): 4437-4445.
[3] WANG Rui-hu, XU Hong-yan, GUO Yong, et al. Bis[3-(5-nitroamino-1,2,4-triazolate)]-based energetic salts: Synthesis and promising properties of a new family of high-density insensitive materials[J].JournaloftheAmericanChemicalSociety, 2010, 132(34): 11904-11905.
[4] LI Ya-nan, LIU Ning, LIAN Peng, et al. Synthesis and properties for twoN-amino derivatives of 4,8-dihydrodifurazano[3,4-b,e]pyrazine[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(1): 129-131.
[5] Stepanov A I, Astrat′ev A A, Dashko D V, et al. Synthesis of linear and cyclic compounds containing the 3,4-bis(furazan-3-yl)furoxan fragment[J].RussianChemicalBulletin,InternationalEdition, 2012, 61(5): 1024-1040.
[6] WANG Bo-zhou, ZHANG Guo-fang, HUO Huan, et al. Synthesis, characterization and thermal properties of energetic compounds derived from 3-amino-4-(tetrazol-5-yl)furazan[J].ChineseJournalofChemistry, 2011, 29(5): 919-924.
[7] Coburn M D. Picrylamino-substituted heterocycles. II. Furazans[J]. Journal of Heterocyclic Chemistry, 1968, 5(1): 83-87.
[8] 胡焕性, 覃光明, 张志忠, 等. 3, 4-二硝基呋咱基氧化呋咱炸药: 中国专利, 02101092.7[P]. 2002.
HU Huan-xing, TAN Guang-ming, ZHANG Zhi-zhong, et al. 3,4-di-nitrofurazanfuroxan explosive: China Patent, 02101092.7[P]. 2002.
[9] Aleksei B S, Elena A I, Spiridonova N P , et al. Desilylative nitration of C,N-disilylated 3-amino-4-methyl furazan[J].JournalofHeterocyclicChemistry, 2005, 42(6): 1237-1242.
[10] 周彦水, 王伯周, 李建康, 等. 3,4-双(4′-硝基呋咱-3′-基)氧化呋咱合成, 表征与性能研究[J]. 化学学报, 2011, 69(14): 1673-1680.
ZHOU Yan-shui, WANG Bo-zhou, LI Jian-kang, et al. Study on synthesis, characterization and properties of 3,4-bis(4′-nitrofurazano-3′-yl)furoxan[J].ActaChimicaSinica, 2011, 69(14): 1673-1680.
[11] 王亲会. 一种新型熔铸炸药研究[J]. 含能材料, 2004, 12(1): 46-47.
WANG Qin-hui. A new melt-cast explosive formulation[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2004, 12(1): 46-47.
[12] 郑伟, 王江宁, 韩芳, 等. DNTF-CMDB推进剂的化学安定性[J]. 火炸药学报, 2010, 33(4): 10-13.
ZHENG Wei, WANG Jiang-ning, HAN Fan, et al. Chemical stability of CMDB propellants containing DNTF[J].ChineseJournalofExplosives&Propellants, 2010, 33(4): 10-13.
[13] 赵凤起, 陈沛, 罗阳. 含3,4-二硝基呋咱基氧化呋咱(DNTF)的改性双基推进剂[J]. 推进技术, 2004, 25(6): 570-572.
ZHAO Feng-qi, CHEN Pei, LUO Yang. Study on the composite modified double base propellant containing 3,4-dinitro furazanfuroxan (DNTF) [J].JournalofPropulsionTechnology, 2004, 25(6): 570-572.
[14] Astrat′ev A A, Dashko D V, Stepanov A I. Unusual reaction of 3,4-bis(3-nitrofurazan-4-yl)furoxan with ammonia, primary amines and hydrazine[J].CentralEuropeanJournalofEnergeticMaterials, 2012, 10(4): 1087-1094.
[15] 葛忠学, 王锡杰, 姜俊, 等. 3, 4-二硝基呋咱的合成[J]. 合成化学, 2008, 16(3): 260-263.
GE Zhong-xue, WANG Xi-jie, JIANG Jun, et al. Synthesis of 3,4-dinitrofurazan[J].ChineseJournalofSyntheticChemistry, 2008, 16(3): 260-263.
[16] 张学梅, 董海山, 周智明, 等. 新法合成 1, 3-二氨基-5-甲氨基-2, 4, 6-三硝基苯[J]. 含能材料, 2009, 17(5): 523-526.
ZHANG Xue-mei, DONG Hai-shan, ZHOU Zhi-ming, et al. A new synthetic route to 1,3-diamino-5-methylamino -2,4,6-trinitrobenzene[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 17(5): 523-526.
[17] 周彦水, 张志忠, 李建康, 等. 3, 4-二硝基呋咱基氧化呋咱的晶体结构[J]. 火炸药学报, 2005, 28(2): 43-46.
ZHOU Yan-shui, ZHANG Zhi-zhong, LI Jian-kang, et al. Crystal structure of 3, 4-dinitrofurazanofuroxan[J].ChineseJournalofExplosives&Propellants, 2005, 28(2): 43-46.
[18] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 03, Revision B.05[CP] .Gaussian: Wallingford, inc., 2004.
[19] Gong C, Zeng X, Ju X. Comparative PM6 and PM3 study on heats of formation for high energetic materials[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 31: 445-450.
[20] Politzer P, Ma Y, Lane P, et al. Computational prediction of standard gas, liquid, and solid-phase heats of formation and heats of vaporization and sublimation[J].InternationalJournalQuantumChemistry, 2005, 105: 341-347.
[21] Politzer P,Martinez J, Murray J S, et al. An electrostatic interaction correction for improved crystal density prediction[J].MoleculePhysics. 2009, 107: 2095-2101.
[22] Kamlet M J, Jacobs S J. A simple method for calculating detonation properties of C—H—N—O explosives[J].TheJournalofChemicalPhysics, 1968, 48: 23-35.
[23] Politzer P, Murray J S. Some perspectives on estimating detonation properties of C, H, N, O compounds[J].CentralEuropeanJournalofEnergeticMaterials, 2011, 8: 209-220.
[24] Wang T, Zheng C, Yang J, et al. Theoretical studies on a new high energy density compound 6-amino-7-nitropyrazino[2,3-e] [1,2,3,4]tetrazine 1,3,5-trioxide (ANPTTO)[J].JournalMoleculeModel, 2014, 20: 2261-2271.
[25] 田德余, 赵凤起, 刘剑洪. 含能材料及相关物手册[M]. 北京: 国防工业出版社, 2011.
TIAN De-yu, ZHAO Feng-qi, LIU Jian-hong. Handbook of Energetic Materials and the Related Compounds[M]. Beijing:NationalDefenseIndustryPress, 2011.
