TKX-50合成方法改进
2015-05-10居平文凌亦飞谷玉凡
居平文, 凌亦飞, 谷玉凡, 罗 军
(南京理工大学化工学院, 江苏 南京 210094)
1 引 言
近年来,因四唑环类含能材料具有高密度、高生成焓、高气体生成量、低感度、热稳定性好以及爆轰产物多为洁净的N2等一系列优点,从而使得四唑类含能材料的研究成为高能钝感含能材料研究的热点[1-2]。2001年Tselinskii等人[3]合成了一种新型的联四唑化合物1,1′-二羟基-5,5′-联四唑 (H2DHBT),随后毕福强等人[4]也合成了该化合物并且对该化合物的结构和热稳定性进行了表征。随着离子液体研究的深入,含能离子盐被引入到单质炸药的设计中[5-6]。2012年德国慕尼黑大学报道了5,5′-联四唑-1,1′-二氧羟胺盐(TKX-50)[7],经测试在100 K下其密度高达1.918 g·cm-3,热分解温度为221 ℃,撞击感度为20 J,摩擦感度为120 N,静电感度为0.10 J; 经计算其爆速为9698 m·s-1,爆压为42.4 GPa。说明TKX-50是一种高性能钝感炸药,是黑索今的理想取代物。
目前TKX-50的合成方法主要有四种: (1)直接用过硫酸钾氧化5,5′-联四唑[7],但是氧化过程容易发生副反应,难分离,收率低。(2)“一锅法”二甲基甲酰胺(DMF)路线合成TKX-50[7]: 将二氯乙二肟作为起始原料溶于DMF,加入叠氮钠发生叠氮化反应,反应结束后直接将反应液加入到乙醚中,通入氯化氢气体直接发生环合反应,经处理得到二甲胺盐,最后在热水中与盐酸羟胺发生复分解反应,合成出TKX-50。朱周朔等人[8]优化了该工艺,实现了73.2%的收率。但是此法需要减压蒸馏除去水与DMF,而且操作复杂,适用于实验室。(3)“一锅法”N-甲基吡咯烷酮(NMP)合成TKX-50[7]: 将二氯乙二肟溶于NMP,加入叠氮化钠发生叠氮化反应,之后转移到乙醚中,通入氯化氢发生环合反应,反应结束后挥发乙醚,加氢氧化钠水溶解调节pH,回流冷却生成的1,1′-二羟基-5,5′-联四唑钠盐析出,后与盐酸羟胺发生复分解反应得到TKX-50。周智明等人[9]探讨了溶剂对叠氮化反应的影响并确定了最佳工艺条件。但是该“一锅法”只有在NMP作为溶剂的时候收率比较高,而NMP这种高沸点的有机溶剂处理成本偏高。(4)毕福强等人[10]以二氯乙二肟为起始原料,在DMF溶剂中加入叠氮化钠发生叠氮化反应,反应完全之后加水让二叠氮乙二肟析出后抽滤,滤饼加入到乙醚溶剂中,通入氯化氢气体发生环合反应生成1,1′-二羟基-5,5′-联四唑二水合物,然后加入氢氧化锂生成锂盐,最后锂盐再与盐酸羟胺发生复分解反应得到TKX-50。该方法生成的二叠氮基乙二肟需要在DMF中加水析出,收率有所下降,并且需要用到氢氧化锂与1,1′-二羟基-5,5′-联四唑二水合物生成锂盐,成本偏高。
为了克服上述合成方法的缺点,本课题组改进了TKX-50的合成方法: 二氯乙二肟在丙酮与水的混合溶剂中先叠氮化,后环合得到了1,1′-二羟基-5,5′-联四唑二水合物; 然后直接利用酸碱中和法成盐得到TKX-50。并且优化了这两步反应使得由二氯乙二肟合成TKX-50的收率上升到83%,简化了反应流程,提高了反应安全性。
2 实验部分
2.1 合成路线
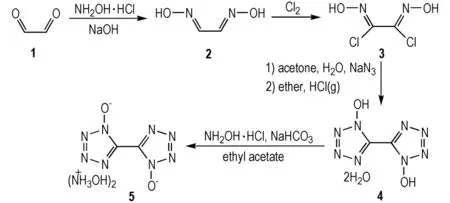
Scheme1Synthetic route of TKX-50
2.2 仪器与试剂
Nicolet Impact 410型傅里叶变换红外光谱仪 (美国Thermofisher公司); Bruker Avance-Ⅲ DRX 500MHz核磁共振仪 (德国Bruker公司); Vario EL-Ⅲ型元素分析仪 (德国Elemetar公司); Finnigan TSQ Quantum ultra AM 型质谱仪 (美国Finnigan公司)。所有药品和试剂均为国产市售分析纯,未经处理直接使用。
2.3 合成实验
2.3.1 乙二肟(2)的合成
参考文献[7]方法以91%的收率制得乙二肟。
2.3.2 二氯乙二肟(3)的合成
氯气直接氯化法[11]合成二氯乙二肟: 将乙二肟17.6 g(0.2 mol)加入200 mL无水乙醇加热搅拌至溶解后,冷却到-20 ℃,通氯气(约0.4 mol,由高锰酸钾与浓盐酸制得)50 min,再反应30 min,慢慢升温至室温,旋转蒸发到大量微黄色固体析出后抽滤,滤饼用二氯甲烷洗涤后得到白色粉末二氯乙二肟27 g(0.16 mol,84%)。1H NMR(DMSO-d6, 500 MHz)δ: 13.14(s, 2H);13C NMR(DMSO-d6, 126 MHz)δ: 130.9; Anal. Calcd for C2H2Cl2N2O2: C 15.65, H 1.25, N 17.49; found: C 15.19, H 1.31, N 17.49。
氧化氯化法[13]合成二氯乙二肟: 将乙二肟4.4 g(50 mmol)、10 mL水、盐酸11.1 mL(110 mmoL)加入到100 mL烧瓶中,通过恒压滴液漏斗缓慢滴加双氧水12. 5mL(110 mmoL),加入氯化钙 22.2 g(100 mmoL)搅拌溶解,冰浴,反应2 h,抽滤,得到少量白色粉末二氯乙二肟(1.4 g,2%)。
2.3.3 1,1′-二羟基-5,5′-联四唑二水合物(4)的合成
将二氯乙二肟8 g (50 mmol) 溶于100 mL丙酮和100 mL水的混合溶剂中,冷却至0 ℃后分批次加入叠氮化钠7.8 g(120 mmol),搅拌反应1.5 h,用无水乙醚萃取(3×100 mL),萃取液不经过任何处理直接通入氯化氢气体(过量),薄层色谱(乙酸乙酯∶石油醚体积比为2∶1)监测反应进程,挥发无水乙醚与氯化氢气体,抽滤后用少量冰水洗涤得到微黄色的1,1′-二羟基-5,5′-联四唑二水合物9.1 g (44 mmol,88%)。1H NMR (DMSO-d6, 500 MHz)δ: 6.40 (s, 2H);13C NMR (DMSO-d6, 126 MHz)δ:135.8; FT-IR(ν/cm-1): 3299, 1665, 1411, 1375, 1302, 1028, 1144, 995, 714, 662;m/z(ESI-): 168.99 [C2HN8O2-]; Anal. Calcd for C2H6N8O4: C 12.01, H 2.81, N 54.04; found: C 11.65, H 2.93, N 54.36。
2.3.4 1,1′-二羟基-5,5′-联四唑二羟胺盐(5)的合成
将1,1′-二羟基-5,5′-联四唑二水合物10.3 g(50 mmol)溶于200 mL的乙酸乙酯中,加入碳酸氢钠8.1 g(100 mmol) 和盐酸羟胺7.0 g(100 mmol),50 ℃条件下反应2 h后抽滤,用(0~5 ℃)冰水30 mL分三次水洗得到白色固体1,1′-二羟基-5,5′-联四唑二羟胺盐11.1 g(47 mmol,94%)。
1H NMR (DMSO-d6, 500 MHz)δ: 9.89 (brs, 2H);13C NMR (DMSO-d6, 126 MHz)δ: 135.4; FT-IR(ν/cm-1): 3415, 3219, 3081, 3050, 2936, 2689, 2513, 1599, 1577, 1527, 1426, 1413, 1389, 1352, 1338, 1316, 1236, 1174, 1145, 1095, 1046, 1029, 1011, 997, 800, 723, 676, 612;m/z(ESI-): 168.99 [C2HN8O2-]; Anal. Calcd for C2H8N10O4: C 10.05, H 3.63, N 59.31; found: C10.17, H 3.41, N 59.31。
3 结果与讨论
3.1 二氯乙二肟的合成方法选择
关于二氯乙二肟的合成,Peet等人[12]用N-氯代丁二酰亚胺氯化乙二肟得到二氯乙二肟,收率高达91%(第一种方法); 毕福强等人[11]直接用氯气氯化乙二肟得到二氯乙二肟,收率也高达91%(第二种方法); Innokent′evich等人[13]采用双氧水与氯化钙氧化氯化乙二肟的方法合成出了二氯乙二肟,收率高达93%(Scheme 2)(第三种方法)。

Scheme 2
第一种方法需要用到N-氯代丁二酰亚胺,成本太高,不适合大规模工业生产; 第三种方法本课题组尝试了多次发现,乙二肟的氧化氯化方法收率低,同时易生成一氯乙二肟副产物。
综合考虑选择第二种方法合成二氯乙二肟,该法具有成本低,收率高,适合工业化等特点。同时经过多次实验发现反应之前的预处理(加热使乙二肟完全溶于乙醇溶剂中)有利于提高该反应的收率。
3.2 叠氮化-环合反应
3.2.1 反应溶剂对叠氮化-环合反应收率的影响
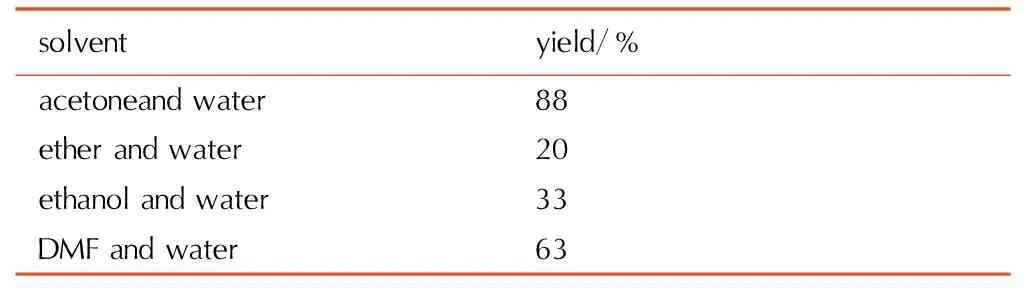
在0 ℃,n(二氯乙二肟)∶n(叠氮化钠)=1∶2.4,反应时间为1.5 h的条件下,考察了丙酮与水、乙醚与水、乙醇与水、DMF与水(体积比均为1∶1)的混合溶剂对1,1′-二羟基-5,5′-联四唑二水合物的收率的影响,具体结果见表1。
表1混合溶剂对叠氮化-环合反应收率的影响
Table1Effect of mixed solvent on yield of azidation-cyclization
solventyield/%acetoneandwater88etherandwater20ethanolandwater33DMFandwater63
由表1可知,当以乙醚与水作为混合溶剂时,由于水与乙醚不能混溶,从而使得叠氮化钠与二氯乙二肟不能完全接触,反应很难进行,收率仅为20%; 当以乙醇和水作为混合溶剂时,叠氮基乙二肟很难从乙醇和水的混合溶剂中萃取出来,收率也不高,仅为33%。当以DMF与水作为混合溶剂时,DMF沸点高,难处理,只能通过加水的方式让二叠氮基乙二肟析出,最终导致收率不高。当丙酮与水作为混合溶剂时,可以避免过滤二叠氮基乙二肟固体,也可以避免一些高沸点的溶剂如DMF与NMP等的使用; 同时通过萃取的的处理方式也可以将1,1′-二羟基-5,5′-联四唑二水合物的收率提高至88%。因此,最适宜的混合溶剂为丙酮与水。
3.2.2 反应温度对叠氮化-环合反应收率的影响
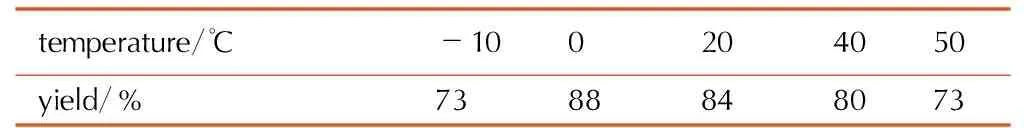
在丙酮与水作为混合溶剂,n(二氯乙二肟)∶n(叠氮化钠)=1∶2.4,反应时间为1.5 h的条件下,考察反应温度对1,1′-二羟基-5,5′-联四唑二水合物的收率的影响,具体结果见表2。
表2反应温度对叠氮化-环合反应收率的影响
Table2Effect of reaction temperature on yield of azidation-cyclization
temperature/℃-100204050yield/%7388848073
由表2可见,反应温度低时收率较低; 随着温度的升高,叠氮化收率逐渐提高; 继续升高温度,产物的收率和纯度都有所降低,这可能是因为温度较低时,叠氮化反应速率慢,而温度太高,会生成副产物。因此,适宜的反应温度为0 ℃。
3.2.3 反应时间对叠氮化-环合反应的收率的影响
在0 ℃,丙酮与水作为混合溶剂,n(二氯乙二肟)∶n(叠氮化钠)=1∶2.4的条件下,考察反应时间对1,1′-二羟基-5,5′-联四唑二水合物收率的影响,具体结果见表3。
表3反应时间对叠氮化-环合反应收率的影响
Table3Effect of reaction time on yield of azidation-cyclization

time/h0.51.52.53.5yield/%70888583
由表3可见,随着反应时间的增加,1,1′-二羟基-5,5′-联四唑二水合物收率逐渐增高,当反应时间为1.5 h时收率最高,再延长反应时间,收率没有明显提高。因此,最佳反应时间为1.5 h。
3.3 酸碱中和反应
3.3.1 反应溶剂对酸碱中和收率的影响
在50 ℃,n(1,1′-二羟基-5,5′-联四唑二水合物)∶n(盐酸羟胺)∶n(碳酸氢钠)=1∶2∶2,反应时间为2 h的条件下,选取了水、乙酸乙酯、甲醇、二氯甲烷为反应溶剂,考察反应溶剂对收率的影响,具体结果见表4。由表4可知,当以乙酸乙酯为溶剂时,TKX-50收率最高,为94%,这可能是因为当以水作为溶剂时,由于产物TKX-50能部分溶于水,从而导致直接过滤的处理方法收率不高,浓缩溶剂也比较危险。同样,当以甲醇作为反应溶剂时,产物TKX-50能部分溶于甲醇,从而导致收率不高。当以二氯甲烷作为溶剂时,1,1′-二羟基-5,5′-联四唑二水合物不溶于二氯甲烷,反应很难进行,从而导致收率降低。由于原料1,1′-二羟基-5,5′-联四唑二水合物易溶于乙酸乙酯而产物TKX-50难溶于乙酸乙酯,可以通过简单的过滤后冰水洗涤的方法得到产物TKX-50。因此,酸碱中和反应的最佳溶剂是乙酸乙酯。
表4反应溶剂对酸碱中和反应的影响
Table4Effect of solvent on yield of neutralization

solventwaterethylacetatemethyldichloromethaneyield/%50947030
3.3.2 反应温度对酸碱中和反应收率的影响
在乙酸乙酯作为溶剂,n(1,1′-二羟基-5,5′-联四唑二水合物)∶n(盐酸羟胺)∶n(碳酸氢钠)=1∶2∶2,反应时间为2 h的条件下,考察反应温度对TKX-50收率的影响,具体结果见表5。
表5反应温度对酸碱中和反应收率的影响
Table5Effect of reaction temperature on yield of neutralization

temperature/℃2030405055yield/%2755719493
由表5可见,随着反应温度的增加,TKX-50收率增大,当温度升至50 ℃时,收率最高,达94%,之后再升高温度,收率变化不大,这可能是因为反应温度低时,酸碱中和速率慢,收率较低; 随着温度的升高,酸碱中和反应速率变快,收率逐渐提高。因此,适宜的温度为50 ℃。
3.3.3 反应时间对酸碱中和反应收率的影响
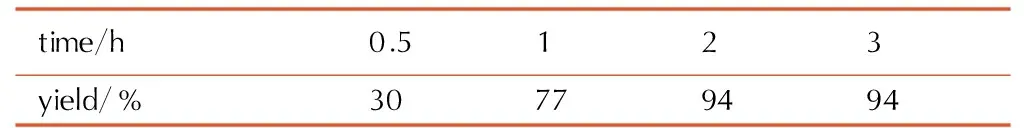
在50 ℃,乙酸乙酯作为溶剂,n(1,1′-二羟基-5,5′-联四唑二水合物)∶n(盐酸羟胺)∶n(碳酸氢钠)=1∶2∶2的条件下,考察反应时间对TKX-50收率的影响,具体结果见表6。
表6反应时间对酸碱中和收率的影响
Table6Effect of reaction time on yield of neutralization
time/h0.5123yield/%30779494
由表6可见,随着反应时间的增加,收率增大,2 h时收率最大,达94%,再延长反应时间收率不再增加。这可能是因为2 h时酸碱中和完全反应。因此,适宜的反应时间为2 h。
4 结 论
(1) 以乙二醛原料,经过肟化、氯化、叠氮化-环合和酸碱中和等反应合成了TKX-50。并利用核磁共振、红外、质谱、元素分析等对产物进行了表征。此法避免了敏感中间产物二叠氮基乙二肟的以固体形式存在,使得该方法操作安全; 直接在萃取液中通氯气发生环合反应,使得该方法操作简单; 利用酸碱中和直接合成TKX-50,使得该方法操作简单。因此,该方法合成TKX-50,具有一定的工业化应用前景。
(2) 优化了叠氮化-环合反应条件: 以丙酮与水作为混合溶剂,n(二氯乙二肟)∶n(叠氮化钠)=1∶2.4,反应温度为0 ℃,反应时间为1.5 h,收率为88%。
(3) 优化了酸碱中和反应条件: 溶剂为乙酸乙酯,n(1,1′-二羟基-5,5′-联四唑二水合物)∶n(盐酸羟胺)∶n(碳酸氢钠)=1∶2∶2,反应时间为2 h,反应温度为50 ℃,收率为94%。
参考文献:
[1] 彭蕾, 李玉川, 杨雨璋, 等. 双环和多环四唑含能化合物的合成研究进展[J]. 有机化学, 2012, 32: 667-676.
PENG Lei, LI Yu-chun, YANG Yu-zhang, et al. Research progress in synthesis of energetic compounds of bicycle-and multicyclo-tetrazoles[J].ChineseJournalofOrganicChemistry, 2012, 32: 667-676.
[2] 居平文, 凌亦飞, 王桂香, 等. 一种新型高氮含能化合物5-((5-硝基-2H-四唑-2-基)甲基)-1H-四唑-1-醇的合成与表征[J]. 有机化学, 2015, 35: 236-240.
JU Ping-wen, LING Yi-fei, WANG Gui-xiang, et al. Synthesis and characterization of a novel high nitrogen energetic compound 5-((5-Nitro-2H-tetrazol-2-yl)methyl)-1H-tetrazol-1-ol[J].ChineseJournalofOrganicChemistry, 2015, 35: 236-240.
[3] Tselinskii I V, Mel′nikova S F, Romanova T V. Synthesis and reactivity of carbohydroximoyl azides: I. aliphatic and aromatic carbohydroximoyl azides and 5-Substituted 1-hydroxytetrazoles based thereon[J].RussiaJournalofOrganicChemistry, 2001, 37(3): 455-461.
[4] 毕福强, 樊学忠, 许成, 等. 1,1′-二羟基-5,5′-联四唑的合成及理论研究[J]. 火炸药学报, 2013, 36(4): 22-25.
BI Fu-qiang, FAN Xue-zhong, XU Cheng, et al. Synthesis and theoretical study of 1,1′-dihydroxy-5,5′-bistetrazole[J].ChineseJournalofExplosives&Propellants,2013, 36(4): 22-25.
[5] Gao H, Shreeve J M. Azole-based energetic salts[J].ChemicalReviews, 2011, 111: 7377-7436.
[6] 黄海丰, 周智明. 基于有机阴离子的含能离子盐研究进展[J]. 火炸药学报, 2012, 35(6): 1-10.
HUANG Hai-feng, ZHOU Zhi-ming. Progress of study on organic anion based on energetic salts[J].ChineseJournalofExplosives&Propellants, 2012, 35(6): 1-10.
[7] Fischer N, Fischer D, Klapotke T M, et al. Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].JournalofMaterialsChemistry, 2012, 22: 20418-20422.
[8] 朱周朔, 姜振明, 王鹏程, 等. 5,5′-联四唑-1,1′-二氧二羟胺的合成及其性能[J]. 含能材料, 2014, 22(3): 332-336.
ZHU Zhou-shuo, JIANG Zheng-ming, WANG Peng-cheng, et al. Synthesis and properties of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(3): 332-336.
[9] 周智明, 梁丽轩, 唐立伟, 等. 一种5,5′-联四唑-1,1′-二氧羟胺盐 (TKX-50) 的合成方法. CN: 103524444[P], 2014.
[10] 毕福强, 肖川, 许成, 等. 1,1′-二羟基-5,5′-联四唑二羟胺盐的合成与性能[J]. 含能材料, 2014, 22(2): 272-273.
BI Fu-qiang, XIE Chuan, XU Cheng, et al. Synthesis and properties of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(2): 272-273.
[11] 毕福强, 王伯周, 王锡杰, 等. 1,4-二硝基呋咱并[ 3, 4-b]哌嗪 (DNFP) 的合成[J]. 含能材料, 2009, 17(5): 537-540.
BI Fu-qiang, WANG Bo-zhou, XANG Xi-jie, et al. Synthesis of 1,4-dinitrofurazano[3, 4-b]piperazine (DNFP)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 17(5): 537-540.
[12] Peet P L, Connell T U, Gunawan G, et al. A click chemistry approach to 5,5′-disubstituted-3,3′-bisisoxazolesfrom dichloroglyoxime and alkynes: luminescent organometallicIridium and rhenium bisisoxazole complexes[J].JournalofOrganicChemistry, 2013, 78: 7298-7304.
[13] Innokent′evich V V,Iosifovna T S. Method for preparing dichloroglyoxime: RU. 2313517[P], 2006.
