葡萄酒中外源性天然色素掺伪检测
2015-05-08赵广西李志芬张克义
赵广西,刘 浩,李志芬,杜 伟,杨 帛,张克义
(1.国家葡萄、葡萄酒质量监督检验中心(秦皇岛),河北秦皇岛 066000;2.秦皇岛市食品药品检验中心,河北秦皇岛 066000)
葡萄酒中外源性天然色素掺伪检测
赵广西1,刘 浩1,李志芬2,杜 伟1,杨 帛1,张克义1
(1.国家葡萄、葡萄酒质量监督检验中心(秦皇岛),河北秦皇岛 066000;2.秦皇岛市食品药品检验中心,河北秦皇岛 066000)
研究确定了葡萄酒中可能添加的天然色素种类是花青素类物质,并建立了葡萄酒中花色苷的检测方法,样品经SPE提取后高效液相色谱荧光法进行定性、定量分析。确定了葡萄酒中6种主要呈色物质:锦葵素-3-葡萄糖苷;锦葵素-3-乙酰葡萄糖苷;锦葵素-3-p-香豆酰葡萄糖苷;芍药素-3-葡萄糖苷;飞燕草素-3-葡萄糖苷;矮牵牛色素-3-葡萄糖苷,比例分别为5∶1.5∶1∶0.5∶0.4∶0.4,当酒中原有花色苷种类和比例出现剧烈变化时,即可判定添加了外源花色苷,方法可以有效判定酒中是否添加外源花色苷。
高效液相色谱法,鉴别检测,天然色素
天然色素是由天然资源获得的食用色素。天然色素不仅给予食品增添了风味,而且相当部分具有一定的生理活性。目前,开发利用天然色素,已成为食品、化妆品业的发展趋势。尤其是欧美一些发达国家在食品中使用天然色素的比例已达 85%,并有完全取代合成色素的趋势,在我国每年生产的食品色素中天然色素也占了90%[1-3]。但天然色素也存在严重的滥用、乱用问题。因此市场上存在着大量天然色素调色产品,其以次充好,以假乱真,造成了市场的混乱。
食品天然色素主要来源于植物色素,根据其化学结构,分为花青素、类胡萝卜素、叶绿素。其中花青素类色素水溶性好,在微酸条件下对光、热条件变化的反应比较稳定且自然界植物资源丰富。尤其是主要为农副产品综合利用,价格低廉、成本低,如红米色素、黑豆皮素、萝卜红、葡萄皮、越橘红、黑加仑、红玫瑰茄色素等,是果酒中常用的着色剂[4]。
目前花青素主要检测方法有层析法[5]、分光光度法[6]、液相色谱法[7-11]、液质联用法[12-15]等。其中层析法、分光光度法难以实现对多种色素的同时检测。高效液相色谱-质谱法仪器昂贵,保养使用精细。高效液相色谱法方法简单,重复性好,结果准确,是目前主要方法。
本文研究利用高效液相色谱法测定葡萄酒中主要花色苷含量和比例,比较了添加外源色素后对酒中原有色素含量和比例的变化,确定葡萄酒中外源色素通用检测方法,为葡萄酒的检测提供有效的理论依据。
1 材料与方法
1.1 材料与仪器
乙腈、甲醇 色谱纯,迪马公司;甲酸、三氟乙酸、氨水 分析纯,天津市化学试剂三厂;锦葵色素-3-葡萄糖苷、锦葵素-3-p-香豆酰葡萄糖苷、锦葵素-3-乙酰葡萄糖苷、飞燕草素-3-芸香糖苷、芍药素-3-葡萄糖苷、矮牵牛色素-3-葡萄糖苷 Sigma公司;Cleanert PCX(6mL/500mg) 天津博纳艾杰尔科技有限公司。

表2 葡萄酒中12种花色苷
葡萄酒样品:昌黎当地购买。
Agilent 1100高效液相色谱仪,配有紫外检测器 美国安捷伦公司;IKA旋转蒸发仪 德国IKA。
1.2 实验方法
1.2.1 色谱条件 色谱柱:Phenomenex C184.6mm×250mm,4μm;柱温箱温度:30℃;流动相:水+甲酸(95+5)(A)和甲醇+乙腈+水+甲酸(22.5+22.5+45+5)(B),梯度洗脱,见表1;流速:1mL·min-1;进样量:10μL;检测器:紫外检测器;检测波长:520nm。

表1 流动相梯度洗脱程序
1.2.2 样品处理 取5mL酒样过2%三氟乙酸12mL活化后的Cleanert PCX小柱,酸化甲醇12mL清洗杂质,5%氨水-甲醇(40:60)6mL洗脱,收集洗脱液加甲酸调节pH到2后旋蒸定容5mL,用0.45μm的超滤膜过滤提取液,供分析用[16-17]。
1.2.3 标准溶液的配制 取适量标品在超纯水溶解后定容,配制成10、50、100、500mg/L的标准溶液,置于4℃冰箱中备用。
1.2.4 检出限 选10mg/L色素标准品溶液,进行测定,方法的检出限(LOD)定义为产生3倍信噪比(S/N=3)的化合物的质量浓度,信噪比S/N=3 时,计算检出限。
1.2.5 添加回收率及重复性 对不同质量浓度的色素标准品在同一天内连续进样 6 次,所得峰面积计算相对标准偏差(RSD);取5mL酒样加入不同浓度的色素标准品配成加标样品,摇匀后静置,按照1.2.2提取方法进行加标回收试验。
1.2.6 样品测定 在1.2.1条件下,分别将标准溶液和待测液注入高效液相色谱仪中,以保留时间定性,以待测液峰面积与标准溶液峰面积比较定量。
2 结果与分析
2.1 色谱条件优化
葡萄酒中的花色苷主要为矢车菊素、飞燕草素、锦葵色素、甲基花青素以及矮牵牛苷配基5种花色素诱导体。研究对红葡萄酒进行大量检测,实验认为葡萄酒中花色苷主要为飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、矮牵牛-3-葡萄糖苷、芍药素-3-葡萄糖苷、锦葵色素-3-葡萄糖苷、翠雀素-3-乙酰葡萄糖苷、花青素-3-乙酰葡萄糖苷、矮牵牛-3-乙酰葡萄糖苷、甲基花青素-3-乙酰葡萄糖苷、锦葵色素-3-乙酰葡萄糖苷、甲基花青素香豆素-3-葡萄糖苷、锦葵色素-3-香豆酰葡萄糖苷12种。
其中锦葵色素-3-葡萄糖苷、锦葵色素-3-乙酰葡萄糖苷和锦葵色素-3-p-香豆酰葡萄糖苷含量最多,其次是芍药素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷和矮牵牛色素-3-葡萄糖苷等。由于这六种花色苷含量最高,因此选取这六种花色苷作为主要研究对象。
2.2 花色苷的光谱分析
花色苷是类黄酮化合物,在280nm和520nm左右的两个波长处有特征吸收峰,而干扰花色苷分析的其他类黄酮化合物(如黄酮、黄烷酮、黄酮醇、黄烷醇等)在紫外区300~350nm和240~285nm有特征吸收峰。而实验发现12种花色苷其最大吸收波长略有差异,但在520nm波长处均有较强的吸收,为兼顾灵敏度,选择520nm为检测波长[18-20]。
2.3 固相萃取

表3 色素的回归分析结果和相关系数
简单过滤的样品中含有一定量糖、酸、盐,而且样品中的酚类成分往往干扰检测,样品分析前的净化,将会大大提高灵敏度,并使基线更加平稳。
本文比较了Sep-Pak-C18反相C18柱;Cleanert PCX阳离子交换混合机理柱;阳离子和反相C18混合柱[21-23]。C18通用型硅胶基质键合相C18小柱,具有强疏水性,能从水相中吸附弱疏水性的分析物,与反相HPLC柱相似,回收率在65%左右。Cleanert PCX是以阳离子交换混合机理的水可浸润型聚合物为基质的萃取柱。提供离子交换与反相保留柱,可在酸性条件下与由于花色苷的碱性基团相互作用,而环境变为碱性时,结合被迅速破坏从而被迅速、彻底的洗脱,因此对花色苷类有着较好回收率为93%左右。
2.4 色谱柱的选择
色谱柱的选择是检测的先决条件,对整个检测结果影响重大,花色苷检测色谱柱主要可分为三种:传统C18柱、苯基柱、离子交换和反相C18混合柱。C18柱主要以C18的C-H与花色苷分子间通过范德华力产生保留,是花色苷的传统分离柱。苯基柱通过苯基固定相的π电子与花色苷分子的π电子发生作用产生保留。离子交换和反相C18混合模式柱具有疏水作用和离子交换的双重机理,在C18柱基础上,在酸性环境中固定相与花青素分子极性相反,相互作用,分离度极好[24]。针对三种不同类型色谱柱,分别选取C18柱Phenomenex Synergi Hydro-RP 4.6mm×250mm;苯基柱Agilent Eclipse Plus 4.6mm×250mm;混合柱Thermo Scientific Accucore 2.1mm×150mm,进行比较。
实验表明三种色谱柱均能对主要花色苷实现较好分离,但对含量较少的花色苷分离有所差别。如芍药素-3-葡萄糖苷和锦葵花色素-3-O-葡萄糖;矢车菊素-3-葡萄糖苷和飞燕草-3-葡萄糖苷的分离;牵牛色素-3-葡萄糖苷和矢车菊素阿拉伯糖苷。通过综合比较,选取了Phenomenex Synergi Hydro-RP柱。
2.5 流动相选择
在反相色谱系统中花色苷的分离主要取决于分子极性和化学结构[25]。由于花色苷都是酸稳定型而且酸性环境中520nm下的吸收最好。因此试验中首先选取了甲醇-磷酸、甲醇-甲酸、甲醇-三氟乙酸进行检测,以甲酸效果最好。
在实验过程中,尝试不同比例的流动相。结果发现当乙腈比例高时,出峰时间过早,与溶剂峰太近难以区分,分离效果不好;而当乙腈所占比例为低时,虽然分离效果明显,但出峰时间过长。经多次试验后,并参考资料最终选用甲醇-乙腈-水混合体系进行洗脱[26-29]。以水+甲酸(95+5)(A)和甲醇+乙腈+水+甲酸(22.5+22.5+45+5)(B)为流动相,能有效的起到分离的效果。
在此体系下,质子溶剂水、甲醇和极性非质子溶剂乙腈相混合,各个组分得到了良好的分离,色谱的选择性和洗脱强度都有所提高,对各组分的分离度较高且峰形对称性良好。
2.6 柱温
研究对30~55℃进行了多次实验。实验表明,随着温度的升高,分离度有轻微的下降,而且对比30℃和55℃,当温度升高时部分花色苷没有分离或分离度下降。同时柱温的不同也影响到出峰的顺序。
2.7 方法学考察
2.7.1 线性方程和相关系数 将配制系列质量浓度的标准溶液按照1.2.1色谱条件检测,测定各质量浓度样品的峰面积,以质量浓度X(mg/mL)对峰面积Y进行线性回归分析,线性回归方程、相关系数如表3所示。

图1 昌黎赤霞珠葡萄酒中六种花色苷检测Fig.1 6 anthocyanins in dry red wine of cabernet sauvignon in changli
2.7.2 检出限、回收率及重复性 对不同质量浓度的色素标准品在同一天内连续进样 6 次,所得峰面积的相对标准偏差(RSD)为2.7%~3.5%,表明该方法具有较好的精密度。方法的检出限(LOD)定义为产生3倍信噪比(S/N=3)的化合物的质量浓度,选10mg/L色素标准品溶液,进行测定,信噪比S/N=3 时,检出限如下,实验结果表明本方法的灵敏度较高,能满足对色素检测和掺假控制的要求。

表5 昌黎赤霞珠葡萄酒中六种花色苷含量分析
2.8 红葡萄酒中六种花色苷含量和比例
2.8.1 当地红葡萄酒中六种花色苷的检测 按照1.2.1的方法,选取不含外源色素的葡萄酒的5组样品进行色素含量检测,确定酒中主要是6种色素,含量分别为锦葵素-3-葡萄糖苷在420~485mg/kg;锦葵素-3-乙酰葡萄糖苷125~145mg/kg;锦葵素-3-香豆酰葡萄糖苷62~92mg/kg;芍药素-3-葡萄糖苷24~56mg/kg;飞燕草素-3-葡萄糖苷33~56mg/kg;矮牵牛色素-3-葡萄糖苷32~55mg/kg;比例为50∶16∶8∶4∶4∶4,结果与文献基本相符[30-31]。
表4 样本的回归分析结果和检出限
2.8.2 添加红米红色素后红葡萄酒中矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷含量和比例 从表5可知葡萄酒中6种主要色素,而红米红色素中主要呈色物质为矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷。向葡萄酒样品中添加红米红色素观察结果。

表6 五种天然色素及其主要呈色物质
方法中基线在开始时归零,并随时间延长不断降低,在图2中时间为32min开始所以基线值低于“0”。

图2 昌黎赤霞珠葡萄酒中矢车菊素-3-O-葡萄糖苷/芍药素-3-O-葡萄糖苷含量Fig.2 Content of Cyaniding-3-glucoside and Peonidin-3-glucoside in Cabernet Wine
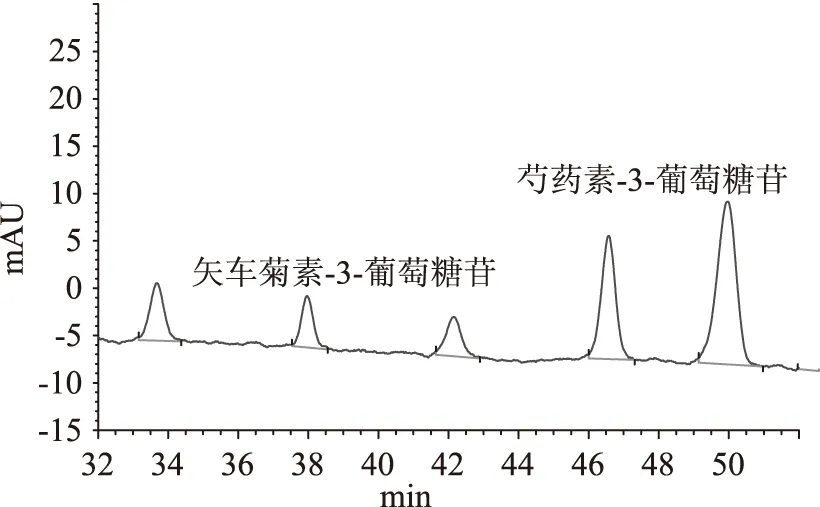
图3 昌黎赤霞珠葡萄酒中添加外源红米红色素30mg·kg-1检出图Fig.3 The content of 30mg·kg-1 back rice pigmen in cabernet wine
试验确定添加微量的红米红色素,葡萄酒中的矢车菊素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷的比值即会发生巨大变化,添加量越大比值变化越大。图3为昌黎赤霞珠葡萄酒中添加外源红米红色素30mg·kg-1色谱图。
2.8.3 市场样品测定 在市场购买15款干红葡萄酒进行检测,按照1.2.2的方法进行提取,按照1.2.1的色谱条件进行测定。发现其中14款的产品中色素比例与表5相一致,仅1款产品中矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷含量分别为170mg/kg和50mg/kg,矢车菊素-3-葡萄糖苷超过芍药素-3-葡萄糖苷含量,比例3∶1,与表5的比例有较大差距,因此,判断酒中添加有主要成色物质是矢车菊素-3-O-葡萄糖苷的红米红色素。
3 结论与讨论
我国《GB 15037-2006葡萄酒》标准中明确规定不得添加合成着色剂,但对天然色素并没有提及,酒中添加天然色素进行护色着色是葡萄酒行业的一种经常做法,但往往在标识上并不标注,由于我国没有相应检测方法,许多消费者往往被蒙骗。
天然色素种类多样,如果每种都建立相应的检测方法,方法必然繁琐且难以实现对市场的即时反应。实验研究了酒中自身和可能添加的天然色素的类型主要为花青素类物质,并建立统一的检测方法,确定了葡萄酒中主要呈色物质为锦葵素-3-葡萄糖苷、锦葵素-3-乙酰葡萄糖苷和锦葵素- 3-p-香豆酰葡萄糖苷、芍药素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷和矮牵牛色素-3-葡萄糖苷,并确定互相比例[32-35]。六种物质比例基本稳定,因此当酒中添加少量的外源天然色素后即会急剧改变酒中花色苷比例或增加新的种类,通过监测变化可以判定酒中是否添加外源天然色素。
方法采用快速、简便、通用的前处理方法与色谱条件,建立了果酒和饮料中天然色素检测的高效液相色谱方法,可以对市场上绝大多数天然色素进行检测,无需专一的方法,适用性强,通用性好,解决了天然色素检测难题。方法经多次实验证实准确、可靠,适用于实际样品中多种天然色素的检测。
[1] 徐铮奎. 天然色素贸易喜忧交集[N]. 医药经济报,2013-06-10.
[2] 陈志炎,毛恒杰. 天然色素稳定性的研究[J]. 新乡学院学报:自然科学版,2013,30(6):426-429.
[3] 权伍荣,金铁,李铉军. 食品天然色素的特点、分类及发展前景[J]. 延边大学农学学报,2012,34(2):181-184.
[4] 白海娜,王振宇. 花色素研究进展[J]. 中国林副特产,2011(5):46-49.
[5] Sushma Bondre,Pallavi Patil,Amaraja Kulkarni,M M Pillai.Study on isolation and purification of anthocyanins and its application as pH indicator[J].International Journal of Advanced Biotechnology and Research ISSN 0976-2612,Online ISSN 2278-599X,2012,3(3):698-702.
[6] Chuanguang QiN,Yang Li,Weining Niu,et al.Analysis and Characterisation of Anthocyanins in Mulberry Fruit[J].Czech J.Food Sci,2010,28(2):117-126.
[7] Pranathi P Perati,Brian M De Borba,Jeffrey S Rohrer.Rapid Separation of Anthocyanins in Cranberry and Bilberry Extracts Using a Core-Shell Particle Column[J].Application Note 1042 Thermo Fisher Scientific,Sunnyvale,CA,USA.
[8] Gitta Ficzek,György Végvári,Gergö Sándor,et al.HPLC evaluation of anthocyanin components in the fruits of Hungarian sour cherry cultivars during ripening[J].Journal of Food,Agriculture & Environment,2011,9(1):30-35.
[9] Ana Cristina Miranda Senna GOUVêA,Manuela Cristina Pessanha de ARAUJO,Daniel Filisberto SCHULZ,et al.Anthocyanins standards(cyanidin-3-O-glucoside and cyanidin-3-O-rutinoside)isolation from freeze-dried açaí(Euterpe oleraceae Mart.)by HPLC[S].Ciência e Tecnologia de Alimentos ISSN 0101-2061.
[10] 张晓芳,高伟,邓慧颖,等. 红米红中矢车菊-3-葡萄糖苷含量与色价的相关性分析[J]. 食品科学,2013,15(1):135-138.
[11] 肖长城,李甲明,姚改芳,等. 不同红梨品种果皮中花色素苷组分及含量特征分析[J].南京农业大学学报,2014,4(8):http://www.cnki.net/kcms/detail/32.1148.S.20140408. 1634.011.html.
[12] Wen-jiang Huang,Shao-ling Zhang,Gai-hua Qin,et al.Isolation and determination of major anthocyanin pigments in the pericarp of P. communis L. cv. ‘Red Du Comices’ and their association with antioxidant activity[J].African Journal of Agricultural Research,2012,7(26):3772-3780.
[13] LC-MS Analysis of Anthocyanins in Bilberry Extract [EB/OL]. Application Brief 134 part Of Thermo fisher Scientific(2011). http:∥www.thermoscientific.com/dionex.
[14] 韩豪,李新生,江海,等.UPLC MS/MS定性分析黑米中花青苷类物质[J].食品工业科技,2014,03(17):http://www.cnki.net/kcms/detail/11.1759.TS.20140317.0933.011.html.
[15] Jeremy S.Barnes.Analytical characterization of anthocyanins from natural products by reverse-phase liquid chromatography-photodiode array-electrospray ionization-ion trap-time of flight mass spectrometry[D].the university of texas at arlington December,2010:55-56.
[16] He J,Giusti M M. High-purity isolation of anthocyanins mixtures from fruits and vegetables-A novel solid-phase extraction method using mixed mode cation-exchange chromatography[J]. Journal of Chromatography A,2011,1218(44):7914-7922.
[17] Ruiz A,Mardones C,Vergara C,et al. Analysis of hydroxycinnamic acids derivatives in calafate berries by liquid chromatography with photodiode array and mass spectrometry detection[J]. Journal of Chromatography A,2013,1281:38-45.
[18] 陈凤清,丛建民,冯俊奎,等. 葡萄皮色苷理化性质及抑菌活性研究[J]. 中国酿造,2012,31(3):42-44.
[19] 樊金玲,朱文学,沈军卫,等.高效液相色谱-电喷雾质谱法分析牡丹花中花色苷类化合物[J]. 食品科学,2007,28(8):367-381.
[20] 王卫东,李超,许时婴.高效液相色谱-串联质谱法分离鉴定黑莓花色苷[J]. 食品科学,2009,30(14):230-234.
[21] Chun Cui,Shaomin Zhang,Lijun You,et al.Antioxidant capacity of anthocyanins from Rhodomyrtus tomenstosa(Ait.)and identification of the major anthocyanins[J]. Food Chemistry,2013,(139):1-8.
[22] He J,Giusti MM.High-purity isolation of anthocyanins mixtures from fruits and vegetables-A novel solid-phase extraction method using mixed mode cation-exchange chromatography[J].Chromatogr A,2011,1218(44):7914-7922.
[23] Petko Denev,Milan Ciz,Gabriela Ambrozova,et al.Solid-phase extraction of berries’ anthocyanins and evaluation of their antioxidative properties[J]. Food Chemistry,2010,(123):1055-1061.
[24] Bálint Berente,Manfred Reichenbächer,Klaus Danzer. Improvement of the HPLC analysis of anthocyanins in red wines by use of recently developed columns in red wines by use of recently developed columns[J]. Fresenius J Anal Chem(2001)371:68-72.
[25] Jason L McCallum,Raymond Yang,J Christopher Young,et al. Improved high performance liquid chromatographic separation of anthocyanin compounds from grapes using a novel mixed-mode ion-exchange reversed-phase column[J]. Chromatography A,2007,(1148):38-45.
[26]P.M.Dey,J.B.Harborne. methods in plant biochemistry [M]. San diego press inc,1989(1):334-334.
[27] OIV-MA-AS315-11. HPLC-Determination of nine major anthocyanins in red and rose wine [S]. International Office of Vine and Wine,Resolution Oeno 22/2003 modified by Oeno 12/2007.
[28] Anne E.Mack,A variety of agilent zorbax rrhd phase offers selectivity options for the determination of anthocyanins in blueberries with UHPLC/MS [M].USA,agilent technologies inc,2011.
[29] Pranathi P. Perati,Brian M. De Borba,Deepali Mohindra,and Jeffrey S.Rohrer. Determination of Organic Acids and Anthocyanins in Cranberry Extract [EB/OL].(2012)Thermo Scientific Poster Note·PN70227 E 09/12S. http:∥www.thermoscientific.com/dionex.
[30] 张瑛莉,董新平,刘延琳. 3个主要产区赤霞珠干红葡萄酒酚类物质及花色苷的分析[J].中外葡萄与葡萄酒,2010,(11):12-15.
[31] 季梅,李强,娄红祥. 高效液相色谱-质谱检测红葡萄皮中花色苷[J]. 药物分析杂志,2011,31(12):2240-2242.
[32] 王贞强,韩富亮,赵仁邦,等. HPLC法测定梅鹿辄和黑比诺葡萄中的花色素苷[J].酿酒科技,2007(5):99-101.
[33] 张素敏,隋洪涛,隋韶奕,等.葡萄花色苷的研究进展及应用前景[J].北方果树,2007(3):1-3.
[34] 王华,丁刚,崔福君.葡萄酒中花色素苷研究现状[J]. 中外葡萄与葡萄酒,2002(2):25-29.
[35] 杜文华,刘忠义.葡萄酒中花色苷的研究进展[J]. 食品与机械,2011(4):169-172.
Determination of exogenous natural pigment in wine
ZHAO Guang-xi1,LIU Hao1,LI Zhi-fen2,DU Wei1,YANG Bo1,ZHANG Ke-yi1
(1.National Center of Supervision & Inspection on Grape and Wine Quality,Qinhuangdao 066000,China;2.Qinhuangdao Center For Food and Drug Control;Qinhuangdao 066000,China)
Based on the previous study,natural pigment added to wine were anthocyanins. A method of determining anthocyanins in wine was established. The qualitative and quantitative analysis was investigated by HPLC. 6 major anthocyanins in wine were determined:Mv-3-gl,mv-3-gl-Ac,mv-3-gl-cm,pn-3-gl,df-3-gl and pt-3-gl. Ratio was 5∶1.5∶1∶0.5∶0.4∶0.4. Therefore,when the contents and proportion were varied dramatically,which showed that natural pigment was applicated into wine. This method was effective in distinguishing whether the anthocyanins added in wine.
high performance liquid chromatography;distinguishing and detection;natural pigment
2014-05-04
赵广西(1979-),男,硕士,工程师,研究方向:食品安全检测。
TS201.1
A
1002-0306(2015)07-0290-06
10.13386/j.issn1002-0306.2015.07.053
