HPLC法同时检测复方产品中西洋参、红景天和刺五加的皂苷含量
2015-05-08张振华赵升强王楚绮赵海锋
郭 栋,张振华,于 淼,赵升强,王楚绮,张 娟,赵海锋,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.暨南大学理工学院,广东广州 510632)
HPLC法同时检测复方产品中西洋参、红景天和刺五加的皂苷含量
郭 栋1,张振华2,于 淼2,赵升强2,王楚绮2,张 娟2,赵海锋1,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.暨南大学理工学院,广东广州 510632)
采用高效液相色谱法建立了同时检测复方产品中人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E含量的方法。以60%乙醇作为提取溶剂,用色谱柱Kromasil 100-5C18(250×4.6mm,5μm)进行分离,以0.1%磷酸-乙腈混合液为流动相进行梯度洗脱,结果表明,在此条件下5种皂苷得到了良好的分离。人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E分别在80~800、80~800、40~400、20~160μg/mL和40~320μg/mL范围内呈现良好的线性关系,平均加标回收率在99.5%~106.8%之间,相对标准偏差为0.5%~2.3%。本方法具有重现性好、回收率高等优点,适用于复方产品中人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的同时检测。
复方,皂苷,高效液相色谱
西洋参又名洋参、美国人参、花旗参,为五加科多年生草本植物。其味甘、微苦,性凉,具有滋阴补气、清热生津的双重功效。研究表明其主要功能成分为人参皂苷,可有效增强中枢神经,保护心血管和提高人体免疫力[1]。红景天亦为亚洲地区公认滋补食材,是稀珍野生植物,其主要功效成分为红景天苷,具有活血益气的功效;药理实验表明,红景天苷具有抗氧化、降血糖、抗炎症等功用[2]。刺五加又名五加参,可补虚扶弱、滋补强壮、延年益寿,其主要功效成分为刺五加苷[3]。目前关于检测人参皂苷、红景天苷、刺五加苷的方法有比色法、薄层扫描法、高效液相色谱法等[4-9],但于同一色谱条件下同时检测多种皂苷尚无文献报道。
西洋参、红景天和刺五加作为滋补食材常以复方形式被提取利用,因此开发一种能同时检测复方产品中主要皂苷含量的方法尤为必要。本文建立了同时检测复方(由西洋参、红景天和刺五加构成)提取液中主要功效成分人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E含量的高效液相色谱法。该方法可实现复方中不同皂苷成分的高效分离,具有重现性好、回收率高的优点。
1 材料与方法
1.1 材料与仪器
西洋参、红景天、刺五加 无限极(中国)有限公司;人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加B和E标准品 广州市药检所;乙腈 色谱纯;其余试剂 分析纯。
SHIMADZMLC-20AT HPLC分析系统 日本岛津仪器公司;电动搅拌器 江苏省金坛市神科仪器厂;Kromasil 100-5C18(250mm×4.6mm,5μm)色谱柱 安捷伦公司。

表1 五种皂苷标准曲线方程及线性范围
1.2 实验方法
1.2.1 样品溶液的准备 单方样品制备:分别准确称取经粉碎、过4号筛的西洋参、红景天和刺五加各5.00g,用200mL 80%乙醇索氏抽提12h,抽滤后定容到250mL。
复方样品制备:西洋参5.00g,红景天5.00g,刺五加5.00g,采用80%乙醇(料液比1∶12)在90℃条件下用电动搅拌器搅拌(200r/min)提取3h。
1.2.2 色谱条件 采用标准物质的混合物经过6次实验,确定色谱条件如下:
色谱柱:Kromasil 100-5 C18(250mm×4.6mm,5μm);
流动相:0.1%磷酸水溶液-乙腈(0~45min,乙腈15%~30%;45~65min,乙腈30~40%;65~80min,乙腈40%;80~90min,乙腈15%);
流速:0.9mL/min;柱温:28℃;
检测波长:采用DAD二极管阵列检测器,对标准品溶液进行全波长扫描,得到人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的检测波长分别为203、203、275、220、206nm[4-6]。
1.2.3 标准溶液的配制和标准曲线的制作 西洋参皂苷:精确称量20mg人参皂苷Rb1和人参皂苷Re,用80%乙醇溶解,定容到25mL,得800μg/mL的标准品母液;分别移取1、2、4、8、10mL母液,用80%乙醇定容到10mL,得浓度为80、160、320、640、800μg/mL的系列标准溶液,采用HPLC测定,进样10μL。以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
红景天苷、刺五加苷B和刺五加苷E:分别精确称量20mg红景天苷、刺五加苷B和刺五加苷E,用80%乙醇溶解,定容到50mL,得400μg/mL的标准品母液;分别移取1、2、4、8、10mL母液,用80%乙醇定容到10mL,得浓度为40、80、160、320、400μg/mL 的系列标准溶液,采用HPLC测定,进样10μL。以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.4 精密度实验 分别取人参皂苷Rb1和人参皂苷Re、红景天苷,刺五加苷B和刺五加苷E的标准品母液,连续进样5次,每次进样量为10μL,计算RSD值[7]。
1.2.5 稳定性实验 分别取1.2.1复方提取样品溶液10μL,每隔2h进样一次,每次进样量为10μL,连续进样6次,测定供试品溶液在12h内的稳定性[8]。
1.2.6 回收率实验 根据复方样品配比分别取西洋参、红景天和刺五加5.00g,加入人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加B和刺五加E标准品,按照实验方法进行样品处理,然后根据所建立的色谱方法在不同检测波长下测定,计算回收率。
1.2.7 复方样品中皂苷的检测 取复方样品液,按1.2.2所述的色谱条件测定皂苷,观察其分离效果,并在不同波长下测定其含量。
1.3 统计分析
每次实验重复三次,结果表示为平均值±标准偏差。数据处理和分析采用Origin8.0和SPSS19.0软件分析。

表2 精密度实验结果

表3 稳定性实验结果
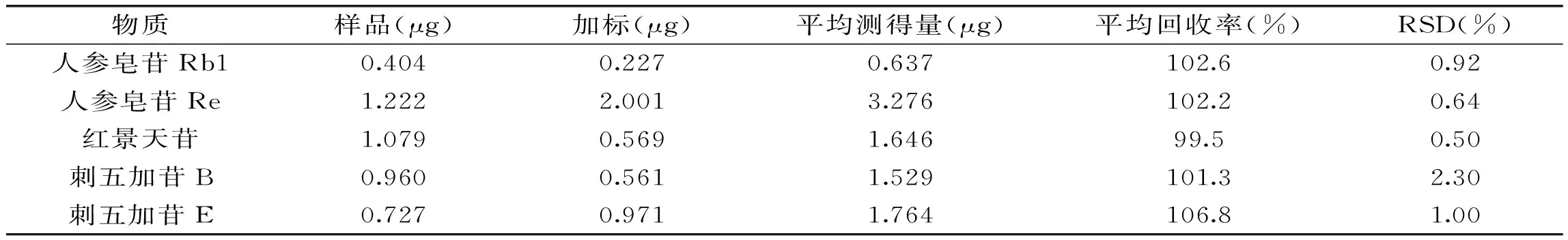
表4 人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的回收率
2 结果与讨论
2.1 线性关系
采用Kromasil 100-5C18(250×4.6mm,5μm)色谱柱、0.1%磷酸水溶液-乙腈作流动相,分别在203、203、275、220和206nm下测定人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E,得到回归方程如表1所示。由表1可知,五种皂苷在所测范围内,线性关系良好。
2.2 精密度实验
人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的RSD分别为:0.33%、0.42%、0.33%、0.44%和0.88%,精密度良好,结果如表2所示。
2.3 稳定性实验
五种皂苷稳定性实验测定结果如表3所示。由表3可知,该方法的稳定性良好,RSD为0.14%~3.72%。
2.4 回收率实验
表4的结果表明,本文所建立的检测方法对五种皂苷的回收率在99.5%~106.8%之间,RSD为0.5%~2.3%,回收率较高,准确性好[9]。
2.5 样品检测
采用HPLC检测标准样品,确定了人参皂苷Rb1、人参皂苷Re、红景天苷,刺五加苷B和刺五加苷E的保留时间分别为58.9、36.8、5.57、5.93和13.9min。图1的结果表明,西洋参、红景天和刺五加提取物中的皂苷在HPLC上分离效果良好,杂峰较少。
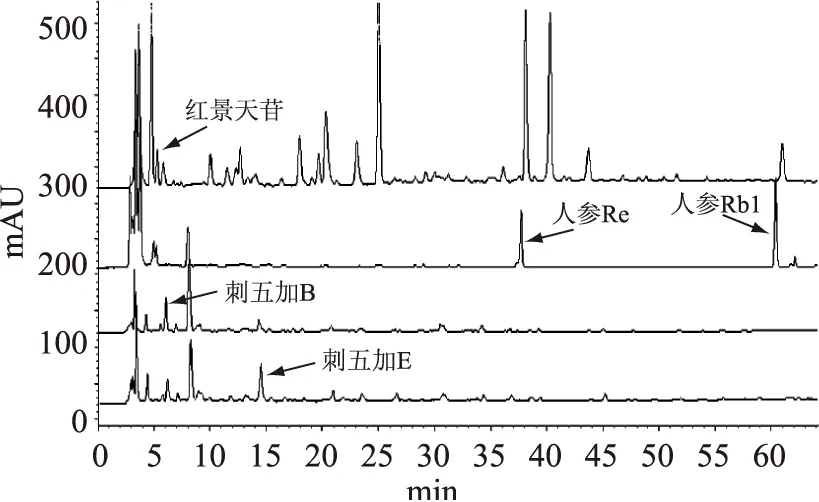
图1 四种检测波长下单方样品中各皂苷含量Fig.1 Saponins contents of single samples under four detection wavelengths注:人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的检测波长分别为03、203、275、220、206nm,图2同。
采用HPLC检测复方中的皂苷时,杂峰增多,但它们并未干扰皂苷的检测,结果如图2所示。根据表1中各皂苷的标准曲线,计算得到复方中人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的含量分别为:2.5%、1.6%、0.85%、1.0%和0.89%。

图2 四种检测波长下复方样品中各皂苷含量Fig.2 Saponins contents of mixture samples under four detection wavelengths
3 结论
本文采用Kromasil 100-5C18(250mm×4.6mm,5μm)色谱柱、0.1%磷酸水溶液-乙腈作为流动相,运用梯度洗脱的高效液相色谱法可以同时检测复方产品(西洋参、红景天和刺五加)中人参皂苷Rb1、人参皂苷Re、红景天苷、刺五加苷B和刺五加苷E的含量,供试复方中五种皂苷的含量分别为:2.5%、1.6%、0.85%、1.0%、0.89%。该方法回收率高,重现性好,可以准确测定复方产品中皂苷的种类和含量,为复方产品的质量控制奠定了基础。
[1]马宝兰,秦绪花,史载祥,等. 西洋参临床药理研究进展[J].江西中医学院学报,2011,23(5):88-92.
[2]熊云珍,胡红艳,熊新刚,等. 红景天药理作用研究进展[J].湖北中医杂志,2013,35(8):78-81.
[3]张晶,刘芳芳,陈彦池,等. 刺五加化学成分及药理学研究进展[J].中国野生植物资源,2008,27(2):6-10.
[4]于超,刁长发,夏文娟,等. 反相高效液相色谱法测定人参及其制剂中人参皂苷Rgl含量[J].药物分析杂志,2000,20(4):263-265.
[5]秦榕,薄海波,韩舜愈. 超高效液相色谱法同时测定红景天保健品中红景天苷和甙元酪醇含量[J].理化检验-化学分册,2009,45(6):674-678.
[6]王梅,范亚刚,高文分. RP-HPLC梯度洗脱法同时测定三七总皂苷及血塞通注射液中三种皂苷的含量[J].药物分析杂志,2000,20(6):410-413.
[7]张中苏,杨艳,罗晋萍,等.薄层扫描法测定龟龄集中人参皂苷Rgl的含量[J].药物分析杂志,1999,19(1):13-15.
[8]周迎春,赵怀清,梁宁,等.高效液相色谱法同时测定三七总皂苷中人参皂苷 Rg1、Re、Rb1与三七皂苷R1含量[J].沈阳药科大学学报,2003,20(1):27-31.
[9]陈军辉,谢明勇,章志明,等. 12种西洋参中总皂苷及人参皂苷Rb1的测定比较[J].时珍国医国药,2005,16(9):845-847.
Simultaneous determination of saponins in the mixture extracts ofPanaxquinquefolius,RhodiolaroseaandEleutherococcussenticosusby HPLC
GUO Dong1,ZHANG Zhen-hua2,YU Miao2,ZHAO Sheng-qiang2,WANG Chu-qi2,ZHANG Juan2,ZHAO Hai-feng1,*
(1.College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China;2.College of Science and Engineering,Jinan University,Guangzhou 510632,China)
HPLC has been applied to determine the contents of ginsenoside Rb1,ginsenoside Re,salidroside,acanthopanax B and acanthopanax E in the mixture extracts ofPanaxquinquefolius,Rhodiolarosea,andEleutherococcussenticosus.The samples extracted with 60% alcohol were separated on a Kromasil 100-5 C18column(250×4.6mm,5μm),and were eluted with 0.1% phosphoric acid-acetonitrile at a flow rate of 0.9mL/min under gradient elution conditions. The results showed that all of the saponins in the mixture extracts were well separated on HPLC. The linear ranges of the ginsenoside Rb1 and ginsenoside Re,salidroside,acanthopanax B and acanthopanax E were 80~800,80~800,40~400,20~160μg/mL and 40~320μg/mL,respectively. Their average recovery rates were 99.5%~106.8%,with the relative standard deviations of 0.5%~2.3%. In conclusion,the proposed method had a good linearity and sensitivity which was suitable to detect simultaneously the contents of the ginsenoside Rb1,ginsenoside Re,salidroside,acanthopanax B and acanthopanax E in the mixture extracts or formulations.
mixture extracts;saponins;HPLC
2014-06-11
郭栋(1985-),男,硕士研究生,研究方向:功能食品开发。
*通讯作者:赵海锋(1977-),男,博士,副研究员,主要从事食品生物技术方面研究。
国家自然科学基金项目(31000810);广东省科技计划项目(2011A020102001)。
TS207.3
A
1002-0306(2015)07-0272-04
10.13386/j.issn1002-0306.2015.07.049
