大孔树脂纯化盐酸育亨宾的工艺研究
2015-05-08雷智东孙华庚赵艳敏郭晓玲刘岱琳
雷智东,孙华庚,赵艳敏,郭晓玲,刘岱琳,*
(1.中国人民武装警察部队后勤学院,天津 300162;2.广东药学院,广东广州 510006;3.天津尖峰天然产物研究开发有限公司,天津 300457)
大孔树脂纯化盐酸育亨宾的工艺研究
雷智东1,2,孙华庚3,赵艳敏1,郭晓玲2,刘岱琳1,*
(1.中国人民武装警察部队后勤学院,天津 300162;2.广东药学院,广东广州 510006;3.天津尖峰天然产物研究开发有限公司,天津 300457)
研究大孔树脂对盐酸育亨宾的纯化条件。以静态饱和吸附量和解吸率为指标,比较了八种不同类型的大孔树脂对盐酸育亨宾的纯化效果。结果表明,D101树脂对盐酸育亨宾的纯化效果较好,对D101树脂的纯化条件进行了静态实验和动态实验。经实验确定最佳纯化条件为上样浓度:1.0mg/mL,样液pH2~3,上样流速为4.0mL/min,树脂对样品的吸附量38.2mg/g,洗脱剂为50%乙醇,洗脱体积6BV。经D101大孔树脂纯化后,盐酸育亨宾的纯度相对于提取粗品提高4~5倍。
盐酸育亨宾,大孔树脂,吸附,解吸
盐酸育亨宾是一种α-肾上腺素受体拮抗剂,通过选择性的阻断突触前α-肾上腺素能,令血管平滑肌扩张,增加外周副交感神经的张力,降低交感神经张力[1],有着广泛的药理作用。有报道,用于临床治疗动脉硬化,还可用于保护内毒素引起的急性肺损伤的α2肾上腺素能受体[2],目前最主要的应用于男性性功能障碍[3-4],多用于男性保健品原料。现在市场上天然植物来源的育亨宾提取物含量较低。刘璇[5]等用大孔树脂对云南萝芙木中的育亨宾进行分离纯化,由于萝芙木中的盐酸育亨宾含量非常低,尽管通过大孔树脂进行纯化,但其纯度仅达到5.9%。李鹏[6]等用离子交换树脂对育亨宾总生物碱进行了分离纯化,用氨水加80%乙醇溶液洗脱,该精制过程生产成本较高。本文首次利用来源非洲塞拉利昂的育亨宾树的干燥树皮为原料利用酸水提取。
1 材料与方法
1.1 材料与仪器
育亨宾药材购自非洲塞拉利昂,经沈阳药科大学孙启时教授鉴定为非洲植物育亨宾Corynante Yohimbe的干燥树皮,该标本保存在武警后勤学院生药学与药剂学教研室,编号YLDL-2009061;盐酸育亨宾对照品 成都曼斯特生物科技有限公司,批号MUST-13021005,纯度≥98%;甲醇和乙腈(色谱纯)、95%乙醇 天津市康科德科技有限公司;水为超纯水,ADS-7、ADS-8、806大孔树脂 天津南开合成科技有限公司;D101、D293、D301、D315大孔树脂 沧州宝恩吸附材料科技有限公司;HP20大孔树脂 日本三菱。
日本岛津公司LC-20AT型高效液相色谱仪(自配SPD-M20A型紫外检测器、CTO-20柱温箱);cosmosil C18柱(2.5μm,4.6mm×250mm);EYEL4型旋转蒸发仪 上海爱朗公司;NewClassicMS105DU半微量天平 梅特勒-托利多;FA1204B电子天平 上海精密科学仪器有限公司;MYB型调温电热套 天津市中环实验电炉有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限责任公司。
1.2 实验方法
1.2.1 盐酸育亨宾粗提液的制备 参照文献[7],称取粉碎后的育亨宾药材150g,加入3000mL 0.5%盐酸水溶液,在圆底烧瓶中回流提取,溶剂沸腾后计时3h。过滤保留滤液,减压蒸馏至2000mL,得到以盐酸育亨宾为标量的1.0mg/mL溶液。
1.2.2 盐酸育亨宾高效液相色谱含量测定方法及工作曲线的制作 色谱柱:Cosmosil C18柱(4.6mm×250mm,2.5μm);流动相,甲醇∶乙腈∶水∶磷酸(60∶1∶90∶0.4);检测波长:226nm;流速为1.0mL/min;柱温为30℃,进样量10μL,测定盐酸育亨宾峰面积,绘制标准曲线。
精密称取盐酸育亨宾1.11mg,加1mL甲醇溶解定容至10mL,摇匀,得0.111mg/mL作为盐酸育亨宾标准品溶液,分别量取盐酸育亨宾标准品溶液,用甲醇稀释配制成0.555、1.11、1.39、1.67、2.22μg/mL的溶液。按上述色谱条件各进样10μL,记录与其对应的峰面积,将样品浓度(X)与经高效液相色谱测定的峰面积(Y)进行线性回归。
1.2.3 大孔树脂预处理 将806、D101、D293、D301、D315、HP20、ADS-7、ADS-8等,八种树脂分别用95%乙醇充分溶胀浸泡24h。用蒸馏水冲洗,至无明显乙醇味为止。用5% NaOH浸泡4h,用蒸馏水冲洗至中性,再用0.5%盐酸水溶液浸泡4h,用蒸馏水冲洗至中性。
1.2.4 最佳树脂筛选
1.2.4.1 静态吸附实验 准确称取预处理过的树脂1.00g于250mL锥形瓶中,加入定量的吸附原液,避光密闭,置于振荡器中,25℃,100r/min震荡,定时从上清液中取样,测定育亨宾的量[8-10]。根据以下公式计算吸附量:
吸附量(mg/g)=(C0-C1)·V1/M
式中:C0、C1-吸附前、后原吸附液中盐酸育亨宾浓度,mg/mL;V1-原吸附液体积,mL,M-树脂重量,g。
1.2.4.2 静态解吸实验 将充分吸附的树脂过滤,用水冲洗后滤干,置于250mL锥形瓶中,加入30%的乙醇水溶液150mL,置于密闭的振荡器中,25℃,100r/min震荡,定时从上清液中取样,测定盐酸育亨宾的量。根据以下公式计算吸附量:
解吸率(%)=CV2×150/W
式中:C-洗脱液中盐酸育亨宾的浓度,mg/mL;W-吸附总量,mg;V2-洗脱总体积,mL。
分别称取1.00g处理好的806、D101、D301、D315、D293、ADS-7、ADS-8、HP20树脂于250mL锥形瓶中,按上述方法,使其充分吸附饱和,检测其吸附量,计算吸附率,并用30%乙醇溶液解吸,计算其解吸率。
1.2.5 D101树脂静态实验
1.2.5.1 料液浓度对树脂吸附量的影响 准确称取处理好的D101树脂1.00g,置于250mL锥形瓶中,分别加入浓度为0.5、1.0、2.0、2.5、3.0mg/mL的盐酸育亨宾溶液120、60、30、24、20mL,进行静态吸附实验。
1.2.5.2 不同洗脱溶剂对解吸的影响 为提高盐酸育亨宾的回收率,通常都选用解吸率较高的溶剂作为解吸溶剂,但考虑到盐酸育亨宾应用在医药行业中,因此,本实验只考虑选择不同浓度的乙醇作为洗脱剂[11]。
考察不同浓度乙醇溶液对解吸的影响。分别称取处理好的树脂1.00g共6份,置于锥形瓶中,加入等量的原吸附液,使其充分吸附后,将树脂过滤,分别加入相同体积的10%乙醇水溶液、20%乙醇水溶液、30%乙醇水溶液、40%乙醇水溶液、50%乙醇水溶液、60%水乙醇溶液,使其充分解吸,测定其结果。
1.2.6 D101树脂动态实验
1.2.6.1 流速吸附的影响 树脂装量30g,样品动态吸附时的流速分别为1.0、2.0、3.0、4.0、5.0、6.0mL/min,测定室温下,流速对D101树脂的动态吸附影响。
1.2.6.2 样品最大吸附量的确定 精密量取处理好的湿树脂250mL装柱,以流速为4mL/min上样,考察上样体积对吸附量的影响。
1.2.6.3 洗脱体积对解吸的影响 吸附饱和的D101树脂,用少量水洗去吸附的水溶性杂质类,再用50%的乙醇洗脱,洗脱速度为4mL/min,测定室温下50%乙醇水溶液对树脂吸附的盐酸育亨宾的动态洗脱效果,确定洗脱曲线。
2 结果与分析
2.1 盐酸育亨宾标准曲线的制备
由图1可知,盐酸育亨宾标准曲线为Y=3528509X-35903(R2=0.9997),结果表明,盐酸育亨宾在0.555~2.22μg/mL范围内具有良好的线性关系。

图1 标准曲线Fig.1 The standard curve
2.2 树脂筛选
结果如表1所示。
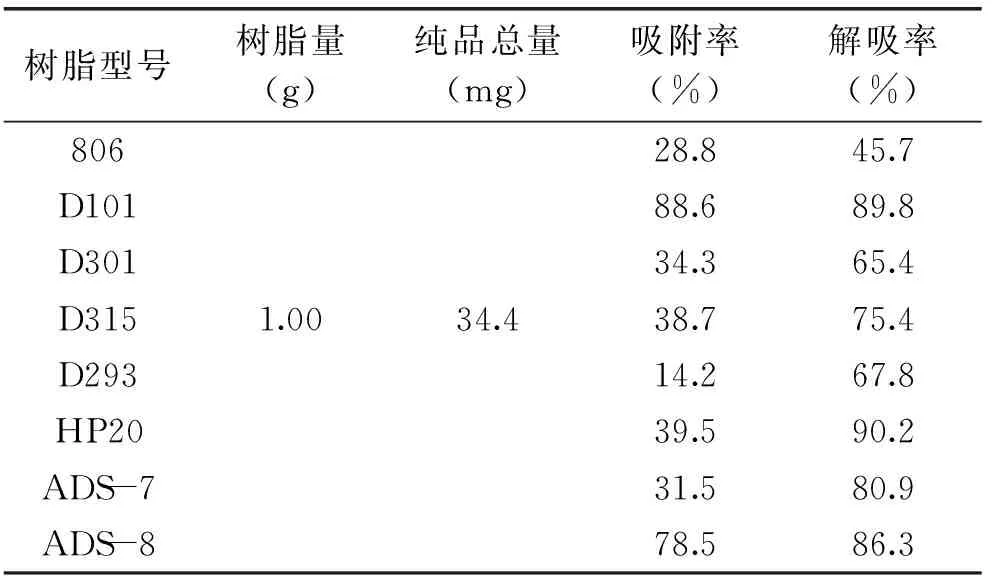
表1 不同树脂的吸附率与解吸率
结果显示,各树脂的静态吸附率差异显著,吸附顺序依次是D101>ADS-8>HP20>D315>D301>ADS-7>806>D293;各树脂的静态解吸率率差异显著,解吸顺序依次是HP20>D101>ADS-8>ADS-7>D315>D293>D301>806,此现象说明,大孔树脂对盐酸育亨宾吸附解吸有较强的选择性,其吸附解吸性能的大小与树脂的类型有较大关系。
综合树脂对盐酸育亨宾的吸附与解吸,表明八种大孔树脂中D101、ADS-8两种树脂对盐酸育亨宾有较强的吸附能力,HP20、D101、ADS-8、ADS-7这四种树脂对盐酸育亨宾有着较强的解吸能力。无论是吸附还是解吸,D101树脂都优于其他树脂,因此,综合考虑本实验选用D101树脂对盐酸育亨宾进行精制纯化。
2.3 D101树脂的静态吸附解吸研究
2.3.1 料液浓度对树脂吸附量的影响 结果如图2,在盐酸育亨宾浓度较低,树脂吸附盐酸育亨宾的能力随着浓度的增加而增加,当料液浓度提高超过1mg/mL时,吸附量随浓度增加反而减少。这可能与接触面积有关,但超过一定浓度其杂质也影响树脂表面与盐酸育亨宾的接触机会,因此,本实验的样品液浓度控制在1mg/mL。
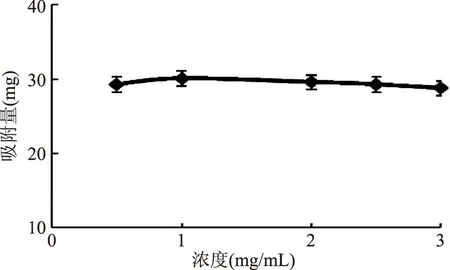
图2 不同浓度的样品溶液对吸附的影响Fig.2 Effects of different concentration of sample solution on absorption
本实验考察上样浓度时,如果溶液浓度过大,会有沉淀出现,此会影响树脂对溶液的吸附,因此,浓度应较低些,有利于树脂吸附。
2.3.2 不同洗脱溶剂对解吸的影响 结果如图3,不同浓度乙醇溶液的解吸率,随着乙醇浓度的增加,解吸率先升高后下降,当乙醇浓度达到50%,解吸率达到92.8%,因此,本实验选用50%乙醇水溶液作为洗脱剂。
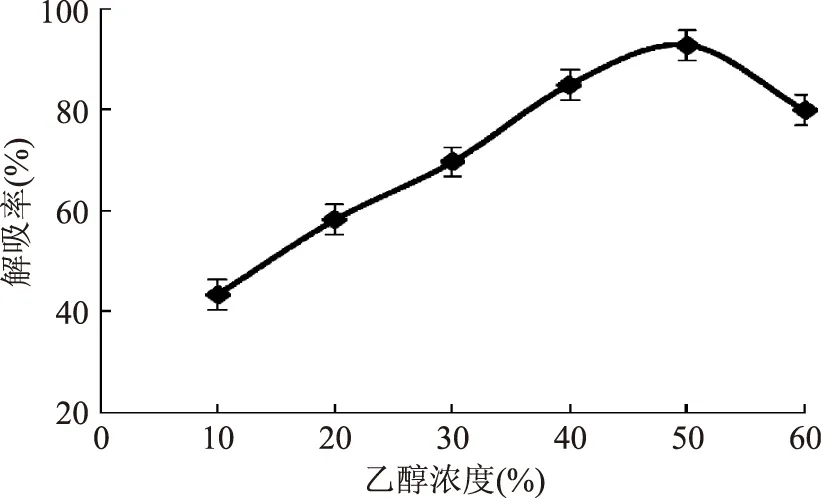
图3 不同浓度乙醇溶液的D101树脂静态解吸曲线Fig.3 Static desorption curve of D101 resin at different ethanol solution
在选择洗脱溶剂时,选取50%乙醇水溶液,可能是当乙醇浓度过大时,在洗脱盐酸育亨宾的同时将大量的杂质一同洗脱,从而导致结果降低。
2.4 D101树脂的动态吸附解吸研究
2.4.1 流速吸附的影响 结果如图4,上料液流速对吸附率的影响差异不大,当流速为4mL/min时,吸附率相对较高,达到87.9%。此外流速过慢消耗时间太多,延长生产周期,流速过快吸附较差,且易流失。因此,综合考虑选择流速为4mL/min较为适宜。
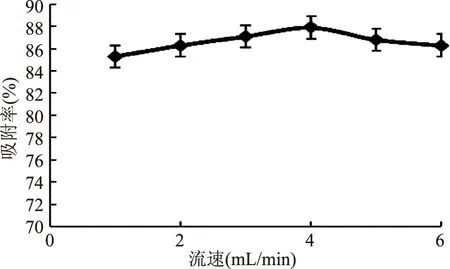
图4 流速对吸附的影响Fig.4 Effects of velocity of flow on adsorption
流速的控制也是本实验中较为关键的步骤,流速较慢效果较好,但同时考虑到周期,因此综合结果,选择出最佳流速,如果速度过快,会提前泄漏盐酸育亨宾,导致样品损失。
2.4.2 样品最大吸附量的确定 结果如图5,当上样体积为1800mL,达到吸附饱和,流出液与原液中盐酸育亨宾量达到相近,这时吸附率达到92.5%,此时为D101树脂对盐酸育亨宾纯品的最大吸附量44.74mg/g,如果选择最大吸附量时作为上样体积,则会有大量的盐酸育亨宾泄漏,造成资源浪费;当上样体积为1100~1200mL时,刚刚开始有泄漏,考虑到整体纯化效率、节约生产成本,确定250mL树脂的最佳上样体积为1200mL。因此我们选择在达到泄漏点时的吸附量作为上样体积,即树脂的吸附量为38.2mg/g,上样体积为1200mL。吸附过程中盐酸育亨宾漏出的时间较晚,开始泄漏时,泄漏迅速,说明D101树脂的吸附并不是缓慢型,在考察静态吸附和解吸时也同样表现出这样的结果,饱和前不易漏出,吸附较好。

图5 动态吸附曲线Fig.5 Dynamic adsorption curve
2.4.3 洗脱体积对解吸的影响 结果如图6,在前1000mL(4BV)时,盐酸育亨宾解吸率达到91.6%,前250mL解吸液中就有大量的盐酸育亨宾流出,因此,从一开始就要收集解吸液。D101树脂上吸附的盐酸育亨宾,易被解吸,只用很少量的洗脱剂即可使树脂柱上吸附的盐酸育亨宾解吸下来,在解吸到1500mL(6BV)时,洗脱解吸率能达96.5%,解吸较完全。最终测定经D101大孔树脂精制纯化后的盐酸育亨宾含量高达17%。

图6 动态解吸曲线Fig.6 Dynamic desorption curve
3 结论与讨论
在所选的8种大孔树脂中,D101树脂对盐酸育亨宾有较好的吸附和解吸能力,可用于盐酸育亨宾的纯化。通过D101树脂静态实验和动态实验,确定了最佳纯化条件:上样浓度为1mg/mL,上样流速为4mL/min,盐酸育亨宾上样量38.2mg/g,洗脱剂为50%乙醇水溶液,洗脱体积6BV。通过该条件的纯化,可将提取的粗品盐酸育亨宾提取物纯度从3.7%提高到17%以上,提高4~5倍。
本实验的吸附原液是用0.5%盐酸水溶液提取,吸附原液的pH为2~3,当调节pH为4以上,就会出现分层或沉淀,故本实验不考察pH对树脂吸附的影响,直接将原吸附液pH为2~3进行吸附,并且在此条件下育亨宾处于盐酸育亨宾,极性变大,更容易吸附在树脂上。
本研究利用D101大孔树脂,对育亨宾树皮粗提液进行精制纯化,其工艺过程简单,并且所用洗脱溶剂仅为乙醇水溶液,安全环保。工艺中D101树脂,乙醇均可重复利用,不仅节约能源并且降低成本。通过最优纯化工艺,将盐酸育亨宾的纯度提高,效果明显,具有很高的应用价值。本实验为生产较高纯度的盐酸育亨宾提供参考。
[1]DrB Nsahu Ph D.Rauvolfias[M].USA:Today and Tomrrow,1983.
[2]LIN Ying,ZHU Xi,YAO Wan-lin,et al.yohimbine protects against endotoxin-induced acute lung injury by blockade of alpha 2A adrenergic receptor[J].Chinese Medical Journal,2011,124(7):1069-1074.
[3]郑培良.育亨宾治疗阳萎的药理机制与临床应用[J].中国药理学通报,1993,11(2):418-419.
[4]Ade A Adeniyi,Giles S Brindeley,John P Pryor,et al.Yohimbine in the treatment of orgasmic dysfunction[J].Asian J Androl,2007,9(3):403-407.
[5]刘璇,曹福祥,赵莹,等.用大孔树脂分离纯化育亨宾[J].湘潭师范学院学报,2009,31(2):44-47.
[6]李鹏,陈琴华,张卓,等.离子交换树脂对育亨宾总生物碱的纯化研究[J].中国医院药学杂志,2009,29(2):129-132.
[7]雷智东,郭晓玲,刘岱琳,等.正交实验设计优化盐酸育亨宾的提取工艺[J].武警后勤学院学报(待发表).
[8]吕春茂,宋雨涵,孟宪军,等.大孔树脂纯化寒富苹果渣多分工艺优化[J].食品工业科技,2012,33(6):300-308.
[9]邵盈盈,李向荣.大孔树脂纯化蓝莓总黄酮及其抗氧化活性研究[J].食品工业科技,2013,34(7):73-76.
[10]孟宪军,朱力杰,李斌,等.大孔树脂纯化北五味子藤茎中总三萜的研究[J].食品工业科技,2012,33(4):339-342.
[11]刘荣,何娇,王振宇,等.大孔树脂对樟子松树皮多酚的纯化工艺的研究[J].食品工业科技,2013,34(11):201-209.
Purification of Yohimbine Hgydrochloride by macroprous resin
LEI Zhi-dong1,2,SUN Hua-geng3,ZHAO Yan-min1,GUO Xiao-ling2,LIU Dai-lin1,*
(1.Logistics College of Chinese People’s Armed Police Forces,Tianjin 300162,China;2.Guangdong Pharmaceutical University,Guangzhou 510006,China;3.Tianjin Jianfeng Natural Product R&D Co.,Ltd.,Tianjin 300457,China)
The purification of yohimbine hydrochloride with macroporous resin was studied. The static adsorption and desorption performance of 8 kinds of resins for yohimbine hydrochloride were compared with static adsorption capacity and elution ratio as evaluation factors. The results showed that the optimum conditions of the static and dynamic adsorption and desorption for separating yohimbine hydrochloride by D101 resin were studied.The optimal conditions were:the concentration of the sample solution of 1.0mg/mL,pH2~3,the colume of the sample quantity of 38.2mg/g,best velocity 4.0mL/min,eluting with 50% ethanol,eluting 6BV. The yohimbine hydrochloride with respect to the purity improved 4~5 times.
Yohimbine hydrochloride;macroporous resin;adsorption;desorption
2014-07-24
雷智东(1989- ),男,硕士研究生,研究方向:天然产物活性成分研究。
天津市科技特派员项目(14JCTPJC00469)。
TS201.2
B
1002-0306(2015)07-0237-04
10.13386/j.issn1002-0306.2015.07.042
*通讯作者:刘岱琳(1973- ),女,博士,教授,研究方向:天然产物活性成分研究。
