猪股骨酶解液中降血压肽的活性及其体外稳定性研究
2015-05-08舒一梅李凌希潘姝璇王诗熠
舒一梅,李 诚,李凌希,潘姝璇,王诗熠,郭 威,付 刚,肖 岚
(四川农业大学食品学院,四川雅安 625014)
猪股骨酶解液中降血压肽的活性及其体外稳定性研究
舒一梅1,李 诚*,李凌希2,潘姝璇2,王诗熠2,郭 威2,付 刚2,肖 岚2
(四川农业大学食品学院,四川雅安 625014)
采用0.22、0.45μm两种孔径滤膜过滤猪股骨酶解液,再利用截留分子量为5、3、2ku的超滤离心管对过滤后的酶解液进行超滤,比较两种滤膜过滤的酶解液超滤分离后的各分子量段滤液的色值、澄清度、蛋白损失率及ACE(血管紧张素转换酶)抑制活性,并将ACE抑制活性最高的分子量段进行模拟胃肠道及耐热、耐酸碱实验。研究显示:0.22μm微孔滤膜处理的酶解液超滤后的色值、澄清度效果好于0.45μm微孔滤膜,两者超滤后各个分子量段的ACE抑制率差异不显著,蛋白回收率前者较低,分子量<2ku的滤液活性最高,其IC50值为0.83mg/mL。分子量<2ku经胃蛋白酶、胰蛋白酶作用后,ACE抑制活性仍然保持原来的95%以上,该分子量段的滤液有良好的胃肠道耐受性、热稳定性及耐酸碱性。
猪股骨酶解液,降血压肽,超滤,稳定性,ACE半抑制浓度
超滤技术是以超滤膜作为分离介质,以膜两侧的压力差为推动力,将不同分子量的溶质进行选择性分离。超滤技术的优点是无相际间变化、能耗低、操作简便、占地面积小,成本低廉,尤其是超滤技术的实验条件温和可以防止肽变性、失活,在提纯蛋白质过程中已得到广泛应用[1]。据研究报道大多数降血压肽多是由10个以下氨基酸残基组成的小肽[2-4],因此可用超滤法除去酶解物中的大分子量多肽,富集小分子量肽段。目前,已有较多有关蛋白水解物中的降血压肽的超滤分离的报道,如,米糠蛋白水解物[5],鳕鱼蛋白水解物[6],乳清蛋白ACE活性肽[7],鸭骨蛋白水解物[8],酪蛋白水解物[9]和大蒜渣ACE活性肽[10]等。
本文不仅对猪股骨酶解液超滤滤液的感官性状、降血压活性进行了研究,并通过体外稳定性实验进一步研究了其体外稳定性,以期为促进降血压肽产品的工业化提供一定的实验基础。一般情况下,降血压肽如果在体外对胃肠道酶有良好的耐受性、耐热性、耐酸碱性,在体内才可能具有明显的生理效果,才可能经机体吸收后在体内产生真正的降血压作用[11]。
1 材料与方法
1.1 材料与仪器
猪股骨骨粉 实验室自制;胃蛋白酶(20U/mg)、胰蛋白酶(20U/mg)、木瓜蛋白酶(800U/mg)、风味蛋白酶(20U/mg)、碱性蛋白酶(200U/mg) DSM公司;超纯水 优谱公司;ACE、HHL 美国Sigma公司;其它均为国产分析纯试剂。
0.22、0.45μm微滤膜 上海新亚净化器件厂;超滤管(5、3、2ku) 密理博公司;QT-2漩涡混匀器 上海琪特分析仪器有限公司;V-1100D型可见光分光光度计 上海美普达仪器有限公司;冷冻干燥机、高速冷冻离心机、移液枪 Thermo Fisher;pH计 方舟科技;氨基酸成分分析仪 日本日立公司;真空抽滤装置 天津奥特赛恩斯仪器有限公司。
1.2 实验方法
1.2.1 猪股骨降血压肽的制备 按本研究室前期猪股骨酶解降血压肽的优选条件制备猪股骨降血压肽,其工艺流程为:新鲜猪股骨→高压蒸→粉碎→加酶水解→灭酶→离心→上清液→冷冻干燥[12]。
1.2.2 超滤分离
1.2.2.1 酶解液前处理 本实验采用微孔过滤的方法对猪股骨酶解液进行前处理,利用真空抽滤装置分别将酶解液用0.22、0.45μm微滤膜进行抽滤,并以色值、澄清度、蛋白回收率为指标比较两种混合纤维素酯滤膜的过滤效果。
1.2.2.2 色值测定 以去离子水为空白对照,将滤液用分光光度计在420nm处测定吸光度值,用Abs表示,重复该实验3次[13]。
1.2.2.3 澄清度测定 以去离子水为空白对照,将滤液用分光光度计在680nm处测定透光率,用T%表示,重复该实验3次[14]。
1.2.2.4 超滤后蛋白回收率计算
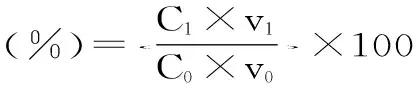
C0:酶解液蛋白含量(mg/mL);V0:酶解液总体积(mL);C1:滤液蛋白含量(mg/mL);V1:滤液总体积(mL)
1.2.2.5 超滤 猪股骨酶解液分别经两种微孔滤膜过滤后,再分别透过截留分子量5、3、2ku的超滤离心管(4000r/min,10min),猪股骨酶解液0.22μm微滤后进行超滤的为A组,0.45μm微滤后超滤的为B组,得到A组酶解液分别为<5,3~5,<3,2~3,<2ku的滤液,以及B组酶解液分别为<5,3~5,<3,2~3,<2ku的滤液。
1.2.2.6 氨基酸的测定 将超滤后的A组<5,3~5,<3,2~3,<2ku滤液分别冷冻干燥后,分别称取10mg测定其氨基酸成分,每个分子量段取三组进行平行实验。采用酸水解法[15]对样品进行处理,然后上机测定。
1.2.3 猪股骨降血压肽的稳定性实验
1.2.3.1 猪股骨降血压肽模拟胃肠道实验 参照Megumi KUBA[16]、Yike Yu[17]等的方法进行测定。操作步骤:取适量1%(w/v)的最高ACE抑制活性的分子量段滤液溶于0.1mol/L HCl溶液(适宜缓冲溶液调节pH2.0)中,加入1%(w/w)胃蛋白酶,摇匀,于37℃保温模拟消化4h,煮沸5min中止反应,立即冷却,并用0.1mol/L的磷酸氢二钾调pH至8.0。取水解液在5000r/min下离心20min,测定上清液的ACE抑制活性;在剩余水解液中加入1%(w/w)胰蛋白酶,于37℃保温模拟消化2h,再置于沸水浴中5min,再取适量水解液在5000r/min下离心20min,测定上清液的ACE抑制活性。每组样品经酶处理后,经离心分离,取上清液,pH调至8.0,取样测定其IC50值,同时取超纯水作为空白对照,重复该实验3次。
1.2.3.2 猪股骨降血压肽的热稳定性实验 取超滤后的ACE抑制率最高的分子量段,调节浓度为1.0mg/mL,并用HCl(1mol/L)和NaOH(1mol/L)调节pH为7.0,分别置25、35、45、55、65、75、85、95℃的水浴中,保温4h,然后迅速拿出,分别取样检测其IC50值,重复该实验3次。
1.2.3.3 猪股骨降血压肽的酸碱稳定性实验 取超滤后的ACE抑制率最高的分子量段,调节浓度为1.0mg/mL,用适宜的缓冲液分别调pH为4、5、6、7、8、9、10、11、12常温放置4h后,分别取样检测其IC50值,重复该实验3次[18]。
1.2.4 ACE抑制活性的测定 ACE抑制率的测定主要采用经典的紫外分光光度法[19]。
1.2.5 IC50值测定方法 将样品配制成不同的浓度,分别测定其ACE抑制率,以样品浓度为横坐标,ACE抑制率为纵坐标,绘制圆滑曲线,从曲线中计算出IC50值。
1.2.6 蛋白质浓度测定 蛋白质浓度的测定主要采用Lowry法[20]蛋白含量检测试剂盒测定。
1.3 数据统计分析
实验数据经3次平行实验后得到,通过计算其平均值与误差,采用SPSS 20.0分析数据之间的相关性。
2 结果与分析
2.1 微孔滤膜过滤的影响
猪股骨酶解液经0.22、0.45μm微孔滤膜处理后,经统计学分析,其色值、澄清度、蛋白回收率如表1。由于0.22μm微滤膜膜孔较小,所得滤液色值较小,澄清度较大,但膜孔更容易发生阻塞;两种滤液性质差异不显著(p>0.05):两种滤液颜色均为亮浅黄色,澄清透明,与酶解液相比,整体得到改善。

表1 微滤处理后酶解液色值、澄清度、蛋白回收率

表2 A组酶解液超滤滤液评价

表3 B组酶解液超滤滤液评价
2.2 超滤
A组与B组的猪股骨酶解液,分别用5、3、2ku超滤离心管在4000r/min下离心10min,共收集到分子量为<5、3~5、<3、2~3、<2ku的A、B两组滤液。A、B两组蛋白回收率、ACE抑制活性、色值、澄清度见表2、表3。
由表2、表3可知,A、B两组超滤滤液在色值、澄清度、蛋白回收率上差异显著(p<0.05)。就ACE抑制活性而言,A组、B组超滤滤液差异不显著(p>0.05),因为不同的膜过滤后进行超滤只是对于酶解液中的杂质、蛋白分子等通过的影响,而对ACE抑制活性没有影响。酶解液经0.22μm微滤过滤后进行超滤,可得到感官评价较好的超滤组分,若是进行猪股骨降血压肽产品的开发,可选择0.22μm微滤膜过滤酶解液,其产品的感官性状较好。若是进一步分离猪股骨降血压肽单体,由于0.45μm微滤膜过滤的效率较高,因此选择0.45μm微滤膜过滤酶解液较好。
2.3 氨基酸成分分析
酶解液及超滤后各分子量段的氨基酸成分分析如表4。
如表4中的氨基酸组成及其含量,从原液依次到分子量为<5、3~5、<3、2~3、<2ku的滤液其中的氨基酸种类没有发生变化。经统计分析,其疏水性氨基酸、脯氨酸所占的比例依次增大,可能因为高活性的降血压肽多由疏水性氨基酸、脯氨酸等组成,其中分子量<2ku的滤液ACE抑制活性最高,其疏水性氨基酸比例最高为49.11%,脯氨酸所占比例为13.78%,降血压肽的ACE抑制活性很可能跟疏水性氨基酸的含量相关[21]。这也符合了Saito[22],Cheung[19]等人的研究:ACE抑制肽的抑制活性主要取决于C端氨基酸,当C端氨基酸为疏水性氨基酸和脯氨酸时其抑制活性较高。
2.4 体外稳定性实验
2.4.1 模拟胃肠道稳定性实验 降血压肽或酶解超滤滤液经口服是否具有降血压作用的前提条件是不被肠道酶和肽酶降解,到达体内目标点时抑制了这些目标点的ACE活性。
从表5可知,分子量段<2ku的滤液与胃蛋白酶作用后IC50值增大,但其ACE抑制活性仍保持原来的95%以上,经统计分析,胃蛋白酶的降解作用不显著(p>0.05)。进一步与胰蛋白酶作用后,其IC50值升高微小。这说明胃蛋白酶、胰蛋白酶对分子量<2ku滤液的降解作用不显著(p>0.05)。
Yamamoto等[23],Doyen等[24]研究发现蛋白质源降血压肽能发挥功能活性或营养作用,若其IC50值于12~60mg/mL范围内,经口服后依然有活性。由猪股骨酶解液分离的分子量<2ku的滤液经胃肠道酶作用后,IC50值仅为0.83mg/mL,远低于12~60mg/mL,这个范围,这说明分子量<2ku的猪股骨降血压肽经口服后很可能具有良好的降血压作用。

表4 不同分子量段滤液的氨基酸含量

表5 消化酶对猪股骨<2ku滤液的影响
2.4.2 猪股骨降血压肽热稳定性 由图1可知,分子量<2ku滤液在不同温度下水浴6h后,其ACE抑制活性差异不显著(p>0.05)。随着温度的升高,分子量<2ku滤液ACE抑制率基本不变。当温度达到95℃时,其ACE抑制活性仍很高。由此可知,分子量<2ku滤液具有良好的耐高温性能。
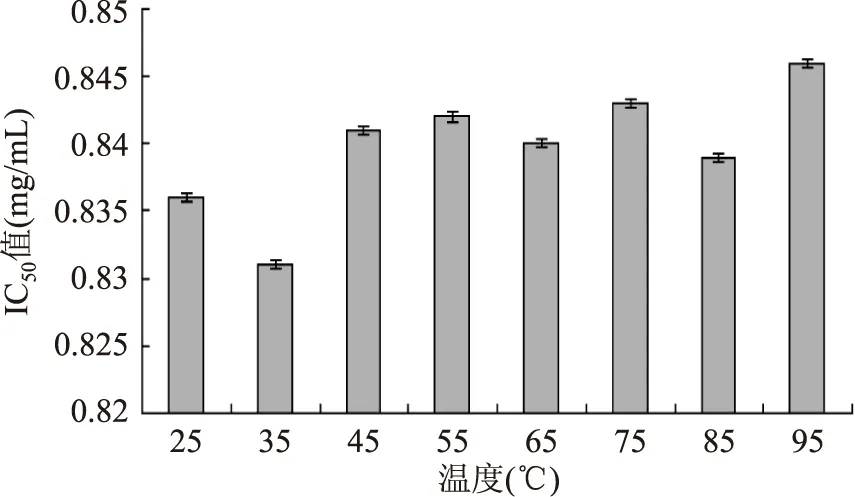
图1 不同温度对分子量<2ku滤液的影响Fig.1 Effect of temperature on the activity of the<2ku
2.4.3 猪股骨降血压肽的酸碱稳定性结果分析 从图2可知,当pH在4~6、8~12之间时,分子量<2ku滤液的活性变化幅度很小(p>0.05),当pH为7时,其ACE抑制率最低,但仍有较高的抑制活性。由此可知,分子量<2ku滤液在酸性和碱性的条件下最稳定,在中性条件下较稳定。

图2 不同pH对分子量<2ku滤液的影响Fig.2 Effect of pH value on the activity of the<2ku
3 结论
利用两种微孔滤膜过滤酶解液,发现酶解液经0.22μm微滤膜过滤后进行超滤,可得到感官评价较好的超滤组分,两者的ACE抑制活性差异不显著。猪股骨酶解液超滤后,蛋白回收率分布在80%~95%之间,分子量<2ku的滤液具有最好的ACE的抑制效果;通过对各个分子量段的氨基酸成分分析,随着各个分子量段的ACE抑制活性的增大,其疏水性氨基酸和脯氨酸的比例逐渐增大,降血压肽的活性很可能与疏水性氨基酸和脯氨酸的含量相关。分子量<2ku的滤液对胃蛋白酶、胰蛋白酶有良好的耐受性,还有良好的耐热和耐酸碱性。
国内外较多学者利用超滤分离蛋白水解物,获得了高活性的目的产物。国外学者Alain[25]等、Antonio[26]等利用超滤分离对亚麻籽蛋白水解物、墨鱼水解物分离出高活性的降血压肽滤液。本研究中经超滤分离出的分子量<2ku的滤液ACE抑制活性较高,较李诚[8]等对鸭骨水解物进行超滤后得到的最高活性肽段活性有了提高,为猪股骨降血压肽的工业化生产提供了一定的理论基础。此外,ACE的抑制作用与体外降血压效果之间有时会出现不一致的情况。因此在体外进行降血压肽抗肠道酶降解的研究是非常必要的。降血压肽的热稳定性、耐酸碱性的研究,也为猪股骨降血压肽产品的开发提供了理化条件的参考。然而,要得到单一的猪股骨降血压肽成分还需结合更多分离技术进行分离,以期分离出纯度更高的猪股骨降血压肽,促进以其为功能因子的保健品的开发。
[1]Myroslav S,Iryna K,Boguslaw B.The separation ofuranium ions by natural and modified diatomite from aqueous solution[J].Journalof Hazardous Materials,2010(181):700-707.
[2]Yoshii H,Tachi N.Antihypertensive effect of ACE inhibitory oligo peptides from chinken egg yolks[J].Comp Biochem Physiol C Toxicol Pharmacol,2001,128(1):27-33.
[3]Byun HG,Kim SK.Structure and activity of angiotensin I converting enzyme inhibitory peptides derived from Alaskan Pollack skin[J].J Biochem Mol Biol,2002,35(2):239-243.
[4]L.Vandanjon,M.Grignon,E.Courois,et al.Fractionating white fish fillet hydrolysates by ultrafiltration and nanofiltration[J]. Journal of Food Engineering,2009(95):36-44.
[5]丁青芝,马海乐,骆琳,等.米糠蛋白ACEI活性肽的超滤分离及其稳定性研究[J].食品研究与开发杂志,2008(9):48-51.
[6]You-Jin Jeon.Improvement of functional properities of cod frame protein hydrolysates using ultrafiltration membranes[J]. Process bio-chemistry,1999,16(35):471-478.
[7]沈小琴,李朝惠,罗永康.乳清蛋白酶解ACE抑制肽分离纯化技术的研究[J].中国乳品工业,2005,33(11):4-6.
[8]李诚,张小丽,付刚.酶解鸭骨制取ACE抑制肽工艺条件的优化[J].中国酿造,2011(8):64.
[9]冯彪,倪晋仁,毛学英.超滤技术处理酪蛋白酶解液的研究[J].中国乳品工业,2005,33(3):32-34.
[10]徐霞.大蒜ACEI活性肽制备技术的研究[D].镇江:江苏大学,2004:38-12.
[11]方科伟,孙海燕,刘冬,等.基因工程法高效表达降血压肽的稳定性及降压效果[J].中国组织工程研究与临床康复,2008,27(12):16-20.
[12]刘小红,李诚,付刚,等.猪股骨头胶原蛋白降血压肽的分离纯化[J].食品科学,2014,35(6):50-54.
[13]陈瑜,李志远,侯小祯.膜分离技术在菠萝汁澄清中的应用研究[J].食品工业科技,2005,26(9):63-66.
[14]Jaeger L M,Bento C A. Clarification of pineapple juice by ultrafiltration and microfiltration:physicochemical evaluation of clarified juices,soft drink formulation,and sensorial evaluation
[J]. Journal of agricultural and food chemistry,1998(6):2185-2189.
[15]GB/T5009.124-2003 食品中氨基酸的测定[G].
[16]KUBA M,TANAKA K,TAWATA S,et al.Angiotensin Ⅰ-Converting Enzyme Inhibitory Peptides Isolated from Tofuyo Fermented Soybean Food[J].Biosci Biotechnol Biochem,2003,67(6):1278-1283.
[17]Yu Y,Jianen Hu.Yuji Miyaguchi,et al.Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides derived from porcine hemoglobin[J].Peptides,2006,27(22):2950-2956.
[18]邓慧玲,刘嘉,陈光镜,等.猪血红蛋白ACE抑制肽的分离和理化性质研究[J].食品工业科技,2013,34(10):281-284.
[19]Cushman D W,Cheung H S.Spectrophotometric assay and properties of the angiotensin I-converting enzyme of rabbit lung[J]. Biochem Pharmacol,1971,20:1637-1648.
[20]侯曼玲.食品分析[M].北京:化学工业出版社,2004:132-133.
[21]郑炯,邓惠玲,林茂.ACE抑制肽的酶法制备及其构效关系的研究进展[J].食品工业科技,2012,33(15):418-427.
[22]Saito Y,Wanezaki K,Kawato A,et al.Structure and activity of angiotensin I converting enzyme inhibitory peptides fromsake and sake lees[J].Bioscience,biotechnology,and biochemistry,1994,58(10):176-1771.
[23]Yamamoto N,Akino A,Takano T.Antihypertensive effect of the peptides derived from casein by an extracelluar proteinase from Lactobacillus helveticus CP790[J]. Food Chemistry,1994,77(4):917-922.
[24]Alain Doyen,Lucie Beaulieu,Linda Saucier,et al.Demonstration ofinvitroanticancer properties fractions from a snow crab by-products hydrolysate after separation by electrodialysis with ultrafiltration membranes[J].Separation and Purification Technology,2011,26(78):321-329.
[25]Alain Doyen,Chibuike C,Udenigwe Patricia L. Mitchell. Anti-diabetic and antihypertensive activities of two flaxseed protein hydrolysate fractions revealed following their simultaneous separation by electrodialysis with ultrafiltration membranes[J]. Food Chemistry,2014,16(14):66-76.
[26]José Antonio Vázquez,Ma Pilar González,Miguel Anxo Murado. Production of antihypertensive and antioxidant activities by enzymatic hydrolysis of protein concentrates recovered by ultrafiltration from cuttlefish processing wastewaters[J]. Biochemical Engineering Journal,2013,18(76):43-54.
Study on antihypertensive peptides activity of enzymolysis liquid of pig femoral collagen and of it’s stabilityinvitro
SHU Yi-mei1,LI Cheng*,LI Ling-xi2,PAN Shu-xuan2,WANG Shi-yi2,GUO Wei2,FU Gang2,XIAO Lan2
(College of Food,Sichuan Agriculture University,Ya’an 625014,China)
Pig femoral collagen enzymatic hydrolysate was pretreatmented by 0.22μm and 0.45μm microfiltration membranes,then used the MWCO 5,3,2ku ultrafiltration membrane for ultrafiltration step by step,and the color value,clarity,protein recovery and ACE inhibitory as index,the effect of the different permeate on enzymatic hydrolysate were compared,taken the test to remain activity under acid,alkaline conditions,hot environment and trypsinl enzymes proteolysis.The results showed:the enzymatic hydrolysate was pretreatmented by 0.22μm better than 0.45μm in color value and clarity,but the former was lower in protein recovery,they had no difference in ACE inhibitory.All of the permeate were obtained and the MW<2ku had the best activity with the IC50was 0.83mg/mL. The stability of antihypertensive peptide,lower than 2ku,was investigated and the results this kind of peptide could remain activity under acid,alkaline conditions and hot environment could had the ability to resist trypsinl enzymes proteolysis.However,the activity decreased when treated by pepsin,and it’s activity keep more than 95% of the original.
enzymolysis liquid of pig femoral;antihypertensive peptides;ultrafiltration;stability;Half inhibitory concentration of ACE
2014-06-03
舒一梅(1989-),女,在读硕士研究生,研究方向:畜产品质量与安全。
*通讯作者:李诚(1964-),男,硕士,教授,研究方向:畜产品加工与质量安全控制。
TS201.1
A
1002-0306(2015)07-0074-05
10.13386/j.issn1002-0306.2015.07.006
