肝脏缺血再灌注损伤机制的研究进展
2015-05-08关连越付佩尧综述审校
关连越,付佩尧(综述),李 巍(审校)
(吉林大学中日联谊医院肝胆胰外科,长春130033)
肝脏缺血再灌注损伤机制的研究进展
关连越,付佩尧(综述),李 巍(*审校)
(吉林大学中日联谊医院肝胆胰外科,长春130033)
组织经历一定时间的缺血后恢复血流灌注,不仅无法使组织器官功能得以迅速恢复正常,反而加重组织器官炎症反应、结构破坏、甚至出现严重功能障碍,这一过程被称为缺血再灌注损伤(ischemia reperfusion injury,IRI)。这种损伤常发生于医疗过程中,如器官移植、溶栓治疗、动脉搭桥术、体外循环心脏手术、低血容量性休克等,进而出现肝、脑、心、肺、肾、肠等多器官功能损伤,成为影响缺血治疗效果的一个重要因素。其中肝脏IRI(HIRI)最为常见和严重,限制了肝切除术的适应症及边缘性肝脏供体的应用,在不同程度上阻碍了肝脏外科及肝移植的发展和普及。HIRI可分为热缺血再灌注损伤及冷缺血再灌注损伤,二者发生的病理生理过程相似,其机制涉及诸多因素,与代谢障碍、氧化应激、细胞活化、炎症反应等有关,各个因素形成相互制约、相互促进的关系。近些年,蛋白酶抑制剂、自由基清除剂、钙通道阻滞剂、某些激素或中药等均已被证实可从多种途径有效抑制HIRI。目前,新型免疫抑制的应用及基因治疗等也逐渐成为人们研究的焦点。本文综合国内外研究资料就HIRI发生发展的常见机制(见图1)加以综述。
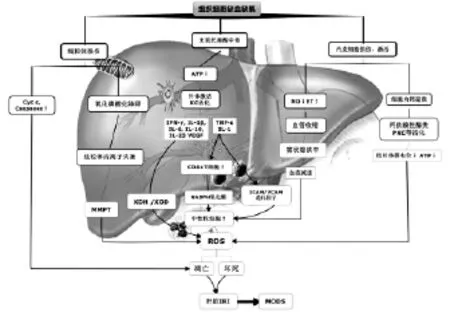
图1 肝脏缺血再灌注损伤机制
1 无氧代谢与酸中毒
肝脏缺血时,组织处于缺血、缺氧状态,细胞正常的氧化还原过程受阻,细胞内ATP被迅速消耗,依赖于ATP的各种细胞代谢活动也逐渐停止,无氧酵解增强引起乳酸、酮体等酸性代谢产物的蓄积,加上线粒体氧化磷酸化功能下降,致使组织细胞间pH值下降,出现代谢性酸中毒。复流后,pH值随之恢复正常,大量pH值依赖性的蛋白酶、磷脂酶等活性增强,反而加重组织器官的损伤,造成HIRI[1],此为HIRI最常见的机制之一。
2 线粒体损伤及膜渗透性的转变
线粒体是机体氧化磷酸化的主要场所,其参与了HIRI的多个病理生理环节。缺血、缺氧状态下活性氧及活性氮大量生成,破坏了细胞氧化磷酸化的过程,使ATP生成障碍,加上胞质内Ca2+、Na+、H+等离子紊乱引起线粒体内离子失衡,最后导致线粒体膜结构及渗透性的改变(mitochondrial membrane permeability transition,MMPT)[2]。这种转变主要表现在线粒体的肿胀及膜电位的下降,使分子量小于1 500kDa的溶质可以自由通过线粒体内膜[3]。引发MMPT有多种因素,包括线粒体内calpain-like蛋白酶的存在、Ca2+浓度的升高、氧化剂等。少量MMPT时,溶酶体溶解,氧自由基(ROS)产生加快,ATP消耗,进而细胞色素C释放至胞浆内,引起细胞凋亡;大量线粒体损伤时,ATP耗竭,细胞坏死,从而造成HIRI。
3 微循环衰竭
缺氧导致的内皮细胞损伤破坏了微脉管系统的完整性,进而导致血流量的减少,被称为“无复流现象”[4],可能的原因是缩血管物质和扩血管物质的大量产生,以及疾病本身导致的血管反应性的改变,造成这些物质局部比例失衡并最终导致缺血性损伤[5]。大量的实验研究也证明了这样的观点,首先,移除扩血管物质一氧化氮(NO)可加重再灌注损伤,而加入外源性NO可减轻损伤[6],此外,加入左旋精氨酸刺激NO的生成可降低门静脉压力,减轻再灌注损伤[7]。另一方面,缺血再灌注期间窦状内皮细胞(SEC)和巨噬细胞可产生大量缩血管物质,如内皮素-1(ET-1),ET-1与肝脏星状细胞表面受体结合通过收缩窦状隙造成微循环障碍[8]。应用抗ET-1血清、抗内皮素单克隆抗体或ET受体拮抗剂可以有效改善再灌注后肝脏微血流,减轻组织损伤,提高细胞存活率[9,10]。
4 细胞内钙离子(Ca2+)超载
在正常生理状态下,细胞膜的选择通过性维持细胞内相对低钙状态,即钙稳态。缺血缺氧、氧化应激、细胞膜毒性物质等有害因素可引起钙平衡系统功能失调,导致细胞内钙超载。目前研究认为,钙超载是造成肝细胞损伤的关键机制之一[11]。肝细胞或内皮细胞缺氧或复氧化后可出现细胞Ca2+增加,使Ca2+依赖性酶类,如钙激活酶、蛋白激酶-C(PKC)、磷脂酶-C、钙调蛋白依赖性的蛋白激酶-Ⅱ(CAMkinaseⅡ)和钙调磷酸酶(蛋白磷酸酶2B)等活化,在内源性底物磷酸化、去磷酸化过程中起到重要作用,最终导致细胞的死亡或凋亡。因此,胞内Ca2+超载后可引起线粒体内氧化磷酸化过程障碍,线粒体膜电位降低,组织ATP含量下降,以及胞浆内磷脂酶、蛋白酶等激活,导致细胞的不可逆性损伤。
5 氧化应激
大量研究表明,氧化应激过程在IRI中起到重要作用[11,12]。肝组织经历缺血再灌注后,产生大量高活性分子如活性氧自由基(ROS)和活性氮自由基(RNS),前者包括超氧阴离子、羟自由基和过氧化氢等,后者包括一氧化氮、二氧化氮和过氧化亚硝酸盐等,二者作用机制相似。ROS主要来源包括细胞溶质内黄嘌呤氧化酶、KC、黏附的多形核中性粒细胞,作用于蛋白、酶类、核酸、细胞骨架、包膜和脂类过氧化物,导致线粒体功能低下和脂类过氧化反应;ROS可损伤内皮细胞使微脉管系统的完整性遭到破坏。内源性抗氧化物,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽、维生素E等都可以抑制ROS的破坏作用。应用与腺病毒重组的超氧化物可有效减轻小鼠HIRI[13]。
6 KC和中性粒细胞的激活
肝脏缺血再灌注后诱发了体内炎性介质的复杂的级联反应,首先KC被激活,活化的KC释放出大量促炎因子,包括肿瘤坏死因子(TNF-α),白细胞介素(IL-1β)[14],作用于肝细胞周围诱导细胞因子和趋化因子的产生。进一步使中性粒细胞聚集、旋转、吸引并随后从血管腔内迁移至肝脏小间隙内。活化的中性粒细胞及肝脏实质细胞可通过释放氧化剂和蛋白酶造成肝损伤。中性粒细胞生成氧化剂的主要途径来源于还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶,活化的NADPH氧化酶氧化NADPH,释放出的电子降低氧分子电位,进一步产生超氧化物阴离子O2-,过氧化氢H2O2,羟自由基HO·,还原成H2O,从中性粒细胞中释放出的髓过氧化物酶(以卤化物形式存在的如Cl-)可以使过氧化氢H2O2转变成次氯酸HOCl(另一种强效氧化剂),上述氧化剂的产生可直接造成肝细胞的损伤和(或)通过灭活内源性抗蛋白酶系统活性促进蛋白酶介导的肝细胞损伤。
7 细胞间黏附分子和内毒素的作用
细胞间黏附分子(ICAM-1),即CD54,在正常肝组织的SEC、血管内皮细胞和单核巨噬细胞中微弱表达,在实质性细胞内无表达。ICAM-1可通过与淋巴细胞功能相关抗原(LFA-1)的结合介导T淋巴细胞间,T、B淋巴细胞间,效应细胞与靶细胞间的相互作用,促进免疫系统的激活及免疫应答的发生。再灌注期间,活化的KC释放炎性介质如TNF-α、IL-1等,可激活SEC和肝细胞,使ICAM-1的表达增加。ICAM-1可通过与其受体LFA-1的结合,促进中性粒细胞和内皮细胞的粘附、迁移、趋化,活化后释放蛋白酶、氧化剂等造成肝细胞的损伤。有研究表明内毒素也参与了肝脏缺血再灌注损伤的过程[15],肝脏缺血时一方面肝细胞功能下降,清除内毒素能力减弱,另一方面,肠黏膜屏障受损,菌群移位,释放内毒素入血可经门静脉回流入肝,进而激活KC,释放促炎介质,活化中性粒细胞,通过NADPH氧化酶生成大量氧自由基加重肝损伤。
8 细胞死亡
近些年,许多实验性数据均证实细胞凋亡存在于肝脏缺血再灌注过程中。基于TUNEL分析法、DNA梯度法和含半胱氨酸的天冬氨酸蛋白水解酶(caspase)活性的检测,判定再灌注期间有50%-70%的内皮细胞和40%-60%肝细胞发生凋亡[16]。然而仔细查阅这些数据,会发现一系列的疑问[17],①单纯应用TUNEL分析法判定细胞凋亡并不合适,因为DNA链的瓦解同样存在于细胞肿胀性坏死过程中;②最小含量的caspase的活化与所谓的大规模的细胞凋亡没有明显的关联;③即刻细胞内容物的释放和炎症反应与认为凋亡是细胞唯一死亡形式的看法不一致;④过度表达Bcl-2可同时抑制细胞的凋亡和坏死;⑤GUJRAL等人的研究结果基于形态学的判定标准,在热缺血60分钟后,发现内皮细胞和肝细胞发生凋亡的比例从未超过1%-2%,因此推断细胞肿胀性坏死是肝脏缺血再灌注期间细胞的主要损伤形式,而并非凋亡[18]。类似的结果也出现在冷保存再灌注的实验研究中[19]。
9 细胞因子的作用
细胞因子在HIRI过程中起着抗炎、促炎反应的双重作用,TNF-α是促进炎症级联反应的主要因素,它由KC活化后分泌,可通过旁分泌和内分泌途径作用于周围组织和远隔器官,是HIRI后继发远隔器官损伤的关键因素[20]。TNF-α的上调将直接导致肝脏的损伤,TNF-α与肝细胞表面受体结合后,使上皮中性粒细胞活化肽78(ENA-78)和ROS生成增多,同时激活核因子kB(NF-kB)和丝裂源活化蛋白激酶(MAPK)c-Jun氨基端激酶(JNK)[21]。此外,TNF-α还能上调ICAM-1、血管细胞黏附分子-1(VCAM-1)和P-选择素的表达[20,22]。上述这些介质可通过各种途径,使白细胞聚集、活化并进入缺血后的肝脏,而且,JNK和ROS可以直接作用于细胞造成肝脏损伤。其它一些重要的细胞因子还包括γ干扰素(IFN-γ)、肝细胞生长因子、IL-1β、IL-6、IL-10、IL-23、IL-13、IL-18血管内皮生长因子(VEGF)[2330]。这些细胞因子的表达受到大量可变的上游调控者的控制,下游方面,这些因子影响多种分子的表达,在缺血损伤过程中要么起到保护作用,要么起到破坏作用。
小结:IRI的病理生理机制是一个多组织器官、多种因素、多种学科交叉关联并相互制约的复杂过程,氧化应激反应、代谢障碍、细胞凋亡、活化细胞释放炎症介质等被认为参与其主要过程,但仍存在许多未知因素;肝脏是体内产生细胞因子的主要器官,也是诸多细胞因子作用的靶器官之一,HIRI可严重影响肝脏术后功能,甚至出现不可逆的损伤,进而出现多器官功能障碍的级联反应;针对HIRI的防治方法多种多样,如自由基清除剂、蛋白酶抑制剂、NO、钙通道阻滞剂、中医中药、缺血预处理等,但尚无一种完备的措施,目前多种防治措施的联合应用已经在临床实验中取得了良好的保护效果。因此,进一步探寻IRI的发生机制及并据此研制出更有针对性的防治措施将对未来肝脏外科的发展起到至关重要的作用。
[1]Gourab D,Barry J,Brian R,et al.Molecular mechanisms of liver ischemia reperfusion injury:insights from transgenic knockout models[J].World J Gastroenterol,2013,19(11):1683.
[2]Mahmoud AA,Shi YY,Niteen T,et al.Liver ischemia/reperfusion injury:processes in inflammatory networks-a review[J].Liv-er transplantation,2010,16:1016.
[3]Zoratti M,Szabo I.The mitochondrial permeability transition[J].Biochim Biophys Acta,1995,1241:139.
[4]Lemasters JJ,Bunzendahl H,Thurman RG.Reperfusion injury to donor livers stored for transplantation[J].Liver Transplant Surg,1995,1:124.
[5]Clemens MG,Bauer M,Pannen BHJ,et al.Remodeling of hepatic microvascular responsiveness after ischemia/reperfusion[J].Shock,1997,8:80.
[6]Wang CY,Mathew WR,Guido DM,et al.Inhibition of nitric synthesis aggravates reperfusion injury after hepatic ischemia and endotoxemia[J].Shock,1995,4:282.
[7]Shiraishi M,Hiroyasu S,Nagahama M,et al.Role of exogenous L-arginine in hepatic ischemia-reperfusion injury[J].J Surg Res,1997,69:429.
[8]Nakamura S,Nishiyama R,Serizawa A,et al.Hepatic release of endothelin-1after warm ischemia[J].Reperfusion injury and its hemodynamic effect[J].Transplantation,1995,59:679.
[9]Urakami A,Todo S,Zhu Y,et al.Attenuation of ischemia liver injury by monoclonal anti-endothelin antibody,AWETN40[J].J Am Coll Surg,1997,185:358.
[10]Koeppel TA,Kraus T,Thies JC,et al.Effects of mixed ETA and ETB-receptor antagonist(Ro-47-0203)on hepatic microcirculation after warm ischemia[J].Dig Dis Sci,1997,42:1316.
[11]李佩东,关连越,李 巍.乌司他丁对肝缺血-再灌注损伤保护作用的研究进展[J].器官移植杂志,2013,4(2):117.
[12]Brass CA,Roberts TG.Hepatic free radical production after cold storage:Kupffer cell-dependent and-independent mechanisms in rats[J].Gastroenterology,1995,108(4):1167.
[13]Zhou W,Zhang Y,Hosch MS,et al.Subcellular site of superoxide dismutase expression differentially controls AP-1activity and injury in mouse liver following ischemia/reperfusion[J].Hepatology,2001,33:902.
[14]Wanner GA,Ertel W,Muller P,et al.Liver ischemia and reperfusion induces a systemic inflammatory response through Kupffer cell activation[J].Shock,1996,5:34.
[15]Jaeschke H,Smith CW.Mechanisms of neutrophil-induced parenchymal cell injury[J].J Leukoc Biol,1997,61:647.
[16]Kohli V,Selzner M,Madden JF,et al.Endothelial cell and hepatocyte deaths occur by apoptosis after ischemia-reperfusion injury in the rat liver[J].Transplantation,1999,67:1099.
[17]Jaeschke H.Reperfusion injury after warm ischemia or cold storage of the liver:role of apoptotic cell death[J].Transplant Proceedings,2002,34(7):2656.
[18]Gujral JS,Bucci TJ,Farhood A,et al.Mechcanism of cell death during warm hepatic ischemia-reperfusion in rats:apoptosis or necrosis[J].Hepatology,2001,33(2):403.
[19]Redaelli CA,Tian YH,Schaffner T,et al.Extended preservation of rat liver graft by induction of heme oxygenase-1[J].Hepatology,2002,35:1082.
[20]Peralta C,Fernandez L,Panes J,et al.Preconditioning protects against systemic disorders associated with hepatic ischemia-reperfusion through blockade of tumor necrosis factor induced P-selectin up-regulation in the rat[J].Hepatology,2001,33:100.
[21]Schwabe RF,Brenner DA.Mechanisms of Liver Injury.TNF-alpha-induced liver injury:role of IKK,JNK,and ROS pathways[J].Am J Physiol Gastrointest Liver Physiol,2006,290:G583.
[22]Rajesh M,Pan H,et al.Cannabinoid-2receptor agonist HU-308 protects against hepatic ischemia/reperfusion injury by attenuating oxidative stress,inflammatory response,and apoptosis[J].J Leukoc Biol,2007,82:1382.
[23]Shen XD,Ke B,Zhai Y,et al.Absence of toll-like receptor 4(TLR4)signaling in the donor organ reduces ischemia and reperfusion injury in a murine liver transplantation model[J].Liver Transpl,2007,13:1435.
[24]Oe S,Hiros T,Fujii H,et al.Continuous intravenous infusion of deleted form of hepatocyte growth factor attenuates hepatic ischemia-reperfusion injury in rats[J].J Hepatol,2001,34:832.
[25]Zhai Y,Shen XD,Gao F,et al.CXCL10regulates liver innate immune response against ischemia and reperfusion injury[J].Hepatology,2008,47:207.
[26]Matsumoto T,O’Malley K,Efron PA,et al.Interleukin-6and STAT3protect the liver from hepatic ischemia and reperfusion injury during ischemic preconditioning[J].Surgery,2006,140:793.
[27]Husted TL,Blanchard J,Schuster R,et al.Potential role for IL-23in hepatic ischemia/reperfusion injury[J].Inflamm Res,2006,55:177.
[28]Ke B,Shen XD,Lassman CR,et al.Cytoprotective and antiapoptotic effects of IL-13in hepatic cold ischemia/reperfusion injury are heme oxygenase-1dependent[J].Am J Transplant,2003,3:1076.
[29]Takeuchi D,Yoshidome H,Kato A,et al.Interleukin 18causes hepatic ischemia/reperfusion injury by suppressing anti-inflammatory cytokine expression in mice[J].Hepatology,2004,39:699.
[30]Tsuchihashi S,Ke B,Kaldas F,et al.Vascular endothelial growth factor antagonist modulates leukocyte trafficking and protects mouse livers against ischemia/reperfusion injury[J].Am J Pathol,2006,168:695.
2015-03-28)
1007-4287(2015)09-1602-04
国家自然科学基金(81170416);天普研究基金(01201046);吉林省科技厅国际合作研究基金(2011742);吉林省自然科学基金(201015178)
*通讯作者
