鲟鱼籽酱(Husodauricus×Acipenserschrenckii)冷藏期间脂肪酸组成的变化
2015-05-05郝淑贤李来好杨贤庆林婉玲
何 丹,郝淑贤,魏 涯,李来好,杨贤庆,黄 卉,林婉玲
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
鲟鱼籽酱(Husodauricus×Acipenserschrenckii)冷藏期间脂肪酸组成的变化
何 丹1,2,郝淑贤1,*,魏 涯1,李来好1,杨贤庆1,黄 卉1,林婉玲1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
实验通过气相色谱与质谱联用仪(GC-MS),研究了养殖鲟鱼籽酱在冷藏条件(0℃)下脂肪酸组成的变化。结果表明,鲟鱼籽酱脂肪总体组成为:23.03%饱和脂肪酸(SFA),33.68%单不饱和脂肪酸(MUFA)和33.03%多不饱和脂肪酸(PUFA),其富含n-3长链多不饱和脂肪酸,比如EPA(二十碳五烯酸,C20∶5(n-3))和DHA(二十二碳六烯酸,C22∶6(n-3)),营养价值非常高。随着冷藏时间的延长,饱和脂肪酸(SFA)含量显著升高,不饱和脂肪酸(UFA=MUFA+PUFA)含量显著降低,特别是多不饱和脂肪酸降低明显(p<0.05),由此表明,仅低温冷藏不能保持鱼籽酱的脂肪酸营养品质。此外,在鲟鱼籽酱贮藏3月后,MUFA和PUFA出现显著性减少,且到贮藏5月时,分别从3月时的36.79、32.43降到34.83、31.86。由此可初步认定为3~5个月为鲟鱼籽酱冷藏时质量控制的关键时间段。
养殖鲟鱼,鱼籽酱,冷藏,脂肪酸组成
鲟鱼籽酱是由成熟的鲟鱼籽经盐腌制得,是世界上最为昂贵和精美的美食之一,与鹅肝、松露并成为“世界三大美食”,素有“黑色黄金”之称[1]。鲟鱼籽酱营养丰富,富含长链不饱和脂肪酸,特别是EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)[2]。EPA和DHA作为人体必需脂肪酸,具有多种重要的生理功能,比如能抑制血小板凝集、抗肿瘤、抗炎和降低人体血液胆固醇的水平,能显著降低心血管疾病的发病率[3-4]。然而,鲟鱼籽酱中的长链不饱和脂肪酸很不稳定,而脂肪酸的氧化对水产品的品质有重要的影响。研究证明,鱼类在贮藏加工过程中,随着贮藏时间的延长,脂肪酸(尤其是不饱和脂肪酸)的氧化程度加剧[5]。近年来,我国的鲟鱼养殖业发展迅速,有力地推动了养殖鲟鱼籽酱加工产业的兴起[6],且鲟鱼籽酱最基础的贮藏方式是冷藏。因此,研究养殖鲟鱼籽酱在贮藏加工过程中品质(特别是脂肪酸组成)的变化具有重大意义。
脂肪酸的测定方法有气相色谱法(GC)、液相色谱法、超临界流体色谱法等[7]。其中,因为气相色谱法具有灵敏度高、分离能力强和分析速度快等优点,已成为脂肪酸分析的主要方法[8]。脂肪酸GC测定主要分为三个部分:脂肪提取,脂肪酸的衍生化处理(包括皂化和甲酯化)以及脂肪酸的GC上机分离鉴定。近年来气相色谱与质谱的联用技术发展较快,将成为脂肪酸定性分析的主要手段[9]。
目前,有关鲟鱼籽酱脂肪酸研究较少,研究主要集中于对来自不同种类或不同区域鲟鱼所得鱼籽酱脂肪酸的比较[10],以及对野生和养殖鲟鱼籽脂肪酸组成进行比较[11-12],对鲟鱼籽酱在日常冷藏过程中脂肪酸的变化尚不清楚。为此,笔者研究鲟鱼籽酱在0℃贮藏条件下,脂肪酸组成的变化,旨在得出鲟鱼籽酱在冷藏过程中的脂肪酸变化规律,为今后鲟鱼籽酱冷藏时质量变化研究奠定基础。
1 材料与方法
1.1 材料与仪器
鲟鱼籽酱 由杭州千岛湖鲟龙科技股份有限公司提供。鲟鱼籽酱用金属罐罐装,每罐大约30g,经冰藏运输至实验室。
0.85%的生理盐水 0.85g NaCl经蒸馏水溶解,定容到100mL;0.5mol/L NaOH-CH3OH:2g NaOH经少量CH3OH溶解后,定容到100mL;14%三氯化硼-甲醇(500mL,购于上海安谱科学仪器有限公司)。
T50高速分散均质机 德国IKA公司;AvantiJ-26XP高速离心机 美国贝克曼库尔特公司;2010PLUS GC-MS 日本岛津公司。
1.2 实验方法
1.2.1 处理方法 将实验所用鱼籽酱置于0℃的冰箱内冷藏,于不同时期取样测定鱼籽酱脂肪酸组成。
1.2.2 脂肪酸的测定
1.2.2.1 脂肪的提取 取5.0g鱼籽酱样于50mL离心管中,加入15mL氯仿-甲醇(2∶1,体积比),冰浴中用高速分散均质机匀浆两次。转入100mL具塞量筒中定容至50mL,静止1h后过滤,在滤液中加入10mL的0.85%的生理盐水,转移到100mL离心管,3000r/min离心15min,弃去上层液体,将下层溶液经氮气吹扫浓缩除去有机试剂,得到固体脂质[13]。
1.2.2.2 脂肪的皂化和甲酯化往附有脂质的100mL离心管中加入0.5mol/L NaOH-CH3OH溶液5mL,充分震荡后于60℃水浴中皂化10min。然后加入2mL 14%三氯化硼-甲醇,60℃水浴30min进行甲酯化,冷却至室温后,加入1mL蒸馏水和1mL正己烷振荡,静止分层完全后,吸取上层有机层1mL到1.5mL的棕色进样小瓶中,用正己烷定容到1.5mL,样品上GC-MS进行分析测定[9,13-14]。
1.2.2.3 脂肪酸的GC-MS分析 色谱条件:色谱柱:DB-5MS(30m×0.25mm,0.25μm);进样口温度:230℃;升温程序:110℃保持4min,以10℃/min的速度升温到160℃保持1min,最后以5℃/min上升到240℃保持15min;载气:氦气;流量为1.52mL/min;采用恒线速度,分流比为1∶30。
质谱条件:离子源温度:200℃;电子能量70eV;质量扫描范围m/z 40~550,溶剂切除时间为3min。
1.2.2.4 脂肪酸的定性和定量分析 每组样品做三个平行,利用计算机NIST 0.5谱库数据库检索、参考脂肪酸标准谱图和各脂肪酸的保留时间,定性出所有的脂肪酸。按面积归一化法进行分析,求得各脂肪酸相对百分含量,检测的数据用“平均值±标准偏差”表示。依次取初始鱼籽酱,贮藏1、3、5、6、7、8月进行脂肪酸测定,对7组样品的脂肪酸结果进行整理和对比后,将至少有一组样品有超过总脂肪酸0.1%的脂肪酸,予以记录和比较。数据经单因素方差分析(ANOVA)(PASW Statistics 18软件,SPSS公司,芝加哥,美国),平均值经邓肯法多重比较检验,显著性水平为p<0.05。
2 结果与分析
2.1 初始鲟鱼籽酱脂肪酸组成
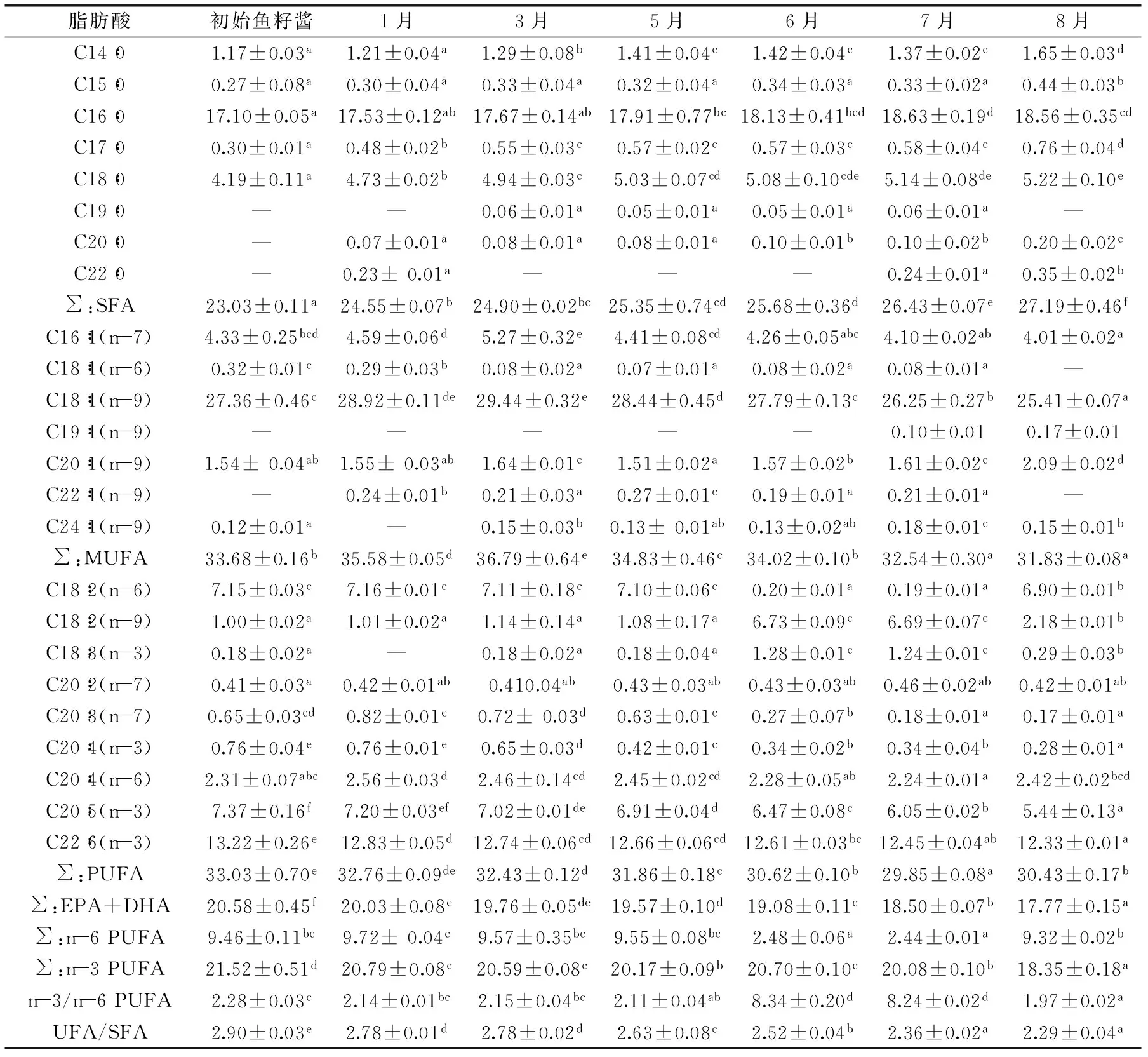
表1 鲟鱼籽酱冷藏期间脂肪酸组成的变化(%)Table 1 Changes of fatty acid composition in sturgeon caviar during iced storage(%)
图1 贮藏不同时间的鱼籽酱脂肪酸的GC-MS总离子流图Fig.1 Total ion current chromatogram(TIC) of fatty acids in caviar after different storage time注:A~G分别为初始鱼籽酱、 1月、3月、5月、6月、7月、8月鱼籽酱脂肪酸的 GC-MS总离子流图。
注:SFA:饱和脂肪酸(Saturated fatty acids);MUFA:单不饱和脂肪酸(Monounsaturated fatty acids);PUFA:多不饱和脂肪酸(Polyunsaturated fatty acids)。“-”表示没有被检测到。同行数据上标字母不同时,表示差异显著(p<0.05)。
不同贮藏时间的鱼籽酱脂肪酸的总离子流图(TIC图)如图1所示,如图显示,峰型光滑,无拖尾现象,峰分离较好,表明脂肪酸分离效果较理想。初始鲟鱼籽酱脂肪酸组成如表1中的第一列所示,该鲟鱼籽酱共检出19种脂肪酸,其中饱和脂肪酸5种,单不饱和脂肪酸5种,多不饱和脂肪酸9种。含量排在前5位的脂肪酸从大到小依次是:油酸(C18∶1(n-9),27.36%),棕榈酸(C16∶0,17.10%),DHA(13.22%),EPA(7.37%),共轭亚油酸(C18∶2(n-6),7.15%)。油酸作为鱼卵胚胎发育的主要能量来源,是鲟鱼籽酱最主要的脂肪酸,这与Wirth[10]的结果一致。然而,Wang等[2]发现棕榈酸是鲟鱼籽酱(A.gueldenstaedt)最主要的脂肪酸,这可能是由于鱼籽酱来源的鲟鱼种类、养料不同。
初始鲟鱼籽酱脂肪酸总体组成为:23.03%SFA(饱和脂肪酸),33.68%MUFA(单不饱和脂肪酸)和33.03%PUFA(多不饱和脂肪酸),其含量大小顺序为:MUFA>PUFA>SFA。基于饱和脂肪酸会引起低密度脂蛋白胆固醇值升高、增加患心脏病的风险,近数十年,WHO 倡议降低饱和脂肪酸的摄入量[15]。因此,由实验结果可知,鲟鱼籽酱拥有理想的脂肪酸组成。
2.1.1 饱和脂肪酸(SFA) 初始鲟鱼籽酱饱和脂肪酸含量最多的是棕榈酸(C16∶0,17.10%),其次是硬脂酸(C18∶0,4.19%),这与其它水产品的研究结果一致[16]。肉豆蔻酸(C14∶0,1.17%)会提高血胆固醇含量,不利于人体健康[15],本实验用鲟鱼籽酱的肉豆蔻酸含量较低,这是该产品值得消费的积极原因之一。
2.1.2 单不饱和脂肪酸 对于初始鲟鱼籽酱,单不饱和脂肪酸占总脂肪含量最多,相对百分含量达到33.68%。主要的单不饱和脂肪酸有:油酸(C18∶1(n-9))、C16∶1(n-7)和C20∶1(n-9)。油酸含量可用于预测鱼肉脂肪含量的高低,脂肪含量高的鱼,油酸百分含量较低,脂肪含量低的,油酸百分含量较高[15]。若鲟鱼籽酱参照这种方法,则可预测鱼籽中的脂肪含量低,显然与实际事实不符,形成这种差异的原因可能与鱼肉与鱼籽的结构和组成的不同有关。
2.1.3 多不饱和脂肪酸 由PUFA组成分析,初始鲟鱼籽酱PUFA中主要以DHA(13.22%)、EPA(7.37%)、亚油酸(C18∶2(n-6),7.15%)和花生四烯酸(C20∶4(n-6),2.31%)为主。本实验中DHA相对百分含量远大于EPA,这与沙丁鱼(Sardinellagibbosa)[17],石斑鱼(Latescalcarifer)[18],马鲛鱼(Scomberomoruscavalla)[15]的脂肪酸组成类似。Kolakowska等[19]报道称水产品DHA通常要比EPA多。在本实验中,DHA的含量约为EPA含量的两倍,高含量DHA通常代表高含量的磷脂,而磷脂中包含大量的多不饱和脂肪酸[17],表明鲟鱼籽酱是多不饱和脂肪酸很好的来源。
n-3 PUFA/n-6PUFA常用于比较不同来源鱼油的相对营养价值,且1∶1认为是最佳营养比例[16]。 在本实验中,鲟鱼籽酱 n-3不饱和脂肪酸是n-6的2.28倍,这与Wirth等[10]测得的不同种类和来源鲟鱼籽酱脂肪酸结果相似,表明鲟鱼籽酱是n-3 PUFA丰富的食物资源。据研究,鱼卵的n-3 PUFA与n-6 PUFA比例反映了鱼养料的脂肪酸组成[10],n-3 PUFA与n-6PUFA比例可以用于指导养殖鲟鱼饲料的组成和配比。
2.2 贮藏时期鲟鱼籽酱脂肪酸变化结果与分析
由表1可知,其中豆蔻酸(C14∶0)、十五烷酸(C15∶0)、十七烷酸(C17∶0)、硬脂酸(C18∶0)的相对百分含量随贮藏时间的增加而出现显著增加(p<0.05),棕榈酸(C16∶0)总体呈现显著增加趋势。这就导致了SFA在贮藏过程的增加,且在贮藏0~1个月,6~8个月时出现了显著性增加(p<0.05),相对于贮藏初期的鲟鱼籽酱,贮藏至8个月时,鲟鱼籽酱的SFA增加了18.1%。
相反,∑:MUFA和∑:PUFA随着贮藏时间的延长而减少,导致UFA/SFA值的显著性减小(p<0.05),这表示鲟鱼籽酱的不饱和脂肪酸在贮藏期间氧化分解。 而且,相比MUFA,PUFA更易于氧化,尤其是EPA和DHA显著减少(p<0.05),∑:EPA+DHA从20.58%(初始)降到17.77%(8个月),这是由于脂肪的双键数目越多,越易于氧化的发生[20]。
PUFA(共9种)中的、C18∶3(n-3)、C20∶4(n-6)和∑:n-6 PUFA在贮藏时间为5~6个月期间,开始出现显著性减少(p<0.05),但C18∶2(n-9)和C18∶3(n-3)含量在5~6月时突然增加,然后均在7~8月回落。∑:n-3 PUFA和∑:MUFA总体呈下降趋势,但无明显的变化规律,可推测鲟鱼籽酱脂肪酸在0℃贮藏5个月后氧化程度加剧。n-3/n-6 PUFA在5~6个月出现显著性增加,这和∑:n-6PUFA的显著性减少有关(p<0.05)。由此推测鱼籽酱贮藏5个月后其质量出现明显变化,是其质量控制的关键时期。
本实验中脂肪酸组成的变化结果与4℃贮藏的石斑鱼(Latescalcarifer)[18]的变化一致,与冰藏的尼罗罗非鱼(Oreochromisniloticus)[21]的结果相反,这可能与研究对象初始的脂肪酸组成有关。
3 结论
鲟鱼籽酱的不饱和脂肪酸含量丰富,尤其是n-3多不饱和脂肪酸,如EPA和DHA,其营养价值非常高。在0℃的条件下冷藏,随着贮藏时间增加,鲟鱼籽酱的多不饱和脂肪酸易氧化分解而减少,饱和脂肪酸会增加,从而降低了鲟鱼籽酱的营养品质。因此,仅靠一般冷藏,鲟鱼籽酱的品质很难得到保证,有效而安全的贮藏方法有待后续研究。
[1]郝淑贤,何丹,魏涯,等. 鱼卵加工产品类型与鱼籽酱保鲜技术研究进展[J]. 南方水产科学,2014,10(3):104-108.
[2]Wang Y,Yu J-x,Zhang C-l,et al. Influence of flavonoids from Phellinus igniarius on sturgeon caviar:Antioxidant effects and sensory characteristics[J]. Food Chemistry,2012,131(1):206-210.
[3]李国治,鲁绍雄,严达伟,等. 云南裂腹鱼肌肉生化成分分析与营养品质评价[J]. 南方水产科学,2009,5(2):56-62.
[4]李海峰,迟长凤,吴常文. 养殖曼氏无针乌贼白色卵膜营养成分分析及评价[J]. 南方水产科学,2014,10(3):86-91.
[5]武华,阴晓菲,罗永康,等. 腌制鳙鱼片在冷藏过程中品质变化规律的研究[J]. 南方水产科学,2013,9(4):70-75.
[6]李连春,韩春艳,屈绍彭,等. 国内外鲟鱼鱼子酱加工产业发展概述[J]. 科学养鱼,2010(9):69-70.
[7]王金秀. 蘑菇中脂肪酸提取衍生化方法研究与气相色谱法测定[D]. 长春:吉林大学,2008.
[8]Seppänen-Laakso T,Laakso I,Hiltunen R. Analysis of fatty acids by gas chromatography,and its relevance to research on health and nutrition[J]. Analytica chimica acta,2002,465:39-62.
[9]裴怀全. 水产品脂肪酸气相色谱测定方法的比较优化及应用[D]. 长春:吉林农业大学,2012.
[10]Wirth M,Kirschbaum F,Gessner J,et al. Chemical and biochemical composition of caviar from different sturgeon species and origins[J]. Food/Nahrung,2000,44(4):233-237.
[11]Czesny S,Dabrowski K,Christensen J E,et al. Discrimination of wild and domestic origin of sturgeon ova based on lipids and fatty acid analysis[J]. Aquaculture,2000,189(1):145-153.
[12]Chen I-C,Chapman F A,Wei C-l,et al. Differentiation of cultured and wild sturgeon(Acipenser oxyrinchus desotoi)based on fatty acid composition[J]. Journal of food science,1995,60(3):631-635.
[13]刘敬科. 鲢鱼风味特征及热历史对鲢鱼风味的影响[D]. 武汉:华中农业大学,2009.
[14]杨明,龙虎,文勇立,等. 四川牦牛,黄牛不同品种肌肉脂肪酸组成的气相色谱-质谱分析[J]. 食品科学,2008,29(3):444-449.
[15]Fernandes C E,Vasconcelos M A d S,de Almeida Ribeiro M,et al. Nutritional and lipid profiles in marine fish species from Brazil[J]. Food Chemistry,2014,160:67-71.
[16]Turan H. Fatty acid profile and proximate composition of the thornback ray(Raja clavata,L. 1758)from the Sinop coast in the Black Sea[J]. Journal of Fisheries Sciencescom,2007,1(2):97-103.
[17]Chaijan M,Benjakul S,Visessanguan W,et al. Changes of lipids in sardine(Sardinella gibbosa)muscle during iced storage[J]. Food Chemistry,2006,99(1):83-91.
[18]Sae-leaw T,Benjakul S. Fatty acid composition,lipid oxidation,and fishy odour development in seabass(Lates calcarifer)skin during iced storage[J]. European Journal of Lipid Science and Technology,2014,116:885-894.
[19]A K,J O. Fish Lipids[M]. Florida:Zdzislaw E Sikorski and Anna Kolakowska(ed),2002.
[20]黄艳青,龚洋洋,陆建学,等. 不同加工方式的南极大磷虾粉营养品质评价[J]. 南方水产科学,2013,9(6):58-65.
[21]Sae-Leaw T,Benjakul S,Gokoglu N,et al. Changes in lipids and fishy odour development in skin from Nile tilapia(Oreochromis niloticus)stored in ice[J]. Food Chem,2013,141(3):2466-2472.
Changes of fatty acid profile in sturgeon (Husodauricus×Acipenserschrenckii)caviar during cool storage
HE Dan1,2,HAO Shu-xian1,*,WEI Ya1,LI Lai-hao1,YANG Xian-qing1,HUANG Hui1,LIN Wan-ling1
(1.South China Sea Fisheries Research Institute,Key Lab of Aquatic Product Processing of Ministry of Agriculture,National R&D Center for Aquatic Product Processing,Guangzhou 510300,China;2. College of Food Science &Technology,Shanghai Ocean University,Shanghai 201306,China)
The fatty acid composition of caviar from cultured sturgeon,and the changes of fatty acid composition during storage at 0℃ were investigated. The results showed that the fatty acid profile of initial caviar was:23.03% SFA(saturated fatty acids),33.68% MUFA(monounsaturated fatty acids)and 33.03% PUFA(polyunsaturated fatty acids). The sturgeon caviar had high nutritional value with high content of n-3 long chain PUFA,such as EPA and DHA. The marked decreases in unsaturated fatty acids(UFA),especially PUFA,and the significant increase in SFA were observed in the fatty acid profile of sturgeon caviar(p<0.05)with the extend of storage time. Those changes indicated that the extended iced storage time of sturgeon caviar resulted in the pronounced changes in lipids. Additionally,significant decreases were found in MUFA and PUFA of caviar after 3 months storage(p<0.05)and MUFA and PUFA decreased from 36.79,32.43 to 34.83,31.86 during 3~5 months storage,which indicated that 3~5 months was proved to be the key period of time to control the quality of caviar during cool storage.
cultured sturgeon;caviar;cool storage;fatty acid profile
2014-08-07
何丹(1989-),女,硕士研究生,主要从事水产品加工与质量安全研究。
*通讯作者:郝淑贤(1972-),女,博士,研究员,主要从事水产品加工与质量安全研究。
公益性行业(农业)科研专项(201003055-06);国家重大科技成果转化项目(ZD-2014-345-3);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院南海水产研究所)资助项目(2012YDOl)。
TS254.4
A
1002-0306(2015)11-0319-05
10.13386/j.issn1002-0306.2015.11.056
