应用响应面法优化叶黄素降解发酵培养基
2015-05-05杨雪鹏胡仙妹毛多斌
杨雪鹏,赵 越,胡仙妹,马 科,毛多斌
(郑州轻工业学院食品与生物工程学院,河南郑州 450001)
应用响应面法优化叶黄素降解发酵培养基
杨雪鹏,赵 越,胡仙妹,马 科,毛多斌
(郑州轻工业学院食品与生物工程学院,河南郑州 450001)
利用响应面分析法对Pantoeadispersa(Y08)菌降解叶黄素产香的培养基进行了优化。采用Box-Behnken实验设计,选定KH2PO4、蔗糖和混合氮源(酵母膏∶天门冬酰胺=2∶1)3个关键因子为响应因子,以叶黄素降解率为响应值建立多元二次回归方程,在分析各个因素的显著性和交互作用后,确定了Pantoeadispersa菌降解叶黄素的最优培养基为:蔗糖0.97%,混合氮源(酵母膏∶天门冬酰胺=2∶1)1.38%,KH2PO40.15%,叶黄素降解率为80.03%,与理论预测值基本吻合,比优化前提高140.67%。
培养基优化,叶黄素降解,Box-Behnken设计,响应面法
叶黄素也称黄体素,是一种含氧类胡萝卜素,广泛存在于果蔬、鲜花、烟草等植物中,使其具有鲜艳的颜色和极强的抗自由基能力[1-4]。在有些植物中,叶黄素是香味物质的前体物,叶黄素的降解既有重要的生物学意义又有重要的应用价值。例如,叶黄素的降解可产生β-紫罗兰酮等芳香物质,这些芳香物质是植物花香和果香的来源[5]。在食品与果蔬加工中,叶黄素的降解对产品感官品质、色泽等的影响很大。比如,在烤烟成熟和燃烧过程中,叶黄素可降解转化为β-大马酮、巨豆三烯酮等,这些化合物呈现出烟草特有的香味[6-10]。叶黄素亦可通过酶的降解产生β-紫罗兰酮、β-大马酮等香味物质[11],它们具有浓郁的花香和果香,且香气阈值很低,在制备香精香料方面具有重要价值[12]。
目前关于叶黄素降解的报道主要集中于物理降解和化学降解,而生物降解法尤其是利用酶和微生物来降解叶黄素产生香味物质的研究还很少[13-17]。生物法降解叶黄素与物理降解和化学降解相比较具有以下两个方面的显著优点:首先生物法降解利用了酶催化的专一性,得到成分相对单一的香味物质。其次,生物法降解得到的香味物质被认定为“天然成分”[18]。生物降解叶黄素将越来越受到大家的关注。
为了进一步提高叶黄素降解率,促进香味物质的生成,本研究以叶黄素降解菌PantoeadispersaY08为实验菌株,应用响应面分析法对发酵培养基进行优化,以叶黄素降解率为响应值,探讨了发酵培养基中影响叶黄素降解率的各种关键因素及其相互作用,最终得到培养基的最佳浓度配比。
1 材料与方法
1.1 材料与仪器
菌株 由前期实验,通过在万寿菊中筛选得到一株高效降解叶黄素的菌株,经鉴定为Pantoeadispersa(简称Y08),后于-20℃冰箱甘油管保存备用;斜面培养基 蛋白胨10.0g、酵母膏5.0g、NaCl 1.0g、琼脂20.0g、蒸馏水1L、pH=6.0;基础发酵培养基 葡萄糖10.0g、酵母膏5.0g、MgSO40.1g、叶黄素0.01g、Tween-80 1.0mL、蒸馏水1L、pH=6.0。
LC-MS联用仪 美国赛默飞世尔公司;HF Mega BE-C18柱 美国安捷伦科技公司;高速冷冻离心机 德国Herolab公司;单人双面净化工作台 苏州净化设备有限公司;精密电子天平 赛多利斯科学仪器(北京)有限公司;溶剂微孔过滤膜有机系 天津津腾;50L立式圆形压力蒸汽灭菌锅 上海医用核子仪器厂;pH酸度计 上海市实验仪器总厂。
1.2 实验方法
1.2.1 培养方法 种子培养:将筛选得到的降解叶黄素Y08菌株接种于斜面培养基活化24h,接种于装液50mL/250mL 三角瓶中,28℃,150r/min 避光培养24h即为种子液;发酵培养:按2%的接种量将种子液接种于装液量为100mL/250mL的三角瓶中,28℃,150r/min避光培养96h。
1.2.2 生物量的测定 取10mL发酵液3000r/min离心,洗涤2次,用蒸馏水转移菌体至称量瓶中烘干至恒重M。
生物量(g/L)=M×100
1.2.3 叶黄素测定方法
1.2.3.1 发酵液预处理方法 发酵液在避光条件下,12000r/min离心10min,取上清液,加入等体积二氯甲烷反复萃取3次,得叶黄素的提取物,加无水Na2SO4干燥过夜,过0.45μm的有机系膜,待LC-MS分析,并有等体积不接菌培养基作为对照[19]。
1.2.3.2 LC-MS分析的条件 液相条件:选择Thermo C18柱,常温,进样压力化学电离源(APCI)作为离子源;毛细管加热温度:350℃;电喷雾电压,5kV;离子源鞘气(N2):30Arb;离子源辅助气(N2):10Arb;碰撞气体为高纯氦气(>99.999%);扫描范围:m/z 200~2000全扫描;扫描速率:1scan/s。
1.2.3.3 内标的配制 用苏丹红I号作为内标。准确称取0.02096g的苏丹红I号,用二氯甲烷定容至500mL作为内标液备用。
1.2.3.4 叶黄素标准曲线的绘制 配制的6个梯度的标准溶液根据建立的色谱条件进行LC-MS分析后,以标样峰面积(Ai)/内标峰面积(As)为纵坐标(Y),质量浓度为横坐标(X),绘制标准曲线。
1.2.3.5 叶黄素降解率计算公式
1.3 单因素实验
1.3.1 培养基中碳源的优化 在每100mL基础培养基中,接种2%的种子培养基,分别以浓度1%的葡萄糖、麦芽糖、蔗糖、乳糖、糊精、壳聚糖作为碳源,在28℃、150r/min发酵培养96h,通过LC-MS法测定叶黄素含量,计算得到叶黄素降解率。再对其添加量进行优化,碳源添加量分别为:0.5%、1%、1.5%、2%、2.5%、3%、4%、5%,发酵条件及测定方法同上。
1.3.2 培养基中氮源的优化 以浓度为1%的蛋白胨、酵母膏、KNO3、(NH4)2SO4、天门冬酰胺、混合碳源(酵母膏∶天门冬酰胺=2∶1、1∶1、1∶2)作为氮源,发酵条件及测定方法同上。再对其添加量进行优化,选取浓度为 0.5%、1%、2%、3%、4%、5%的混合氮源(酵母膏∶天门冬酰胺=2∶1),发酵条件及测定方法同上。
1.3.3 培养基无机盐的优化 在以上条件确定的情况下,分别以 0.1%的 CaCl2、KCl、MgSO4、KH2PO4、FeSO4、Na2SO4的金属离子为无机盐离子,其余条件同上。再对其添加量进行优化,添加量分别设为 0.01%、0.05%、0.10%、0.15%、0.20%、0.25%、0.30%,发酵条件及测定方法同上。
1.3.4 响应面法确定最佳培养降解条件 参考文献[20],实验采用Box-Benhnken实验设计,通过单因素实验,确定Box-Benhnken实验的各因素水平。本实验设蔗糖、混合氮源,KH2PO4三个因素,每个因素设三个水平,进行摇瓶发酵实验,寻找最佳发酵培养基成分。本实验用应用Design-Expert软件对实验数据进行多项式拟合回归后,得到回归方程,进而绘制三维响应面图。响应面因素水平设计见表1。
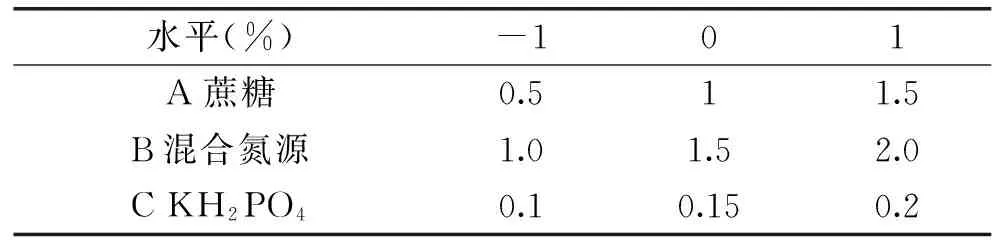
表1 Box-Benhnken设计各因素及水平Table 1 Factors and levels of Box-behnken design for response surface methodology(RSM)
1.4 数据统计分析
应用Design-Expert软件中的RSREG(Response Surface Regression)程序进行回归计算,并对回归方程进行方差分析和系数显著性检验。
2 结果与讨论
2.1 标准曲线的绘制
按照1.2.3.4方法进行检测,结果如图1所示。
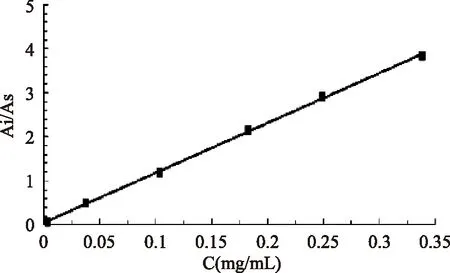
图1 叶黄素标准曲线Fig.1 Lutein standard curve
如图1所示,得出线性回归方程Y=0.0602+11.275X,相关系数R2=0.9997,结果表明叶黄素浓度在3.383~338.3μg/mL之间,与峰面积呈良好的线性关系。
2.2 单因素实验结果
2.2.1 碳源对降解叶黄素的影响 考察葡萄糖、蔗糖、乳糖、麦芽糖、糊精、壳聚糖对Y08菌株降解叶黄素能力的影响。采用基础发酵培养基,分别添加1%不同种类的碳源,28℃、150r/min培养96h后测定生物量和叶黄素降解率,结果如图2所示。从图2可以看出,以蔗糖为碳源时叶黄素降解率相对较高,故选用蔗糖作碳源。
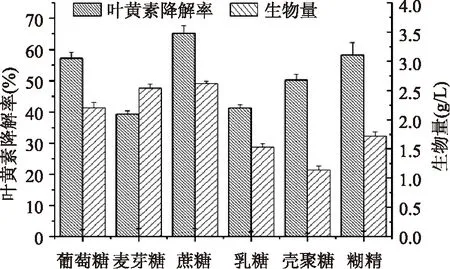
图2 不同碳源对生物量和叶黄素降解率的影响Fig.2 Effect of different carbon sources on biomass and degradation of lutein
2.2.2 碳源浓度对降解叶黄素的影响 不同蔗糖浓度对Y08菌株降解叶黄素的影响,结果如图3所示,当蔗糖浓度为1%时,叶黄素降解率最高。随着蔗糖添加量的继续增加,反而不利于叶黄素降解,其原因可能是蔗糖添加量较大时,产生底物抑制现象,从而导致叶黄素降解率下降。
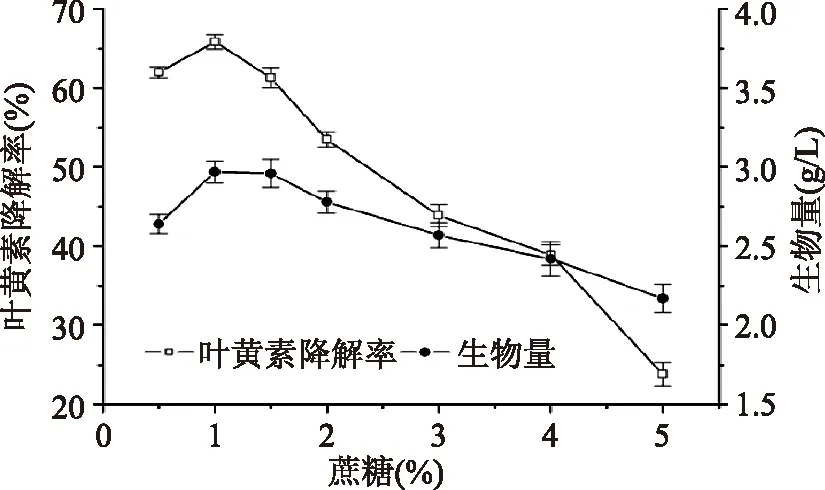
图3 蔗糖浓度对生物量和叶黄素降解率的影响Fig.3 Effect of sucrose concentration on biomass and degradation of lutein
2.2.3 氮源对降解叶黄素的影响 不同氮源对叶黄素的降解均有一定程度的促进作用,其中有机氮源酵母膏、天门冬酰胺对叶黄素降解具有明显的促进作用。无机氮源中的KNO3、(NH4)2SO4对菌体的生长也有一定的作用,但效果不如有机氮源明显。当以混合氮源为唯一氮源时,不同比例的混合碳源比单一碳源对叶黄素降解均有更明显的促进作用。以YE∶LA=2∶1为最佳混合氮源,可能是该比例混合氮源中含有更丰富的氨基酸种类,从而促进叶黄素的降解。

图4 不同氮源对生物量和叶黄素降解率的影响Fig.4 Effect of different nitrogen sources on biomass and degradation of lutein
2.2.4 氮源浓度对降解叶黄素的影响 菌株在不同浓度氮源的培养基中发酵后生物量和叶黄素降解率的测定结果(图5)表明,氮源浓度过高或不足都会影响到菌体的生长和叶黄素的降解,当浓度过低时,很可能是由于营养物质不充分而未能给菌体提供有利的降解条件,而过高则又会抑制叶黄素降解酶的产生。实验结果表明,当氮源浓度为1.5%时叶黄素降解率最高。
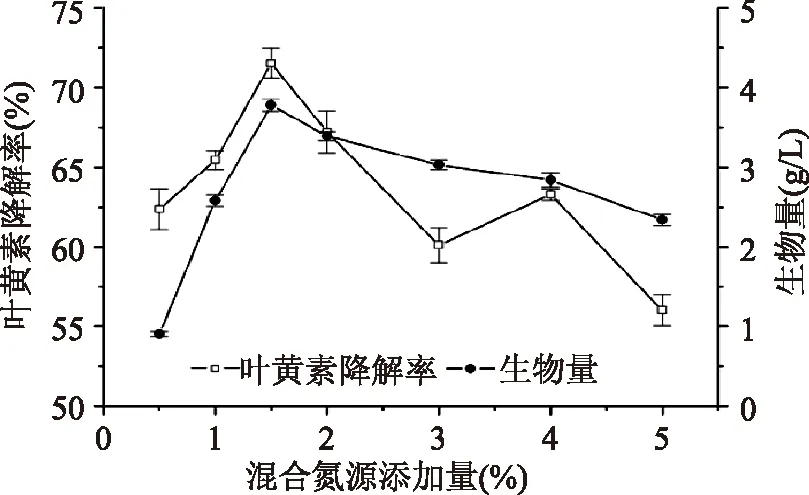
图5 氮源浓度对生物量和叶黄素降解率的影响Fig.5 Effect of nitrogen concentration on biomass and degradation of lutein
2.2.5 无机盐对降解叶黄素的影响 从图6可知,选用KH2PO4叶黄素降解率最高,而选用FeSO4时,叶黄素降解率最低。原因可能是KH2PO4能有效减小H+梯度对细胞的毒害作用,能够使菌体更好的生长。
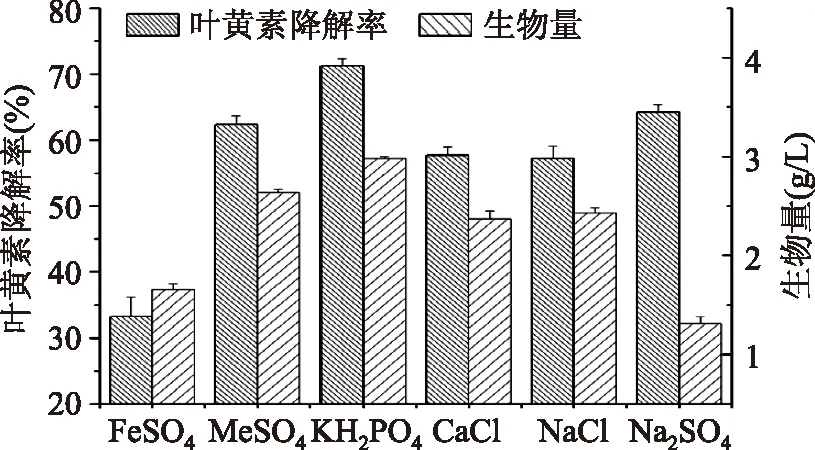
图6 不同无机盐对生物量和叶黄素降解率的影响Fig.6 Effect of different inorganic salts on biomass and degradation of lutein
2.2.6 磷酸二氢钾浓度对降解叶黄素的影响 图7可知KH2PO4添加量在0.01%~0.15%时,叶黄素降解率随KH2PO4量增加逐渐升高,0.15%浓度时叶黄素降解率最高。随着KH2PO4浓度继续增加,叶黄素降解率反而逐渐下降。其原因可能是高浓度的KH2PO4对菌体生长有一定抑制作用,从而影响叶黄素的降解率。
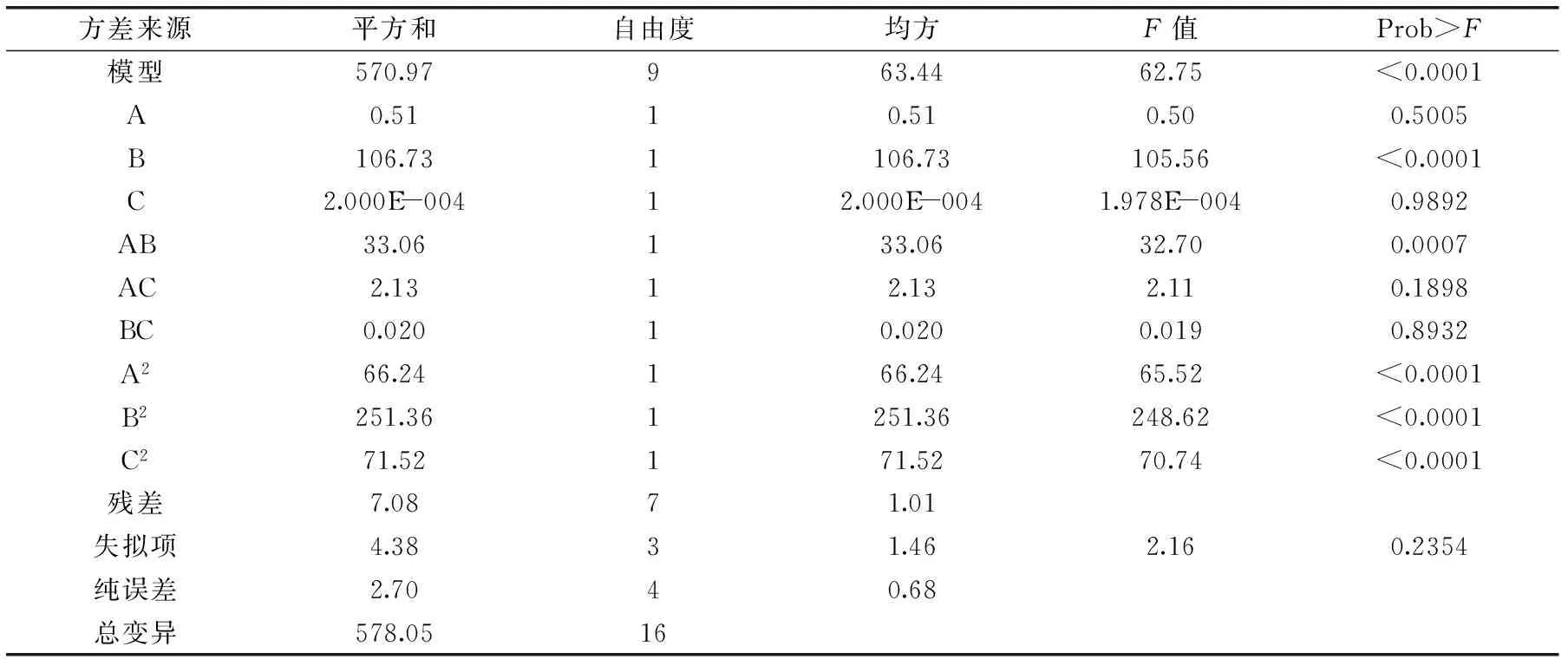
表3 回归模型方差分析Table 3 ANOVA for regression model
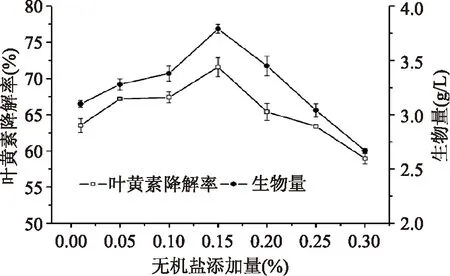
图7 无机盐浓度对生物量和叶黄素降解率的影响Fig.7 Effect of inorganic salt concentration on biomass and degradation of lutein
2.3 响应面法(RSM)优化过程
响应面分析法是一种寻找多因素系统中最优条件的数理统计方法,其中最常见的是采用Box-Behnken设计原理,根据此原理,以叶黄素降解率为响应值,设计了3因素3水平的响应面分析实验 其具体实验方案及结果见表2。
应用Design-Expert软件对实验数据进行多项式拟合回归后,得到以下回归方程:
Y=+79.74+0.25A-3.65B+0.005C+2.88AB+0.73AC+0.070BC-3.97A2-7.73B2-4.12C2
回归方程的方差分析结果见表3,该方程表达了叶黄素降解率与所选的3个因素之间的关系。当“Prob>F”值<0.01时,表示该项指标极显著,当“Prob>F”值<0.05时,表示该项指标显著。回归方程的决定系数(R2)为0.9720,信噪比(Adequate. Precision)为23.954。这表明方程的拟合度与可信度均很高,实验误差较小,能够对叶黄素降解过程进行预测与分析。整体模型的“Prob>F”值<0.01,表明该二次方程模型极显著。混合氮源对菌株降解叶黄素的影响极显著,蔗糖和KH2PO4影响不显著,蔗糖与混合氮源交互作用影响极显著。
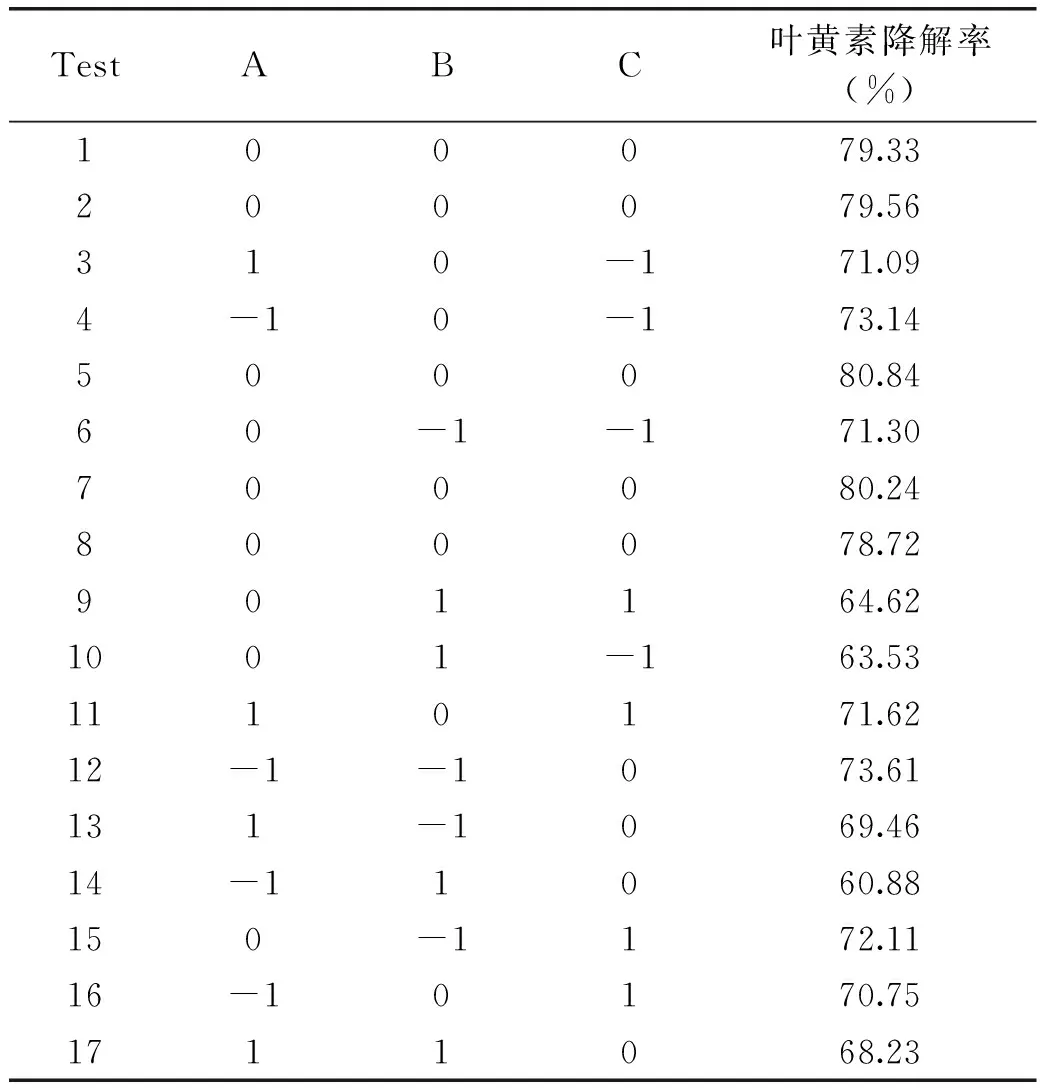
表2 Box-Behnken实验设计与结果Table 2 Results of Box-Behnken design
采用Design-Expert软件绘制三维响应曲面图(见图8)。图8直观地反映了各因素交互作用对响应值的影响,其中蔗糖和混合氮源交互作用显著,混合氮源与KH2PO4交互作用不显著,蔗糖与KH2PO4交互作用不显著。
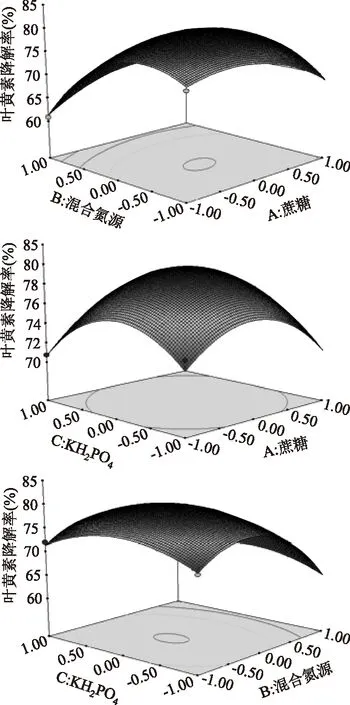
图8 各因素交互影响叶黄素降解率的响应曲面图Fig.8 Response surface plot and contour diagram for interaction of various factors on degradation of lutein
通过图8中的响应面立体图可以看出,响应值存在最大值,应用Design-Expert软件求解方程,得到叶黄素降解最优培养基组成为蔗糖0.97%,混合氮源(酵母膏∶天门冬酰胺=2∶1)1.38%,KH2PO40.15%,叶黄素降解率的预测值为80.18%。
按优化后的条件进行验证实验,平行实验3次,其叶黄素降解率平均为80.03%,与理论预测值基本吻合,比优化前提高140.67%,这说明响应面法可以有效地优化叶黄素降解培养基,从而提高叶黄素降解率。
3 结论
应用Box-Behnken中心组合实验设计方法,优化了Pantoea dispersa Y08菌降解叶黄素的培养基。结果表明,最优培养基为:蔗糖0.97%,混合氮源(酵母膏∶天门冬酰胺=2∶1)1.38%,KH2PO40.15%,培养基经优化后,叶黄素降解率增加到80.03%,较优化前有显著提高。
[1]吴兴壮,张华,王小鹤,等.制备万寿菊叶黄素技术研究进展[J].食品工业科技,2012(6):456-459.
[2]孟丽,赵文军.万寿菊干花中叶黄素酯的超声提取工艺研究[J].食品工业科技,2009(3):270-275.
[3]凌关庭.万寿菊色素及其生理功能[J].粮食与油脂,2002(12):44-46.
[4]Sommerburg O,Keunen J E,Bird A C,et al.Fruits and vegetables that are sources for lutein and zeaxanthin,the macular pigment in human eyes[J].Br J Ophthalmol,1998,82(8):907-910.
[5]宫长荣.不同烘烤条件下烟叶色素降解规律的研究[J].烟草科技,1997(2):33-34.
[6]Wahlberg I,Kerstin K,Austin D J. Effects of flue-curing and ageing on the volatile,neutral and acidic constituents of Virginia tobacco[J]. Phytochemistry,1977(16):1217-1231.
[7]侯英,徐济仓,王保兴,等.叶黄素的热解产物分析[J].烟草科技,2007(12):27-32.
[8]庞慧丽,李大婧,刘春泉,等.在高温油脂中叶黄素的热降解动力学[J].食品工业科技 ,2013(18):147-151.
[9]Gopalam A,Gopalaehari N C. Biochemical changes in leaf pigments and chemical constituents during flue-curing of tobacco[J]. Tob Res,1979,17(5):113-117.
[10]Matsubara S,Morosinotto T,Osmond C B,et al.Short and long-term operation of the lutein-epoxide cycle in light-harvesting antenna complexes[J]. Plant Physiology,2007,144(2):926-941.
[11]Marie F N,De Gaulejac N V,Nicolas V,et al.Characterization of carotenoids and degradation products in oak wood incidence on the flavour of wood[J]. Comptes Rendus Chimie,2004(7):689.
[12]Wache Y,Deratuld A,Belin J M.Dispersion of carotene in process of production of ionone by cooxidation using enzyme-generated reactive oxygen species. Process Biochemistry,2006,41(11):2337-2341
[13]缪明明,王昆文,李鲜,等.叶黄素的化学降解产物及机理研究[J].烟草科技,1998(2):30.
[14]刘金霞,李元实,姬小明,等.叶黄素氧化降解产物GC-MS分析及在卷烟加香中的应用[J].郑州轻工业学院学报:自然科学版,2011,26(2):24-26.
[16]罗昌荣,赵震毅,刘涵刚,等.类胡萝卜素裂解温度对其裂解产物的影响[J]. 无锡轻工大学学报,2003,22(3):67-75.
[16]张永涛,刘惠芳,张东豫,等. 类胡萝卜素的热裂解研究[C]. 中国烟草学会工业专业委员会烟草化学学术研讨会论文集,海南:中国烟草学会,2005:335-339.
[17]杨伟祖,谢刚,王保兴,等.烟草中β-胡萝卜素的热裂解产物的研究[J]. 色谱,2006,24(6):611-614.
[18]Uenojo M,Marostica M R,Pastore G M. Carotenóides propriedades aplicações e biotransformaçõo para formaçõo de compostos de aroma. Química Nova,2007,30(2):616-622.
[19]王睿,孙德亚,王艳,等.高效液相法测定万寿菊颗粒中叶黄素的含量[J].特产研究 ,2013(3):61-64.
[20]曾东慧,张俊,陆胜民.响应曲面法提取温州蜜柑果皮中类胡萝卜素的工艺优化[J].食品工业科技 ,2013(19):183-187.
Optimization of fermentation medium for lutein degradation applying response surface methodology
YANG Xue-peng,ZHAO Yue,HU Xian-mei,MA Ke,MAO Duo-bin
(Food and Bioengineering College,Zhengzhou University of Light Industry,Zhengzhou 450001,China)
Optimization of fermentation medium using for lutein degradation to form important aroma compounds withPantoeadispersaY08 strain was performed employing the response surface analysis(RSA)method. Based on single factor experiment,three critical factors(the content of sucrose,mixed nitrogen sources and KH2PO4)were selected as response factors. The quadric regression equation was established according to the lutein degradation yield. As a result,the optimum fermentation medium was composed of sucrose 0.97%,mixed nitrogen sources(yeast extract∶asparagine=2∶1)1.38% and KH2PO40.15%. Under the situation,the highest yield of degradation of lutein was predicted to be 80.03%. After optimization,the lutein degradation yield was increased by 140.67%. The experimental values were in according with the predicted values.
fermentation medium optimization;degradation of lutein;Box-Behnken design;response surface methodology
2014-07-11
杨雪鹏(1973-),男,博士,副教授,研究方向:烟草工程与酶工程。
国家自然科学基金(21276084);烟草工业生物技术重点实验室课题。
TS201.3
A
1002-0306(2015)11-0167-05
10.13386/j.issn1002-0306.2015.11.025
