CK5/6、CK8/18、SMA、P63、ER在乳腺导管增生性病变中的表达及意义
2015-05-05肖兰戴一菲肖静
肖兰 戴一菲 肖静
新版WHO(2012)乳腺肿瘤分类将乳腺导管内增生性病变分为普通性导管增生(usual ductal hyperplasia,UDH)、非典型性导管增生(atypical ductal hyperplasia,ADH)、导管原位癌(ductal carci noma in situ,DCIS)和分类中新增诊断术语-柱状细胞病变、柱状细胞变和增生、平坦型上皮不典型增生(flat epithelial atypia,FEA)[1-2]。大多数乳腺IDPL仅靠HE染色切片就可以诊断,但是某些病变存在组织结构的复杂性而使鉴别有一定的困难,尤其是旺炽型UDH与ADH、ADH与低级别DCIS,甚至一些复杂的病变还要与浸润癌相鉴别[3],临床对这些病变的处理不尽相同,因此鉴别诊断具有重要意义。本研究通过测定CK5/6、CK8/18、SMA、P63、ER在乳腺IDPL中的表达,探讨其在乳腺IDPL中的意义,从而辅助不同乳腺病变的鉴别。
1 材料与方法
1.1 材料 收集孝感市中心医院病理科2003-2013年存档的乳腺病理标本150例,均为女性,平均年龄45岁,根据WHO(2003)乳腺肿瘤分类标准对其进行诊断和分类,其中UDH 21例,FEA 46例,ADH 51例,DCIS 32例。
1.2 方法 标本固定于4%中性甲醛溶液,石蜡包埋,常规切片,HE染色。免疫组化采用EnVision两步法。鼠单克隆一抗为 CK5/6(D5/16B4)、CK8/18(5D3)、SMA(1A4)、P63(4A4)、ER(1D5),所有抗体及试剂盒均购自福州迈新生物技术有限公司,操作严格按免疫组化试剂盒说明书进行。阳性对照为正常乳腺组织,PBS代替一抗作阴性对照。
1.3 结果判断 CK5/6、CK8/18、SMA阳性着色定位于细胞质,呈黄色、棕黄色颗粒;P63、ER阳性着色定位于细胞核,呈黄色、棕黄色颗粒。
1.4 统计学处理 使用SPSS 13.0统计软件对数据进行分析,计数资料比较采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CK5/6的表达 所有病例中,基膜侧(通常肌上皮部位)均见CK5/6表达。腔缘侧(通常腺上皮部位)的表达:在UDH中,为100%(21/21),呈弥漫、拼花状、马赛克样表达;在FEA中,未见阳性表达,阳性率为0(0/46);在ADH中,表达仅为33.33%(17/51),且为部分或灶状阳性表达;在DCIS中,表达为6.25%(2/32),为散在点灶状阳性表达。CK5/6在腔缘侧的表达,在UDH组、ADH组、DCIS组,组间两两比较,差异有统计学意义(P<0.05);FEA组分别与UDH组及ADH组比较,差异均有统计学意义(P<0.05);FEA组与DCIS组比较,差异无统计学意义。
2.2 CK8/18的表达 所有病例,基膜侧均未见阳性表达。腔缘侧的表达:在UDH中,为85.71%(18/21),呈拼花状、马赛克样表达;在FEA、ADH、DCIS中,分别为100%(46/46)、94.12%(48/51)、93.75%(30/32),均呈弥漫表达。CK8/18在腔缘侧的表达,在UDH组、FEA组、ADH组、DCIS组,组间两两比较,差异均无统计学意义。
2.3 SMA及P63的表达 SMA及P63在UDH、ADH、FEA中,可见基膜侧连续表达,阳性率分别为100%(21/21)、100%(46/46)、100%(51/51), 在 DCIS中, 阳 性 率 为93.75%(30/32)。在UDH组、ADH组、FEA组、DCIS组中的表达,组间的两两比较,差异均无统计学意义。在UDH的腔缘侧可见少许散在表达,在ADH、FEA及DCIS的腔缘侧未见阳性表达。
2.4 ER的表达 ER在UDH、FEA、ADH、DCIS中的表达分别为 28.57%(6/21)、86.96%(40/46)、52.94%(27/51)、78.13%(25/32),在UDH中呈不均一表达,在FEA、ADH及DCIS中呈均匀一致的表达,且表达强于UDH。UDH组分别与FEA组、ADH组、DCIS组比较,差异均有统计学意义(P<0.05);FEA组、ADH组、DCIS组,组间两两比较,差异均无统计学意义。
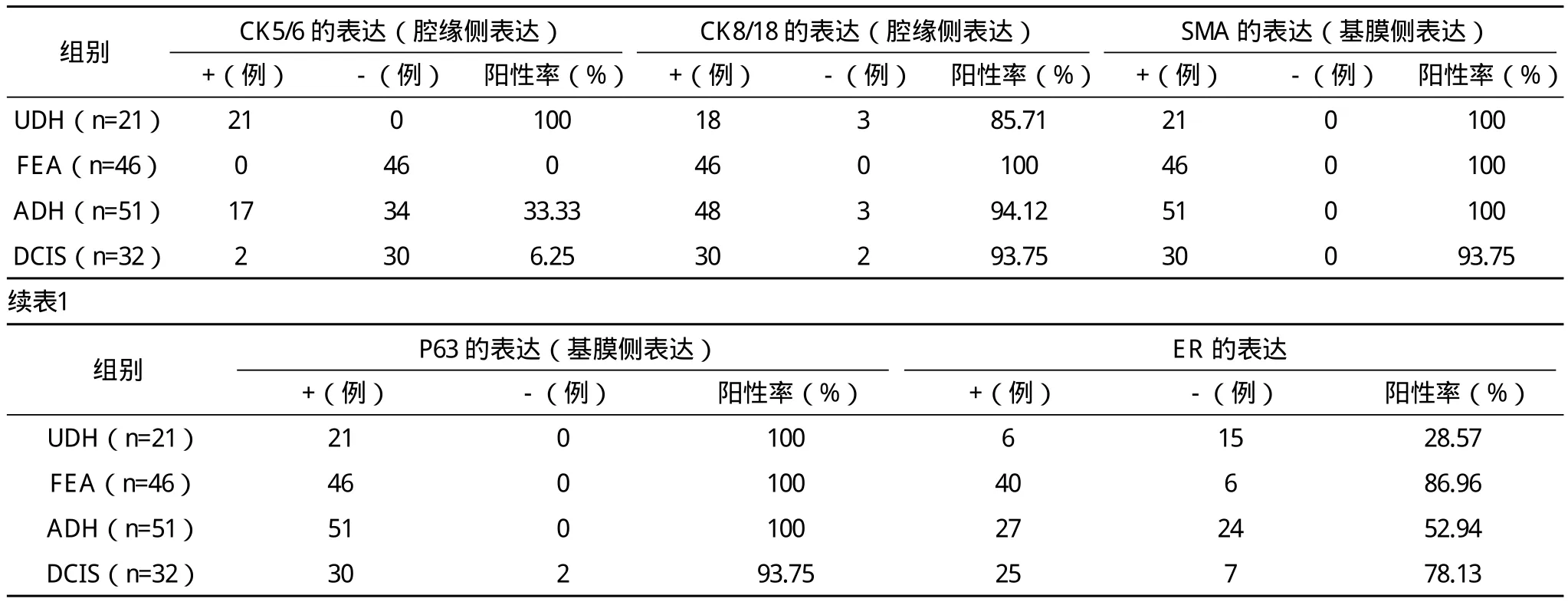
表1 各组CK5/6、CK8/18、SMA表达情况比较
3 讨论
乳腺增生病是生育期女性的常见病和多发病,其发病率占育龄妇女的40%左右,占全部乳房疾病的75%,是最常见的乳房疾病[4]。一直以来,人们都认为乳腺组织含有腺上皮和肌上皮两种细胞[5],导管内增生性病变主要是腺上皮的增生。但近年的研究表明乳腺组织中存在着一种定向干细胞,其中以Boecker[6]提出的乳腺干细胞理论最具有代表性。Boecker等[6]的研究表明乳腺的腺上皮和肌上皮均起源于定向干细胞(表达CK5/6),他认为这种定向干细胞具有多向分化潜能,可分别沿腺细胞系及肌上皮细胞系分化,进一步分化成腺中间细胞及肌上皮的中间细胞,最终分化成终末型的腺上皮细胞(表达CK8/18)及终末型的肌上皮细胞(表达SMA及P63),在这个过程中,定向干细胞逐渐获得CK8/18或SMA、P63的表达,并逐渐丢失CK5/6的表达,直到完全分化成仅表达CK8/18或SMA、P63而不表达CK5/6的终末腺上皮细胞或终末肌上皮细胞。因此,Boecker认为正常乳腺组织存在5种细胞成分,包括定向干细胞(表达CK5/6)、腺上皮中间细胞(表达CK5/6及CK8/18)、腺上皮终末细胞(表达CK8/18)、肌上皮中间细胞(表达CK5/6、SMA及P63)、肌上皮终末细胞(表达SMA及P63)。
本实验中,所有UDH腔缘侧均表达CK5/6,呈弥漫、拼花状、马赛克样表达,其中一些细胞,还同时表达CK8/18或SMA、P63,是腺中间细胞或肌上皮中间细胞,仅表达CK5/6的是定向干细胞,另一些仅表达CK8/18的细胞,是腺上皮终末细胞。说明了UDH是定向干细胞的增生,增生的定向干细胞向腺系分化,分化成腺中间细胞及腺终末细胞,向肌上皮系分化,分化成肌上皮中间细胞,分化成的肌上皮终末细胞存在基膜侧。因此,UDH中存在多种细胞:定向干细胞、腺中间细胞、腺终末细胞、肌上皮中间细胞。这也解释了UDH的近腔缘侧为什么存在SMA及P63阳性的细胞。
本实验中,100%的FEA的腔缘侧弥漫表达表达CK8/18,说明在FEA中,腺上皮获得了单克隆性;94.12%的ADH的腔缘侧弥漫表达CK8/18、仅散在表达CK5/6;93.75%的DCIS的腔缘侧弥漫表达CK8/18,未见CK5/6表达,说明从UDH到ADH到DCIS,腺上皮逐渐获得单克隆性。
一些乳腺增生性病变存在复杂的组织构象,需要与浸润癌鉴别,乳腺肌上皮是否存在对鉴别良、恶性病变具有重要的鉴别意义,当发生浸润时,癌性腺体周围无肌上皮细胞[7]。P63及SMA是标记乳腺肌上皮常用的抗体,本次实验中,所有的UDH、ADH、FEA管周均可见肌上皮连续表达,93.75%的DCIS管周可见肌上皮连续表达,6.25%的DCIS管周可见散在的肌上皮表达。SMA可标记乳腺的肌上皮细胞,同时也可标记间质的肌纤维母细胞及血管的平滑肌细胞[8],在一些病例易将间质的肌纤维母细胞及血管的平滑肌细胞误认为是乳腺的管周肌上皮,SMA阳性细胞只有胞质向腺上皮间突起才能被确认为是肌上皮,否则可能为肌纤维母细胞[9]。P63可较准确地标记出肌上皮细胞(肌上皮表达而肌纤维母细胞及血管平滑肌不表达),P63为核着色,表达较稀疏,并且部分肌上皮不表达P63,易认为肌上皮表达缺失而误诊为浸润性癌[9]。所以,在判断乳腺肌上皮存在与否时,应联合应用SMA及P63。
研究发现雌激素在调节正常乳腺的生长分化以及乳腺癌的发生发展方面起到了重要作用[10-12]。有研究表明在较高级别的DIN中ER的表达消失[13];本实验中,FEA组、ADH组、DCIS组的ER阳性表达率明显高于UDH组,比较差异有统计学意义(P<0.05);FEA组、ADH组、DCIS组的ER阳性表达率,组间两两比较,差异均无统计学意义。在UDH组,ER的表达呈不均一表达,FEA组、ADH组、DCIS组,ER的表达呈均一的强表达。
本实验讨论了乳腺组织中存在干细胞(表达CK5/6),CK5/6在UDH中表达最多,在ADH中表达明显减少,至DCIS及FEA时完全消失;CK8/18在UDH中呈拼花状表达,在ADH、DCIS及FEA中呈弥漫一致的强表达,说明了UDH的腺上皮是多克隆性增生,而ADH、DCIS、FEA的腺上皮获得了单克隆性。SMA及P63在UDH、ADH、FEA、DCIS中呈连续表达,可与浸润的癌性腺体相鉴别,由于SMA、P63各自的优缺点,两者联用可起到更好的作用。ER是一种核内激素受体,在乳腺癌的发生、发展中起着关键性的作用,正常乳腺组织中ER的阳性表达会增加乳腺癌发生的危险性[14],本实验显示,在UDH中,ER的表达呈不均一表达,FEA、ADH、DCIS中,ER的表达呈均一的强表达。
乳腺导管内增生性病变是乳腺癌的前驱病变[15],应引起足够的重视,联合检测CK5/6、CK8/18、SMA、P63、ER有助于乳腺增生性病变的病理诊断及鉴别诊断,具有一定的临床意义。
[1]齐晓伟,姜军.2012年第4版《WHO乳腺肿瘤组织学分类》介绍[J].中华乳腺病杂志(电子版),2012,6(5):586-591.
[2]刘标,周晓军.解读2012年WHO乳腺肿瘤分类[J].临床与实验病理学杂志,2012,28(11):1185-1187.
[3]朱丽娜.乳腺导管内增生性病变诊断与鉴别诊断中CK5/6和P63的意义[J].临床与实验病理学杂志,2013,29(9):1010-1012.
[4]王攻,崔雨佳,邢敏.乳腺增生病与乳腺癌的相关性研究[J].中国医学创新,2010,20(7):191-193.
[5]陶淑芳,杨春玉,彭雪峰,等.CK5/6、CK14、SMA、P53、KI67、ER在乳腺导管内增生性病变中的表达及意义[J].南昌大学学报(医学版),2012,52(4):45-49.
[6] Bocker W,Moll R,Poremba C,et al.Common adult stem cells in the human breast give rise to glandular and my oepithelial cell lineages:a new cell biological concept[J].Laboratory Investigation,2002,82(6):737-746.
[7]丁华野,皋岚湘.乳腺良、恶性上皮性病变诊断及鉴别诊断的某些问题[J].临床与实验病理学杂志,2004,20(1):15-18.
[8]刘国新,马沛,易建华.34βE12、CK5/6、p63、SMA在乳腺增生、不典型增生与原位癌鉴别诊断中的价值[J].实用癌症杂志,2013,28(1):28-30.
[9]陈国璋,徐艳,周晓军.乳腺上皮性病变的诊断与鉴别诊断[J].临床与实验病理学杂志,2008,24(1):1-5.
[10] Travis R C,Key T J.Oestrogen exposure and breast cancer risk[J].Breast Cancer Res,2003,5(5):239-247.
[11] Duss S,Andre S,Nicoulaz A L,et al.An oestrogen-dependent model of breast cancer created by transformation of normal human mammary epithelial cells[J].Breast Cancer Res,2007,9(3):R38.
[12] Polyak K.Breast cancer:origins and evolution[J].J Clin Invest,2007,117(11):3155-3163.
[13]付丽.乳腺小叶内瘤及导管上皮的增生性病变[J].中华病理学杂志,2006,35(1):4-7.
[14]徐晓红,包明稳,曹军,等.乳腺浸润性导管癌声像图特征与C-erbB-2、ER、PR表达的相关性研究[J].中国超声医学杂志,2010,26(12):1068-1071.
[15]杨举伦.乳腺导管内增生性病变是乳腺癌前驱病变[J].临床与实验病理学杂志,2011,27(9):919-923.
