血液标本采集对ICU住院患者生化检验结果的影响*
2015-05-05刘发全宋刚
刘发全 宋刚
血液生化检验是各级医院开展最为广泛,也是临床最重要的检验项目之一。血液生化检验结果的时效性和准确性关系到临床诊疗的科学性。快速、准确地进行血液生化检验可以为临床医师最大程度提供实验室诊断依据和治疗反馈,具有重要的临床意义。ICU住院患者病情危重、血管条件差、往往需同时进行多项血液生化检验,对血液生化检验结果准确性的需求较高。血液生化检验质量控制是保障诊断确切与治疗安全的必要举措,标本的采集是质量控制的重要环节[1]。本研究以300例ICU住院患者作为研究对象,分别从采血部位、采血时间、是否使用促凝管对检验指标进行对比分析,探讨血液标本采集对生化检验结果的影响,以进一步规范ICU住院患者血液生化检验,现具体报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月-2015年1月本院ICU住院患者300例作为研究对象,其中男193例、女107例,年龄(37.8±7.2)岁,入院诊断依次为冠心病92例(30.67%)、慢性阻塞性肺疾病68例(22.67%)、2型糖尿病47例(15.66%)、慢性肾功能不全22例(7.33%)、其他71例(23.67%)。排除失血性休克、感染性休克等需大量补液进行治疗的患者。被检者均自愿参与并配合此次研究。本研究得到本院医学伦理委员会审批通过。
1.2 方法
1.2.1 研究设计 本研究是前瞻、观察性临床研究,不进行治疗干预。300例入组患者根据采血部位、输液后采血时间及是否采用促凝管分3次依次行血液生化检验,分别统计分析3次生化检验的结果。输注液体为0.9%氯化钠溶液,100 mL/h,钾浓度为0.3%。采血部位分为输液同侧和输液另侧,输液后采血时间分为输液后半小时和输液后2 h,按是否采用促凝管分为采用促凝管和采用EDTA-K2抗凝管。
1.2.2 血液标本留取方法 第1次于开始补液半小时至1 h内分别于输液同侧和输液另侧留取血液标本2 mL,标本收集采用促凝管;第2次分别于输液后半小时和输液后2 h在输液另侧留取血液标本2 mL,标本收集采用促凝管;第3次于输液后半小时在输液另侧留取血液标本4 mL,采用促凝管和EDTA-K2抗凝管分别收集2 mL。
1.2.3 检测指标及方法 采用氧化法检测总胆红素、总蛋白、谷丙转氨酶、尿素氮、肌酐、钾、钠、钙、总胆固醇、甘油三酯及低密度脂蛋白。每例患者于入院2 d内清晨6点至10点空腹抽取血液标本离心,取血清或血浆行生化分析(AU2700生化分析仪)。
1.2.4 质量控制 所有血液标本由高年资护理人员采用一次性静脉采血针完成采血,并于采血完成半小时内送检验科行血液生化检验。所有标本经离心后无明显溶血及乳糜状。进行血液生化检验前采用朗道质控物(批号:ZX21511N)进行质量控制[5]。
1.3 统计学处理 资料数据均应用SPSS 19.0软件处理,计量资料以(±s)表示,比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 采血部位对生化检验结果的影响 输液同侧总胆红素、总蛋白、尿素氮、肌酐、总胆固醇、甘油三酯均显著低于输液另侧,比较差异有统计学意义(P<0.05)。两侧谷丙转氨酶、钾浓度、钠浓度、钙浓度、低密度脂蛋白比较差异无统计学意义(P>0.05),见表1。
2.2 输液后采血时间对生化检验结果的影响 输液后2 h钾、钠浓度均显著高于输液后半小时,比较差异均有统计学意义(P<0.05)。输液后半小时和输液后2 h总胆红素、总蛋白、谷丙转氨酶、尿素氮、肌酐、钙浓度、总胆固醇、甘油三酯、低密度脂蛋白比较差异均无统计学意义(P>0.05),见表2。
2.3 采用EDTA-K2抗凝管对生化检验结果的影响 采用EDTA-K2抗凝管的钙浓度显著低于采用促凝管的检验结果,比较差异有统计学意义(P<0.05)。采用促凝管与采用EDTA-K2抗凝管总胆红素、总蛋白、谷丙转氨酶、尿素氮、肌酐、钾浓度、钠浓度、总胆固醇、甘油三酯、低密度脂蛋白比较差异均无统计学意义(P>0.05),见表3。

表1 采血部位对生化检验结果的影响(x-±s)
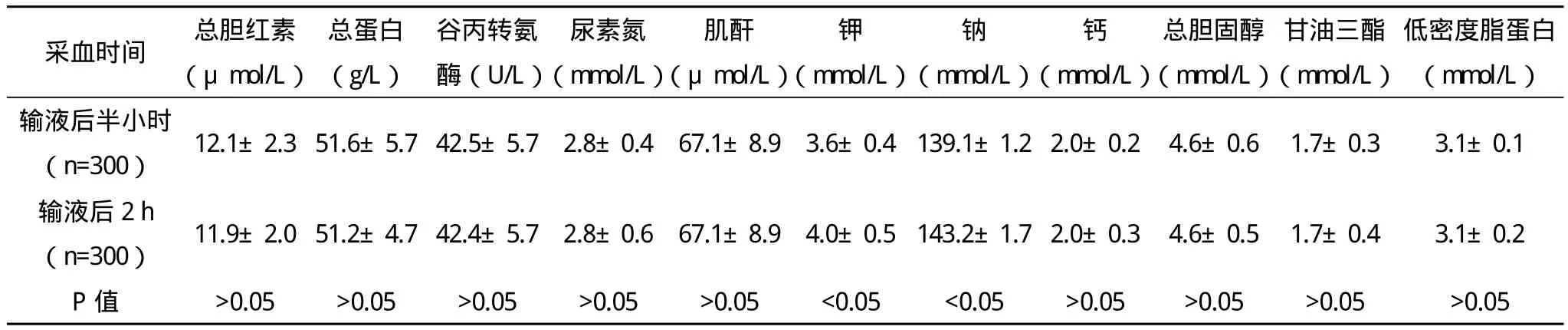
表2 输液后采血时间对生化检验结果的影响(x-±s)
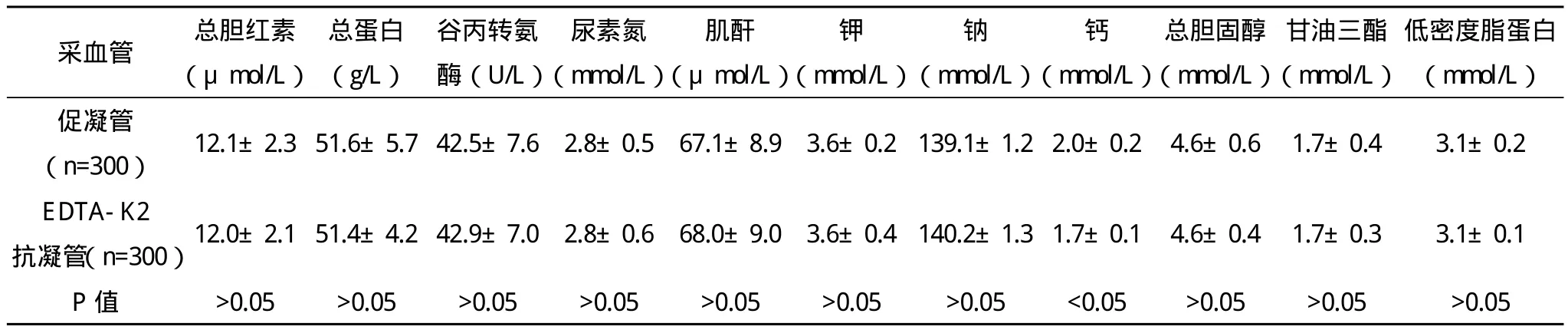
表3 采用EDTA-K2抗凝管对生化检验结果的影响(x-±s)
3 讨论
血液生化检验是临床开展最普遍的检验项目。血液生化检验结果的准确性与住院患者的生理因素、病理性因素、用药因素、环境变化等有关,同时也受血液标本采集方法的影响[2]。ICU患者内环境波动大,血液生化检验结果往往间接诊断或判断病情,血液生化检验的准确性关系重大。同时,ICU患者病情危重,血压较正常偏低或外周血管条件较差,采血困难,往往采用挤压取血的方法留取标本,从而导致溶血发生;或因治疗需要,ICU患者静脉输液时间较长,均能影响血液生化检验的准确性。目前认为,血液生化检验的全过程均会影响检验结果的准确性,包括采血、保存、预处理、送检、检验、数据处理、形成报告等,其中采血是最重要的环节。采集方法会影响血液的生化检验结果,主要是采血部位和采血时间[3-4]。血液生化检验的经典检测样本为血清,临床上多采用促凝管留取。临床生化检验过程中,经常遇到血液生化标本太少或者存在轻度溶血的情况;ICU住院患者重新采血较为困难。本研究尝试采用EDTA-K2抗凝管留取血液标本,经离心后取血浆替代血清标本进行血液生化检验。本研究设计不同采血部位、不同采血时间以及不同血液留取方法,并限定其他影响因素,以对比采集方法对生化检验结果的影响。
本研究输注液体为0.9%氯化钠溶液,100 mL/h,钾浓度为0.3%,保证外源性钾离子和钠离子摄入均一。本研究结果显示,输注同侧总胆红素、总蛋白、尿素氮、肌酐、总胆固醇、甘油三酯均显著低于输液另侧,比较差异有统计学意义(P<0.05),两侧谷丙转氨酶、钾浓度、钠浓度、钙浓度、低密度脂蛋白比较差异均无统计学意义(P>0.05)。采血部位影响生化检验结果的原因主要为输液后血液稀释或病灶影响一定区域内血液的成分[6-7]。因此,若无特殊,应避免输液过程中在输液同侧留取血液标本。另外,本研究结果显示,输液后2 h钾、钠浓度均显著高于输液后半小时检验结果,比较差异有统计学意义(P<0.05),输液后半小时和输液后2 h总胆红素、总蛋白、谷丙转氨酶、尿素氮、肌酐、钙浓度、总胆固醇、甘油三酯、低密度脂蛋白比较差异均无统计学意义(P>0.05),提示采血时间主要影响电解质,尤其是输注液体所含电解质。
生化检验可以采用血清、血浆或全血,三者之间有一定的差异:血清不含有纤维蛋白原和凝血因子,也不含有参与凝血过程的其他蛋白,却较多地含有在血凝过程中血小板完成凝血后分解出的某些物质;血浆含有纤维蛋白原与凝血因子;全血含有完整的细胞和细胞外成分。使用促凝管留取血清进行临床生化检验是最常用的方法[8]。有研究证实,采用血浆作为检验源,其检验成效优于全血,并具有易储存、便于集中检验的优点[9]。EDTA-K2抗凝原理是EDTA-K2中的EDTA成分可与Ca2+形成配位化合物,而Ca2+是内、外凝血途经的必需因子,所以血液不能凝固,从而起到抗凝作用。关于EDTA-K2抗凝是否影响生化检验结果,目前有争议,可能与受检者疾病分布、性别、年龄不同有关[10-16]。EDTA-K2抗凝对生化结果影响最大的是钙离子和钾离子。研究显示,采用EDTA-K2抗凝可导致血浆钾离子浓度大幅度增加[17]。本研究中,采用EDTA-K2抗凝管钙浓度显著低于采用促凝管检验结果,与文献[18]报道一致,提示除钙浓度外,EDTA-K2抗凝不影响其他临床生化检验结果。结合本研究结果,除钙浓度外,不需建立抗凝血浆结果参考值或进行校正[15]。
鉴于血液生化检验结果准确性对ICU住院患者疾病诊断和病情评估的重要性,有必要重视血液标本采集对生化检验结果的影响。如无特殊,应于输液另侧采血;生化检验标本至少应在输液半小时后留取;血液生化检验可常规采用EDTA-K2抗凝管留取标本,采用EDTA-K2抗凝管检测钙离子浓度时应考虑抗凝剂的影响。
[1]孙立明,魏国萍,阎晓芳,等.血液标本采集对检验结果的影响[J].疾病监测与控制,2011,5(7):445-446.
[2]刘燕.血液标本采集对生化检验结果的影响分析[J].中国中医药现代远程教育,2011,9(22):142-143.
[3]朱华山.血液生化分析前影响因素分析及对策[J].中国当代医药,2011,18(32):157-158.
[4] Bulut S.NewsCAP:Charges for 10 common blood tests at 189 California hospitals vary widely[J].Am J Nurs,2014,114(11):18.
[5]赵兴.血液生化检验的临床调查研究[J].中国卫生标准管理,2015,6(2):29-30.
[6]沈爱永.检验科血液生化检验的临床调查分析[J].当代医学,2014,11(20):83.
[7]郑剑.血液标本采集对生化检验结果的影响探讨[J].中外医疗,2011,22(2):6-9.
[8]闫丽杰.临床血液标本的准备对检验结果的影响[J].中外健康文摘,2008,5(6):192-193.
[9]张丽.应警惕药物对临床检验结果的影响[J].中国药业,2007,16(3):44-45.
[10]任继欣.不同真空采血管对生化项目检测结果的影响[J].国际检验医学杂志,2012,33(19):2407-2409.
[11]陈迎春.EDTA-K2抗凝对生化检测项目结果的影响[J].交通医学,2010,24(3):315-316.
[12]黄金文.EDTA-K2血对一系列生化检验项目结果的干扰[J].国际检验医学杂志,2010,31(8):881-882.
[13]苏东,桂满元,王永娜,等.EDTA-K2抗凝血对生化检验结果的影响及校正方法分析[J].中国医学创新,2015,12(7):74-76.
[14]汪仙德,程金莲.EDTA-K2对血糖、血脂和肾功能检测的影响[J].实验与检验医学,2013,31(1):82-83.
[15]李娟,王潮,王静.血清与EDTA-K2抗凝血浆测定低密度脂蛋白胆固醇(LDL-C)的对比分析[J].中国实用医药,2011,6(11):147-148.
[16]姚维菊.不同血液样本在常规生化项目检测中的结果比较[J].检验医学与临床,2013,10(4):468-469.
[17]熊红卫.Sysmex F-820血细胞分析使用中的诸多问题及应对措施[J].现代检验医学杂志,2004,19(4):11.
[18]吴连杰,任继欣,李雪梅,等.探讨多种抗凝血浆对急诊生化离子指标的影响[J].国际检验医学杂志,2013,34(13):1739-1740.
