碱性成纤维生长因子对牙龈间充质干细胞生物学性能的影响
2015-05-05曾素娟葛立宏
方 颖, 曾素娟, 余 湜, 葛立宏
(1. 广州医科大学附属口腔医院·广州口腔疾病研究所·口腔医学重点实验室, 广东 广州 510140;2. 北京大学口腔医院,北京 100081)
·基础研究·
碱性成纤维生长因子对牙龈间充质干细胞生物学性能的影响
方 颖1, 曾素娟1, 余 湜2, 葛立宏2
(1. 广州医科大学附属口腔医院·广州口腔疾病研究所·口腔医学重点实验室, 广东 广州 510140;2. 北京大学口腔医院,北京 100081)
目的: 体外研究碱性成纤维生长因子(bFGF)对牙龈间充质干细胞(GMSCs)生物学特性的影响。方法:酶消化法获得原代人牙龈间充质干细胞(hGMSCs),并采用有限稀释法进行克隆纯化培养。取第3代hGMSCs,观察5~20 ng/mL不同浓度bFGF对hGMSCs增殖的影响;观察10 ng/mL bFGF对hGMSCs克隆形成能力和ALP活性的影响;通过茜素红染色、油红0染色,观察10 ng/mL bFGF对hGMSCs体外成骨、成脂分化能力的影响,并RT-PCR检测各成骨、成脂分化相关基因的表达水平;同时采用流式细胞术检测10 ng/mL bFGF对hGMSCs表面标志物STRO- 1表达的影响。结果:10 ng/mL的bFGF对hGMSCs的增殖、干细胞表面标志物STRO- 1的表达、hGMSCs克隆形成率、脂滴形成量以及LPL、PPARγ各成脂基因的表达水平均有明显的促进作用(P<0.05);但对hGMSCs的ALP活性,及其成骨分化过程中矿化结节的形成量、各成骨相关基因(ALP、OCN、BSP)的表达水平均有明显的抑制作用(P<0.05)。结论:在一定的培养条件下,bFGF可增加hGMSCs的干细胞表面标志物的表达、促进hGMSCs的增殖能力;并对hGMSCs的多向分化能力起调节作用。
碱性成纤维生长因子(bFGF); 牙龈间充质干细胞; 细胞多向分化; 细胞增殖
[Chinese Journal of Conservative Dentistry,2015,25(11): 639]
Zhang等[1](2009)从牙龈组织来源的细胞中分离得到了干细胞,并开始使用牙龈间充质干细胞(gingiva-derived mesenchymal stem cells, GMSCs)这个概念。GMSCs具有自我更新能力,并可在体外向成骨、成脂及成软骨方向分化。有研究证实,GMSCs可促进大鼠下颌骨缺损和颅骨缺损的骨组织再生[2]。除此之外,GMSCs还具有显著的免疫调节功能和抗炎作用[1,3]。GMSCs易于分离,来源广泛,且具有同质性,其增殖速度比骨髓间充质干细胞迅速。Tomar等[4]报道,GMSCs经多次传代后,仍能保持正常的染色体核型和端粒酶活性,且无致瘤性,在再生医学领域及全身系统性疾病的治疗方面均有广阔的应用前景。
碱性成纤维细胞生长因子( basic fibroblast growth factor,bFGF) 属于肝素结合生长因子家族,是一种含有155个氨基酸的促有丝分裂的阳离子多肽,并在人体内广泛分布。有研究认为,bFGF在牙齿形态发生和组织发生中均起着重要的作用,并能有效地促进牙根的发育和牙周组织的形成[5-6]。
鉴于bFGF对hGMSCs的影响目前尚未见相关研究报道,本实验旨在观察不同浓度bFGF对GMSCs的生长增殖能力、克隆形成能力、干细胞表面标志物以及干细胞多向分化能力的影响。
1 材料和方法
1.1 主要实验材料和设备
Alpha MEM培养基(Gibco,美国);链霉素、青霉素、Ⅰ型胶原酶、Dispase酶、油红O(sigma,美国);FBS(Hyclone,美国);胰蛋白酶、L-谷氨酰胺、DMSO、CCK8、碱性磷酸酶(ALP)试剂盒(同仁,日本);地塞米松、β-磷酸甘油钠、抗坏血酸钠、茜素红、多聚甲醛、IBMX 、胰岛素、吲哚美辛、庆大霉素、抗STRO- 1抗体(BD,美国);人bFGF(PeproTech,美国);Trizol、Superscript Ⅲ逆转录试剂盒(Invitrogen,美国);DEPC(北京鼎国生物技术有限公司);氯仿、异丙醇、乙醇(北京化学试剂公司);超净工作台、恒温孵箱、酶标仪(BioTek,ELX808)、倒置显微镜(Leica,德国);流式细胞仪、GeneAmp PCR System、 RT-PCR仪(Biorad,美国)。
1.2 hGMSCs的分离培养和纯化
1.2.1 hGMSCs的分离培养
收集临床上行冠延长术时切取的人健康牙龈组织,用眼科剪剪去其上皮组织,并用含有双抗(链霉素-青霉素)的D-hanks液冲洗3次后,再将其置于加有3 mg/mLⅠ型胶原酶和4 mg/mL Dispase酶各1 mL的培养皿中,并用无菌小弯剪充分剪碎;然后将组织块连同酶消化液一并转移至15 mL的离心管中,并置于37 ℃条件下震荡消化45 min。加入等体积MEM培养基终止消化后,1 200 r/min 离心5 min,去上清;沉淀部分用1 mL含100 mL/L胎牛血清(FBS)的Alpha MEM重悬后,接种于直径60 mm的培养皿中,并置于37 ℃、50 mL/L CO2孵箱中进行培养。每隔2~3 d换1次培养液,待细胞生长汇合后,胰蛋白酶消化收集细胞,并进行传代培养。
1.2.2 hGMSCs的纯化
采用有限稀释法对hGMSCs进行克隆筛选。取第1代牙龈间充质细胞,用MEM制成密度为2~3/mL 的单细胞悬液后接种于96孔板(显微镜观察孔内不多于1个细胞),常规条件下进行培养。待细胞克隆形成明显,并覆盖孔底1/2时,将细胞转种于24孔板进行扩大培养;待细胞生长至汇合后,再将其逐渐移至6孔板中扩增培养以便用于后续研究。
1.3 CCK8法检测bFGF对hGMSCs增殖能力的影响
取P3代hGMSCs以5×103/孔的密度接种于96孔板,置于37 ℃、50 mL/L CO2孵箱中培养24 h后,弃原培养液,并将细胞随机分为6组(5个实验组和1个对照组,每组复6孔);5个实验组分别加入含bFGF终浓度为0.5、1、5、10、20 ng/mL的MEM培养液,对照组加入不含bFGF的MEM培养液继续培养。分别于培养1、3、5、7、9 d各时间点取各组细胞,避光条件下于每孔中各加入10 μL CCK8继续孵育3 h后,用酶标仪测定各孔450 nm波长处的光密度值(OD),实验重复3次。然后以共同培养天数为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.4 bFGF对hGMSCs克隆形成能力影响的观察
取生长良好的P3代hGMSCs, 以1×103的密度接种于9 cm的培养皿中,常规培养24 h后弃原液,并将细胞随机分为2组(每组5个培养皿);实验组加入含bFGF终浓度为10 ng/mL的MEM培养液,对照组加入不含bFGF的MEM正常培养液继续培养14 d。培养结束后弃去培养液,用PBS浸洗2次后加入40 g/L多聚甲醛液固定15 min;弃去固定液,加入适量甲苯胺蓝染色15 min;PBS浸洗2次,镜下观察各组细胞克隆形成情况,并进行克隆计数(以不少于50个细胞的集落计为1个克隆);然后按以下公式分别计算两组hGMSCs的克隆形成率。

1.5 流式细胞术检测bFGF对hGMSCs表达STRO-1的影响
取P3代生长良好的hGMSCs随机分两组,分别用含10 ng/mL bFGF的MEM培养液(实验组)和不含bFGF的MEM培养液(对照组)培养4 d后,用流式细胞仪检测其干细胞表面标志物STRO- 1的表达。
1.6 bFGF对hGMSCs ALP活性影响的观察
取P3代hGMSCs以5×104/孔的密度接种于6孔板,常规培养24 h后弃原培养液,并将细胞随机分为两组;实验组为加入含10 ng/mL bFGF的成骨分化诱导液(含50 mg/L抗坏血酸、10 mmol/L地塞米松、10 mmol/L β-甘油酸钠的MEM),对照组加入不含bFGF的成骨分化诱导液继续培养。分别于诱导培养后3、5、7 d各时间点取各组细胞,按ALP活性试剂盒说明检测其ALP活性(总蛋白质浓度作为内参)。
1.7 bFGF对hGMSCs多向分化能力影响的观察
1.7.1 bFGF对hGMSCs成骨分化能力影响的观察
1.7.1.1 成骨诱导培养
取P3代hGMSCs以5×104/孔的密度接种于6孔板,常规培养至细胞生长达80%汇合时,弃原培养液,并将细胞随机分为两组;实验组加入含有10 ng/mL bFGF的成骨诱导液(具体成分同1.6),对照组加入不含bFGF的成骨诱导液继续培养。每3 d换液1次,连续培养3周后分别进行以下检测。
1.7.1.2 茜素红染色观察矿化结节形成情况
取成骨诱导培养3周的各组细胞,经茜素红染色后,倒置显微镜下观察其矿化结节形成情况并拍照。
1.7.1.3 RT-PCR检测各成骨相关基因的表达
取成骨诱导培养3周的各组细胞,用Trizol试剂盒提取细胞总RNA,并用superscript Ⅲ逆转录酶将其合成cDNA。然后以cDNA为模板,GAPDH为内参照,进行PCR反应,分别检测各组细胞中ALP、骨钙素(Osteocalcin,OCN)、骨涎蛋白(Bone Sialoprotein,BSP)各成骨相关基因的表达水平。PCR反应体系及反应条件均严格按照产品说明书,所用引物由上海生工合成,具体引物序列见表1。
1.7.2 bFGF对hGMSCs成脂分化能力影响的观察
1.7.2.1 成脂诱导培养
取P3代hGMSCs以5×104/孔的密度接种于6孔板,常规培养至细胞生长达80%汇合时,弃原培养液,并将细胞随机分为两组;实验组加入含10 ng/mL bFGF的成脂诱导液(Alpha MEM培养基、100 mL/L FBS、0.5 mmol/L IBMX、1 μmol/L DEXO、10 μmol/L重组人胰岛素、120 μmol/L吲哚美辛、50 μg/L庆大霉素),对照组加入不含bFGF的成脂诱导液继续培养。每3 d换液1次,连续培养4周后分别进行以下检测。
1.7.2.2 油红O染色观察脂滴形成情况
取成脂诱导培养3周的各组细胞,经油红O染色后,倒置显微镜下观察其脂滴形成情况并拍照。
1.7.2.3 RT-PCR检测各成脂相关基因的表达
取成骨诱导培养3周的各组细胞,按1.7.1.3 同样的方法提取细胞总RNA,并逆转录合成cDNA。然后以cDNA为模板,以GAPDH为内参照,进行PCR反应,分别检测各组细胞中LPL(Lipoprotein lipase)、PPARγ(Peroxisome proliferator-activated receptor gamma)各成脂相关基因的表达水平,PCR反应体系及反应条件均严格按照产品说明书,所用引物序列见表1。

表1 PCR引物序列
1.8 统计学分析
2 结果
2.1 hGMSCs的分离培养结果
酶消化法获得的hGMSCs呈典型的成纤维细胞状态,并具有克隆形成能力(图1a);传代后大多数细胞呈长梭形或短梭形,生长快慢不等,传至5~6 代时其形态均无明显改变,具有成体干细胞的特征(图1b)。


图1 原代及传代培养的hGMSCs(×4)
2.2 不同浓度bFGF对hGMSCs增殖能力的影响
CCK8检测结果显示,5~20 ng/mL 不同浓度的bFGF与hGMSCs共同培养1~9 d后,各浓度组在3、5、7、9 d各时间点的细胞增殖能力(OD值)均明显高于对照组(P<0.05),bFGF浓度为10 ng/mL组的细胞增殖能力最强,与其他各浓度组相比,各时间点均有统计学差异(P<0.05)(图2)。
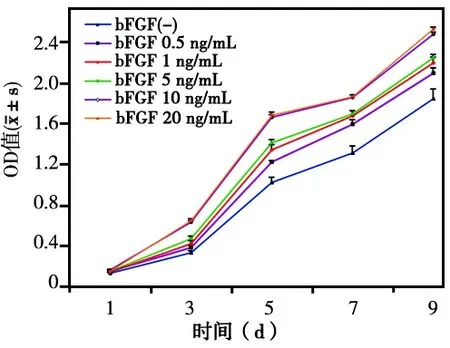
图2 不同浓度bFGF对hGMSCs增殖能力的影响
2.3 bFGF对hGMSCs克隆形成能力的影响
单克隆挑选培养14 d 后,对照组的平均克隆形成率为0.28%(28个集落/103个细胞),实验组的平均克隆形成率为0.41%(41个集落/103个细胞),两组间差异有统计学意义(P<0.05) 。
2.4 bFGF对hGMSCs表面标志物STRO-1表达的影响
STRO-1是经典的hGMSCs表面标志物。本实验中流式细胞仪检测结果显示,用含有10 ng/mL bFGF的培养液培养的hGMSCs中,STRO-1的表达率为19.8%,而不含bFGF培养液培养的hGMSCs(对照组)中,STRO-1的表达率为10.4%,两者有统计学差异(P<0.05)(图3)。
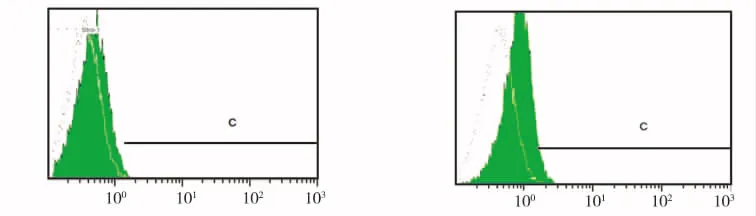
bFGF(-) bFGF(+)
图3 bFGF对hGMSCs表达STRO-1的影响
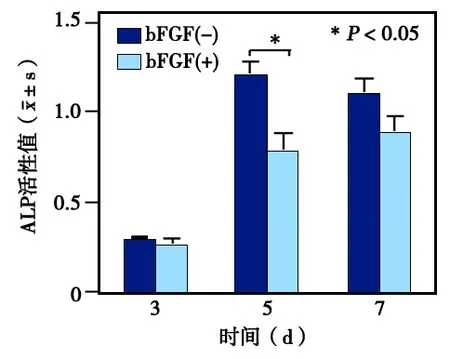
图4 10 ng/mL bFGF对hGMSCs成骨分化过程中ALP活性的影响
2.5 bFGF对hGMSCs成骨分化过程中ALP活性的影响
用含有10 ng/mL bFGF的成骨诱导液对hGMSCs进行诱导培养3、5、7 d后,ALP活性检测结果显示:实验组各时间点的ALP活性均较对照组有所降低,其中以第5天时的降低程度最明显,差异有统计学意义(P<0.05)(图4)。
2.6 bFGF对hGMSCs成骨分化能力的影响
用含有10 ng/mL bFGF的成骨诱导液对hGMSCs进行诱导培养3周后,茜素红染色结果显示,实验组细胞的矿化结节形成量低于对照组(图5);RT-PCR检测结果显示,实验组中ALP、ONC、BSP各成骨相关基因的表达水平均低于对照组,差异有统计学意义(P<0.05)(图6)。以上结果提示,10 ng/mL bFGF对hGMSCs的成骨分化具有抑制作用。
2.7 bFGF对hGMSCs成脂分化能力的影响
用含有10 ng/mL bFGF的成脂诱导液对hGMSCs进行诱导培养4周后,油红O染色结果显示,实验组细胞中的脂滴形成面积明显大于对照组(图7);RT-PCR检测结果显示,实验组中LPL、PPARγ各成脂相关基因的表达水平均高于对照组,差异有统计学意义(P<0.05)(图8)。
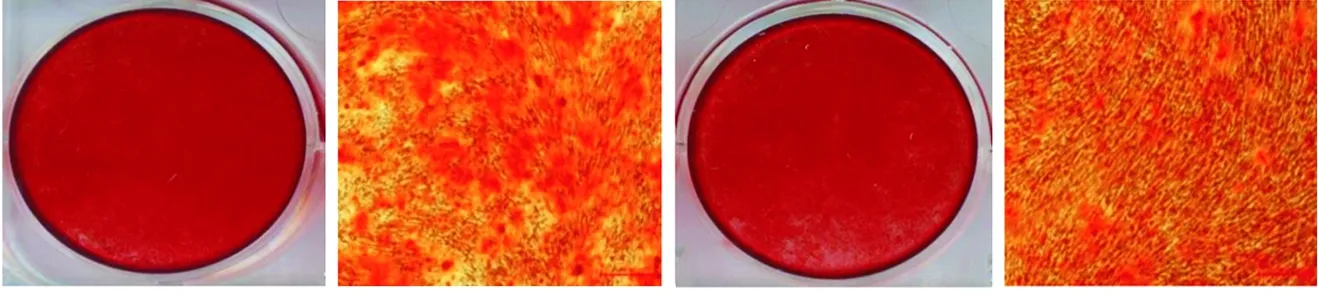
对照组 实验组
图5 bFGF对hGMSCs成骨分化的影响(茜素红染色,×4)

图6 bFGF对hGMSCs成骨相关基因表达的影响(相同字母P<0.05)

对照组 实验组
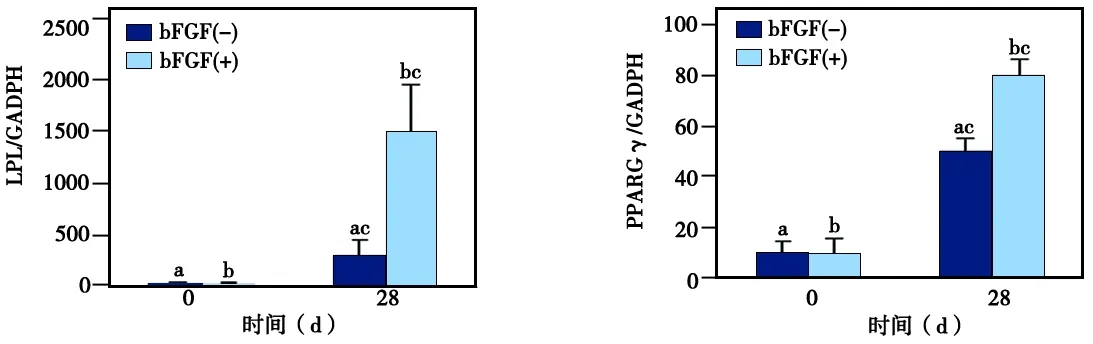
图8 bFGF对hGMSCs成脂分化过程中成脂相关基因表达的影响(相同字母P<0.05)
3 讨论
GMSCs不仅具有自我更新和多向分化的能力,同时还在免疫调节及抗炎方面起着重要的作用[1-3]。GMSCs自首次分离以来,因其来源广泛,取材方便,在再生医学领域有着广阔的应用前景,并已成为干细胞新的研究热点。而对于bFGF的研究则开始的更早,且研究的更深[7]。在再生医学研究中,如何选择合适的干细胞和生长因子,并确保后者能对前者产生最佳的调控效果,一直是学者们关注的焦点。
本实验主要研究bFGF对GMSCs生物特性的影响,从实验结果可以看出,bFGF不仅能促进GMSCs的增殖,并促进其干细胞表面标志物STRO-1的表达,同时还对GMSCs的成脂分化具有增强作用。然而,在GMSCs成骨分化的早期,bFGF则对其碱性磷酸酶的活性、成骨相关基因的表达、矿化结节的形成等均具有抑制作用。由此可以认为,bFGF可以增强GMSCs的干性,即在体外不仅能增强GMSCs的自我更新能力,同时还对细胞的分化能力具有调节作用。
其他相关研究也表明,bFGF与牙髓干细胞、脂肪干细胞、人根尖牙乳头细胞共同培养后,可降低其成骨分化过程中的矿化结节的形成量,并抑制其成骨相关基因的表达水平[8-9]。本结果与上述结论基本一致,并进一步证实了bFGF在细胞分化的不同阶段均具有一定的调节作用。
除此之外,bFGF作为分裂源和化学引诱物,在脂肪干细胞和骨髓间充质干细胞的多向分化过程中,还能促进血管生成、细胞迁移及其成脂分化[10-12]。Vashi等[12]研究发现,低温保存的人脂肪干细胞与10 ng/mL bFGF和EGF共同培养时,其细胞的增殖能力增加了3倍;在该细胞的扩大培养过程中加入上述两种因子并进行成脂诱导后,油红O染色显示,其脂滴形成的面积显著增大。本实验单独研究了bFGF对GMSCs成脂分化的作用,实验结果表明,bFGF能促进牙龈间充质的成脂分化,而且这种是改变是基因水平的。进一步证实了bFGF对GMSCs的分化具有调控作用。
综上所述,bFGF 作为一种重要的细胞因子,其对细胞的作用是广泛而复杂的。本研究只是从一个侧面来研究了bFGF对GMSCs的影响,并发现bFGF对GMSCs的影响是在基因水平上的,而且在传代后依然存在。在今后的实验中还将从蛋白水平以及体内实验等方面进行更加深入细致的研究,以期更好的掌握bFGF对GMSCs细胞分化的调控作用,并建立具有科研和临床意义的细胞系。
[1]Zhang Q, Shi S, Liu Y,etal.Mesenchymal stem cells derived from human gingiva are capable of immunomodulatory functions and ameliorate inflammation-related tissue destruction in experimental colitis [J].JImmunol, 2009,183(12):7787-7798.
[2]Wang F, Yu M, Yan X,etal. Gingiva-derived mesenchymal stem cell-mediated therapeutic approach for bone tissue regeneration[J].StemcellsDev, 2011,20(12): 2093-2102.
[3]Zhang QZ, Su WR, Shi SH,etal. Human gingiva-derived mesenchymal stem cells elicit polarization of M2 macrophages and enhance cutaneous wound healing[J].StemCells, 2010,28(10):1856-1868.
[4]Tomar GB, Srivastava RK, Gupta N,etal. Human gingiva-derived mesenchymal stem cells are superior to bone marrow-derived mesenchymal stem cells for cell therapy in regenerative medicine[J].BiochemBiophysResCommun, 2010,393(3):377-383.
[5]Ota MS, Nakatomi M, Iseki S,etal. Sonic hedgehog and FGF signalingare important for tooth root development[J].EurCellMater, 2007,14(Suppl):45.
[6]Amit M, Carpenter MK, Inokuma MS,etal. Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture[J].DevBiol, 2000,227(2):271-278.
[7]Osathanon T, Nowwarote N, Pavasant P. Basic fibroblast growth factor inhibits mineralization but induces neuronal differentiation by human dental pulp stem cells through a FGFR and PLCγ signaling pathway[J].JCellBiochem, 2011,112(7):1807-1816.
[8]Shimabukuro Y, Ueda M, Ozasa M,etal. Fibroblast growth factor- 2 regulates thecell function of human dental pulp cells[J].Endod, 2009,35(11):1529-1535.
[9]Shiba H, Nakamura S, Shirakawa M,etal. Effects of basic fibroblast growth factoron proliferation, the expression of osteonectin (SPARC) and alkaline phosphatase,and calcification in cultures of human pulp cells[J].DevBiol,1995,170(2):457-466.
[10]Locklin RM, Oreffo RO, Triffitt JT. Effects of TGFβandbFGF on the differentiation of human bonemarrow stromal fibroblasts[J].CellBiolInt,1999,23(3):185-194.
[11]Schmidt A, Ladage D, Schinkothe T,etal. Basic fibroblast growth factor controls migration in humanmesenchymal stem cells[J].StemCells, 2006,24(7):1750-1758.
[12]Vashi AV, Abberton KM, Thomas GP,etal. Adipose tissue engineering based on the controlled releaseof fibroblast growth factor-2 in a collagen matrix[J].TissueEng, 2006,12(11):3035-3043.
Effects of basic fibroblast growth factor on the biological charactor of gingiva- derived mesenchymal stem cells
FANG Ying*, ZENG Su- juan, YU Shi, GE Li- hong
(*KeyLaboratoryofOralMedicine,GuangzhouInstituteofOralDisease,StomatologyHospitalofGuangzhouMedicalUniversity,Guangzhou510140,China)
AIM: To investigate the effects of basic fibroblast growth factor (bFGF) on the biological charactor of gingiva-derived mesenchymal stem cells (GMSCs) in vitro. METHODS: GMSCs were isolated from human healthy gingival tissue samples. Proliferation, colony formation, alkaline phosphatase (ALP) activity, STRO- 1 expression, osteogenic and adipogenic differentiation of GMSCs cultured in the presence or absence of bFGF, were evaluated. RESULTS:Treatment with 10 ng/mL bFGF significantly increased the proliferation and STRO- 1 expression of GMSCs. bFGF also increased oil red O staining following adipogenic induction and the expression of PPARγ and LPL of GMSCs. In contrast, it reduced the ALP activity and mineral nodule formation; inhibited the gene expression of ALP, OCN and BSP of GMSCs. CONCLUSION: Under certain conditions, bFGF enhances GMSCs stemness by up-regulating stem cell gene expression, increasing proliferation ability, and may regulate the differentiation potency of GMSCs.
basic fibroblast growth factor(bFGF); gingiva-derived mesenchymal stem cells(GMSCs); cell differentiation; cell proliferation
2015-08-18
国家自然科学基金面上项目(81170928)
方 颖(1989-),女,汉族,湖北黄冈人。硕士生(导师: 葛立宏)
葛立宏, E-mail: gelh0919@126.com; 曾素娟, E-mail: 13922265473@163.com
R780.2
A
1005-2593(2015)11-0639-06
10.15956/j.cnki.chin.j.conserv.dent.2015.11.001
