甘草不同功能基因拷贝数多态性组合类型与叶片形态及甘草酸含量的相关性分析
2015-05-04王礼强杨瑞袁伯川刘春生刘颖
王礼强,杨瑞,袁伯川,刘春生,刘颖
北京中医药大学 中药学院,北京 100102
甘草是我国最常用的大宗药材之一,具有补脾 益气、清热解毒、祛痰止咳、缓急止痛和调和诸药等作用[1]。甘草中最主要的活性成分甘草酸通过甲羟戊酸(mevalonic acid,MVA)途径合成[2],此途径受为数众多的关键酶的调节,其中3-羟基-3-甲基戊二酰CoA还原酶(3-hydroxy-3-methylglutaryl-CoA re⁃ductase,HMGR)是该途径的第一个限速酶[3]。鲨稀合成酶1(squalene synthetase 1,SQS1)是碳源流向三萜的关键酶,当其正向调节时,可促进三萜类化合物的合成[4-5]。β-香树酯醇合成酶(beta-amyrin syn⁃thase,β-AS)是控制形成甘草酸类化合物(齐墩果烷型)或白桦酯酸类化合物(羽扇豆烷型)的分支点,是甘草酸生物合成的关键酶[6]。近年来次生代谢途径上关键酶对应的功能基因已逐渐成为药用植物研究领域的热点,功能基因的多态性对于调控产物的合成具有显著影响。对于甘草来说,以上3个MVA代谢途径关键酶对应的功能基因则有可能是导致其甘草酸含量差异的分子基础。
功能基因的多态性既包括结构变异,也包括数量变异。其中,拷贝数多态性(copy number varia⁃tions,CNV)是指与基因组参考序列相比,基因组中大于1 kb的DNA片段缺失、插入、重复或扩增及其互相组合衍生出的复杂变异[7]。基因剂量的改变会引起相应的酶含量的改变,进而影响次生代谢产物的含量,因此功能基因的CNV往往与次生代谢产物含量之间具有密切的相关性。本课题组在前期研究中也发现,不同甘草植株中功能基因HMGR、SQS1及β-AS的确存在拷贝数上的变化[8-9],而这些变化是否会影响次生代谢产物甘草酸的合成,还有待进一步探讨。基因的多态性除了会影响次生代谢产物的含量,还有可能引起植物表观特征的改变[10],因此功能基因的不同CNV也有可能对应不同的表观性状特征。基于以上原因,我们从甘草酸代谢途径的HMGR、SQS1和β-AS基因入手,研究这3个功能基因CNV与甘草酸含量及甘草叶片形态特征的相关性,为高品质甘草的筛选奠定基础。
1 材料与方法
1.1 材料
将采自7个产地的甘草成熟种子栽培于北京中医药大学药草园,生长1年后经北京中医药大学刘春生教授鉴定为豆科植物甘草(Glycyrrhiza uralen⁃sis Fisch.),取其中60株作为本实验的样本(表1)。
SYBR GreenⅠ PCR Master Mix购于ABI公司;LA Taq DNA聚合酶购于TaKaRa公司;广谱植物基因组DNA快速提取试剂盒、DNA胶回收试剂盒和DL2000核酸分子质量标准购于北京博迈德科技发展有限公司;甘草酸铵(编号:110731)购自中国食品药品检定研究院;乙腈(CALEDON,色谱纯)、甲醇(分析纯)、乙醇(分析纯)、磷酸(分析纯)购于北京汇海科仪有限公司。

表1 本实验所用植物材料情况统计表
Thermo Cell恒温金属浴;SIGMA 3K-15低温高速离心机;JS-680B全自动凝胶成像分析仪(上海培清科技有限公司);TECHNE TC-3000 PCR扩增仪;Bio-Rad电泳仪;555牌游标卡尺(0~150 mm,分度值 0.02 mm,采用标准 GB/T12141-1996);Agilent 1100型高效液相色谱仪;Agilent 1100化学工作站;Agilent C18色谱柱(4.6 mm×250 mm,5 μm)。
1.2 甘草材料中功能基因拷贝数的测定
取甘草植物材料的嫩叶,按照广谱植物基因组DNA快速提取试剂盒说明书提取甘草总DNA。具体步骤见参考文献[11]。
选择Lectin基因为内标基因[8-9],根据光果甘草Lectin基因序列(GeBank:HQ337023.1,AJ234389.1),甘草HMGR序列(GQ845405.1,JF461267.1)、SQS1序列(HM012838.1,HM012837.1,GQ180932.1)及β-AS序列(FJ627179.1,GU072921.1)设计各基因对应引物(表2),由上海生工生物技术有限公司合成。
实时 PCR 扩增反应体系为 25 μL,含 12.5 μL 2×SYBR Green qPCR mix、1.0 μL 正 向 引 物(5 μmol/L)、1.0 μL反向引物(5 μmol/L)、4.0 μL模板和6.5 μL H2O。PCR扩增程序:95℃ 10 min,95℃15 s,60℃ 1 min,40个循环,4℃保存。
将含有HMGR、SQS1、β-AS、Lectin基因的质粒标准品稀释至1×10、1×102、1×103、1×104、1×105、1×106拷贝/μL,以标准品拷贝数的对数值为横坐标、测得的Ct值为纵坐标绘制标准曲线,得到标准曲线方程。以待测样品的DNA为模板,利用所建立的实时PCR方法,对甘草HMGR、SQS1、β-AS基因的Ct值进行测定。每个样品重复3次,将所得Ct值带入相应的标准曲线中进行换算,得到相对含量。通过HMGR、SQS1、β-AS与内标基因Lectin基因的比值得到相应的拷贝数。
1.3 甘草叶片形态特征分析
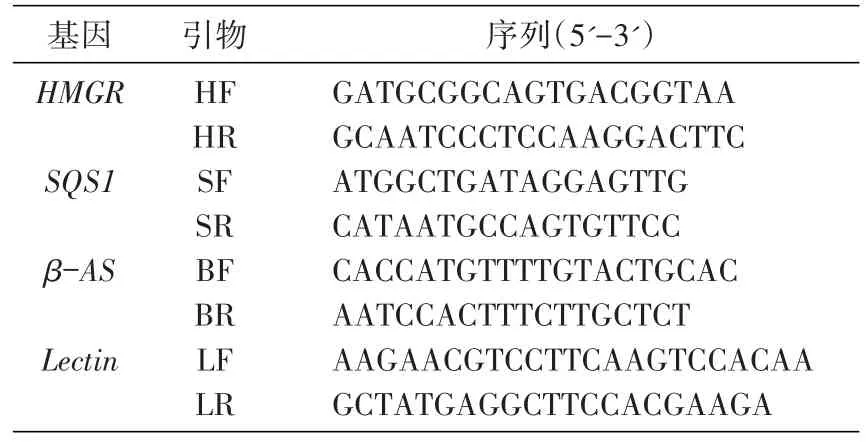
表2 实时PCR引物
根据以上3个基因拷贝数的测定结果,对60株甘草样品进行分类。对不同CNV组合类型甘草的叶片形态特征进行分析,用游标卡尺分别测量复叶长度、小叶长度和宽度、顶叶长度和宽度,并对各测量值进行统计学分析。各特征解释如下:①复叶长:植株中部一级侧枝中部二级侧枝中部复叶的长度;②小叶长、宽:植株中部一级侧枝中部二级侧枝中部复叶的中部小叶的长、宽;③顶叶长、宽:植株中部一级侧枝中部二级侧枝中部复叶的顶叶的长、宽。
1.4 甘草酸含量测定
参照2010版《中华人民共和国药典》[12]对样品中的甘草酸含量进行测定。
以乙腈为流动相A,以0.05%磷酸溶液为流动相B,按表3条件进行梯度洗脱。取甘草酸铵对照品适量,精密称定,加70%乙醇配制成0.2 mg/mL的溶液,作为对照品储备液。分别精密量取甘草酸铵储备液0.2、0.4、0.8、1.2、1.6、2.0、2.4 mL于7个5 mL容量瓶中,用70%乙醇定容到刻度,作为标准系列。进样10 μL,以峰面积为纵坐标、质量浓度(g/L)为横坐标进行线形回归,得到标准曲线。甘草酸含量=甘草酸铵含量/1.0207。
取样品粉末(过三号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇100 mL,密塞,称定重量,超声波处理(功率250 W,频率40 kHz)30 min,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。吸取各供试品溶液10 μL,注入液相色谱仪进行测定。

表3 HPLC梯度洗脱条件
2 结果
2.1 HMGR、SQS1、β-AS基因拷贝数的测定
利用实时PCR方法所建立的内标基因和待测基因标准曲线方程如下:

PCR测定60份甘草样品中的HMGR、SQS1、β-AS及Lectin基因,根据以上标准曲线计算各样品中3个功能基因的拷贝数,按照计算结果将60株甘草分为A、B、C、D、E、F共6种类型(表4)。
2.2 不同功能基因CNV组合类型甘草叶片形态特征分析
对6种CNV组合类型甘草叶片的形态特征进行分析,结果如表5和图1。
由图1A可知,A、B及F型的复叶长度较长,而C、D及E型的复叶长度较短。对各类型甘草复叶长度进行t检验,绝大多数组别在复叶长度方面具有显著性差异(P<0.05),只有C与E型间P值为0.960,无显著性差异。
由图1B可知,A与D型的小叶长度较短,其他类型小叶长度较长。对小叶长度进行t检验,大多数组间均存在显著性差异,特别是A、D型与其他所有组之间P值均小于0.05。由图1C可知,A与D型的小叶宽度较窄,而其他类型的小叶宽度较宽。对小叶宽度进行t检验,发现只有C与F型间不存在显著性差异,P值为0.660(>0.05),其余各组之间均存在显著性差异。综合以上对小叶长度及宽度的分析,我们发现A与D型在小叶长度和宽度方面数值均较小,小叶的整体面积均小于其他类型,而B与E型在小叶长度和宽度方面数值均较大,小叶的整体面积均大于其他类型。
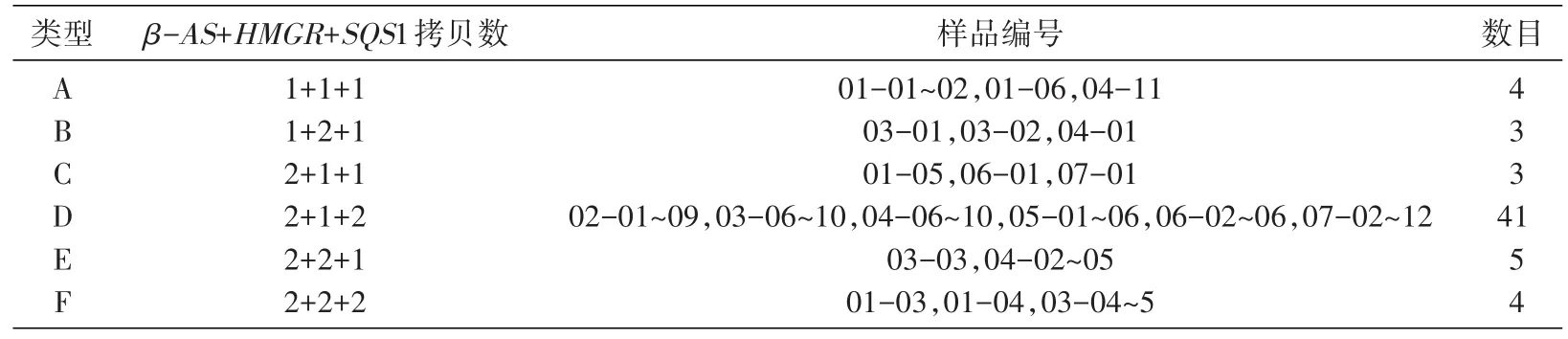
表4 60份甘草样品中HMGR、SQS1、β-AS基因拷贝数组合类型
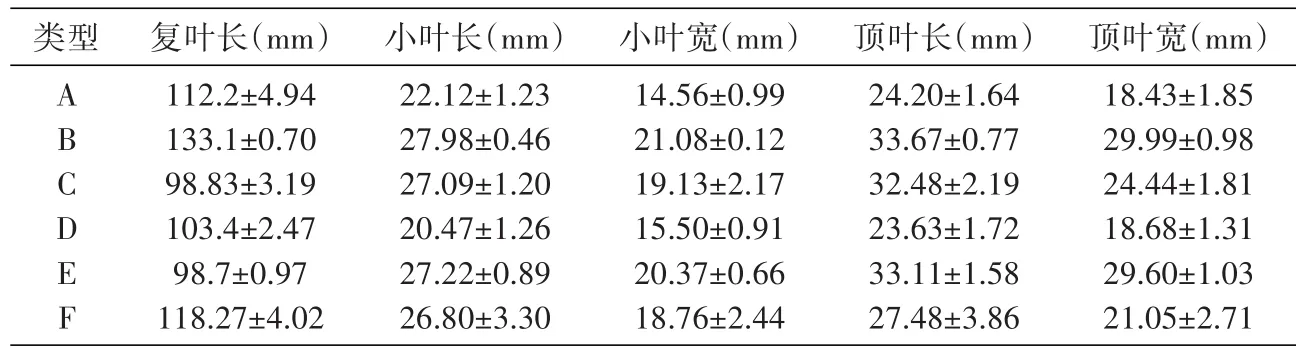
表5 不同功能基因CNV组合类型甘草叶片形态参数统计表(n=9)
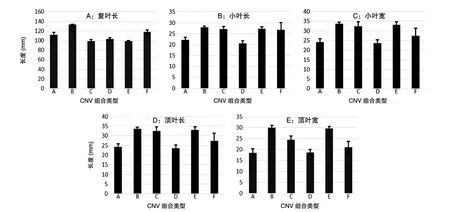
图1 6种CNV组合类型甘草叶片形态特征分析A:甘草复叶长度;B:甘草小叶长度;C:甘草小叶宽度;D:甘草顶叶长度;E:甘草顶叶宽度
由图1D可知,A与D型顶叶长度较短,而其他类型的顶叶长度均较长。t检验分析得A与D、A与F、B与C、B与E、C与E、D与F以及E与F型之间P值均大于等于0.05,不具有显著性差异,其余组间P值均小于0.05,具有显著性差异。由图1E可知,A与D型顶叶宽度较窄,而其他类型顶叶宽度均较宽。t检验可知,A与D(P=0.742)、B与E(P=0.656)、D与F(P=0.09)型间P>0.05,不存在显著性差异,其他组间P值均小于0.05,具有显著性差异。综合以上对顶叶长度及宽度的分析,我们发现A与D型在顶叶长度和宽度方面数值均较小,顶叶的整体面积均小于其他类型;而B与E型在顶叶长度和宽度方面数值均较大,顶叶的整体面积均大于其他类型。
2.3 甘草酸含量测定结果
将甘草酸的标准系列各进样10 μL,以峰面积为纵坐标、质量浓度(g/L)为横坐标进行线形回归,得到回归方程y=4969.2x-10.336(R2=0.9994)。
按照前述HPLC方法对60个甘草样品中的甘草酸进行含量测定,结果显示A~F功能基因CNV组合中,甘草酸平均含量依次为 1.78%±0.28%、3.33%±0.34%、1.89%±0.23%、1.35%±0.30%、2.14%±0.32%和2.04%±0.37%(图2)。B型的甘草酸含量明显高于其他类型,而D型的甘草酸含量则明显低于其他类型。对6组甘草样品中甘草酸含量进行两两比较的显著性差异分析结果表明,B型与其他类型之间均具有显著性差异,其P值均小于0.05,从而证明B型,即β-AS基因与SQS1基因单拷贝、HMGR基因2拷贝的功能基因拷贝数组合更有利于甘草酸的积累;D型与其他类型之间也均存在显著性差异,从而证明D型,即β-AS基因与SQS1基因2拷贝、HMGR基因单拷贝的功能基因拷贝数组合更不利于甘草酸的积累。B与D型在功能基因组合上是恰恰相反的2种类型,其甘草酸含量在6种类型中也分别为最高和最低,这也在一定程度上说明功能基因影响次生代谢产物的生物合成。
3 讨论

图2 6种CNV组合类型甘草的甘草酸平均含量
近年来临床上对天然药物的实际需求不断增加,而许多来源于植物的药物,如紫杉醇等,仍需要依赖生物来源,从而引发资源争夺以及生态环境被破坏。如何实现药用植物资源的可持续发展,在诸多解决方案中,生物技术被寄予厚望。植物在长期进化的过程中,由于自然突变的作用,遗传基因会发生不同程度的变异,形成基因多态性,其中功能基因的多态性对于调控产物的合成具有显著影响。就药材而言,其药用成分的含量高低是评价其质量的决定性因素,因此功能基因的多态性同样是导致其质量差异的分子基础。所以,近年来与药用活性成分生物合成关系密切的功能基因已成为药用植物研究领域的热点。
甘草是我国最常用的大宗药材,近年来由于过度采挖,导致野生甘草资源匮乏,栽培甘草已成为商品甘草的主流产品。但栽培甘草中甘草酸的含量普遍偏低,难以达到药典规定的甘草酸含量2.0%的标准。这已成为制约甘草可持续发展的瓶颈问题。对影响其次生代谢的功能基因开展研究,则有望筛选优良基因,从而提高甘草酸的合成与积累。同时,如果功能基因的改变能够在表观特征方面得以清晰的判断,则可以使得筛选范围缩小,更易于顺利进行。
我们从功能基因的拷贝数多态性入手,对来自7个产地的60株甘草进行了HMGR、SQS1、β-AS基因的拷贝数测定,并根据拷贝数测定结果将60株甘草划分成6种类型。对6种类型甘草样品的叶片形态特征进行分析,发现B型(β-AS+HMGR+SQS1=1+2+1)和E型(2+2+1)在所有的类型中叶片面积较大,而A型(1+1+1)和D型(2+1+2)的叶片面积则较小。HPLC分析结果显示6种类型中B型的甘草酸含量最高,平均值为3.33%;E型仅次于B型,其甘草酸含量平均值为2.14%;而A型和D型中甘草酸的含量则相对较低,特别是D型,其甘草酸平均含量最低,仅为1.35%。因此,β-AS基因与SQS1基因单拷贝、HMGR基因2拷贝的甘草植株,其叶片具有较大的面积,更有利于甘草酸的积累,而β-AS基因与SQS1基因2拷贝、HMGR基因单拷贝的甘草植株,其叶片具有较小的面积,更不利于甘草酸的积累。本研究的结果将为优质甘草的筛选奠定基础。
[1] 曾路,李胜华,楼之岑.国产甘草的生药形态组织学研究[J].药学学报,1988,23(3):200-208.
[2] Liu Y,Zhu X,Li W,et al.Enhancing production of ergoster⁃ol in Pichia pastoris GS115 by over-expression of 3-hydroxy-3-methylglutaryl CoA reductase from Glycyrrhiza uralensis[J].Acta Pharm Sin B,2014,4(2):161-166.
[3] Liu Y,Xu Q X,Xi P Y,et al.Cloning and characterization of a cDNA coding 3-hydroxy-3-methylglutary CoA reductase involved in glycyrrhizic acid biosynthesis in Glycyrrhiza ura⁃lensis[J].Acta Pharm Sin,2013,48(5):773-779.
[4] Seo J W,Jeong J H,Shin C G,et al Overexpression of squa⁃lene synthase in Eleutherococcus senticosus increases phytos⁃terol and triterpene accumulation[J].Phytochemistry,2005,66:869-877.
[5] Lu H Y,Liu J M,Zhang H C,et al.Ri-mediated transforma⁃tion of Glycyrrhiza uralensis with a squalene synthase gene(GuSQS1)forproduction ofglycyrrhizin[J].PlantMolBio Rep,2008,26:1-11.
[6] Hayashi H,Huang P,Kirakosyan A,et al.Cloning and char⁃acterization of a cDNA encoding beta-amyrin synthase in⁃volved in glycyrrhizin and soyasaponin biosyntheses in lico⁃rice[J].Biol Pharm Bull,2001,24:912-916.
[7] Cook E H Jr,Scherer S W.Copy-number variations associat⁃ed with neuropsychiatric conditions[J].Nature,2008,455(7215):919-923.
[8] 刘颖,刘东吉,刘春生,等.基于HMGR,SQS1,β-AS基因CNVs的甘草道地性机制研究[J].药学学报,2012,47(2):250-255.
[9] 刘颖,刘东吉,刘春生.甘草HMGR,SQS1,β-AS合酶基因CNVs检测体系的建立[J].中国中药杂志,2012,37(3):283-287.
[10]陈学军,程志芳,陈劲枫,等.辣椒种质遗传多样性的RAPD和ISSR及其表型数据分析[J].西北植物学报,2007,27(4):662-670.
[11]刘东吉.甘草HMGR,SQS,β-AS合酶基因CNVs与产地,形态的相关性研究[D].北京:北京中医药大学,2011:8-11.
[12]中华人民共和国药典(I部)[S].北京:化学工业出版社,2010:80-81.
