GFP-LC3B真核表达载体的构建及表达鉴定
2015-05-04朱杰丁丽华刘婕禾荣华张亚楠陈志达罗晓丽叶棋浓吕朝晖
朱杰,丁丽华,刘婕,禾荣华,张亚楠,陈志达,罗晓丽,叶棋浓,吕朝晖
1.解放军总医院 内分泌科,北京 100853;2.军事医学科学院 生物工程研究所,北京 100850
自噬(autophagy)是一种重要的细胞内分解代谢过程,在多种基本的生物过程如生长、衰老、死亡、防御疾病等方面起着关键的作用[1]。自噬过程始于拥有双层膜结构的自噬吞噬体的形成,自噬吞噬体成熟之后,与溶酶体结合形成自噬溶酶体[2],将胞质内的无关组分进行消化、再利用。通过这种方式,不仅可以清除损坏的细胞器及大分子物质,维持内环境的稳态[1,3],而且可以在营养物质缺乏的情况下重新动员营养物质。目前,许多研究发现,自噬在肿瘤的生长中扮演着重要的角色[4]。
自噬这一过程主要通过一组高度保守的自噬相关蛋白(ATG蛋白)来调控。哺乳动物细胞中存在同源ATG蛋白[5],如微管相关蛋白1轻链3(microtu⁃bule-associated protein 1 light chain 3,MAP1LC3/LC3),它作为自噬溶酶体上的标志蛋白,可以用来检测自噬的发生[6]。研究发现,人类LC3存在3种亚型[7],即LC3A、LC3B和LC3C,其中LC3B与自噬发生相关。自噬的发生是一个动态变化的过程,在活细胞中,此过程可以用融合蛋白GFP-LC3B来监测。正常情况下,LC3B在胞质中呈均匀分布,发生自噬后,在倒置荧光显微镜下可见自噬小体的形成[8]。
本研究中,我们通过构建人自噬相关基因LC3B的真核表达载体pEGFP-C1-LC3B,用荧光显微镜观察GFP-LC3B融合蛋白的变化,动态考察细胞的自噬过程,为进一步研究自噬在肿瘤中的作用及发生机制奠定了实验基础。
1 材料和方法
1.1 材料
ZR75-1人乳腺癌细胞、大肠杆菌DH5α感受态细胞由本室保存;DMEM培养基和胎牛血清购自杭州四季青生物公司;pEGFP-C1载体、PCR引物H91及H92由赛百胜公司合成;限制性内切酶EcoRⅠ、KpnⅠ,pfu酶,dNTP混合物,T4DNA连接酶及DNA marker购自Promega公司;转染试剂LipofectAMINE 2000和自噬诱导剂雷帕霉素均为Invitrogen公司产品;质粒提取试剂盒、胶回收试剂盒和PCR回收试剂盒均购自Promega公司;鼠抗GFP单克隆抗体购自Chemicon公司;GAPDH抗体购自Santa Cruz公司。
1.2 pEGFP-C1-LC3B真核表达载体的构建
以乳腺文库为模板,根据人LC3序列设计用于PCR扩增的上游引物(5'-CGGAATTCTATGCCGTC GGAGAAGACCTTC-3')和下游引物(5'-GGGGTAC CTTACACTGACAATTTCATCC-3'),用 pfu 酶 进 行PCR扩增(95℃变性1 min;95℃变性30 s,58℃复性30 s,72℃延伸30 s,重复29个循环;72℃延伸 5 min),扩增片段大小为383 bp;切下胶回收条带,将扩增产物与pEGFP-C1空载体于37℃用EcoRⅠ/KpnⅠ双酶切4 h,电泳切胶回收酶切产物;用T4DNA连接酶连接8 h,连接产物转化大肠杆菌DH5α感受态细胞;次日挑取平板上的单菌落于LB培养基中,37℃培养4 h,提取质粒,用PCR及EcoRⅠ/KpnⅠ双酶切鉴定;对鉴定为阳性的重组质粒再进行质粒序列测定,并用DNAMAN软件将测序结果与NCBI中所公布的LC3序列进行比对。
1.3 Western印迹鉴定
将ZR75-1细胞接种于6孔板中,待细胞融合至70%左右时用LipofectAMINE 2000转染重组质粒pEGFP-C1-LC3B及对照质粒pEGFP-C1,于培养箱中培养,4~6 h后更换为DMEM正常培养基,继续培养24 h,收集细胞,加入SDS加样缓冲液,煮沸15 min,离心后取15~20 mg上清蛋白进行SDS-PAGE,结束后转移至硝酸纤维素膜上,转膜后用5%脱脂奶粉于4℃封闭1 h,然后加入用5%脱脂奶粉稀释的GFP(1∶1000)抗体或GAPDH(1∶1000)抗体,室温轻摇1 h,TBST洗膜3次,每次7 min,加入用5%脱脂奶粉稀释的辣根过氧化物酶偶联的羊抗兔IgG,室温轻摇1 h,TBST洗膜3次,每次7 min,用化学发光法显色5 min,压片显影,扫描图像并保存。
1.4 倒置荧光显微镜观察GFP-LC3B的表达
将ZR75-1细胞接种于6孔板中,分为实验组和对照组(每组均含复孔),待密度为70%左右时,实验组和对照组均分别用LipofectAMINE 2000转染重组质粒pEGFP-C1-LC3B及对照质粒pEGFP-C1,4 h后换为DMEM正常培养基,37℃、CO2培养箱中培养24 h后,分别将1 mol/L雷帕霉素按1∶1000加于2组的复孔中,观察绿色荧光聚体的形成。
2 结果
2.1 pEGFP-C1-LC3B真核表达载体的构建与鉴定
以乳腺文库为模板,PCR扩增得到约400 bp的LC3B全长基因,与预期片段大小一致(图1)。将扩增的LC3B全长序列及pEGFP-C1空载体同时用EcoRⅠ、KpnⅠ双酶切处理,酶切产物与空载体连接,之后转化大肠杆菌DH5α感受态细胞,PCR筛选阳性克隆并进行酶切鉴定,鉴定结果显示在约400 bp处出现特异条带,而对照空载体pEGFP-C1无此特异条带(图2);DNA测序结果显示人LC3B基因序列成功插入载体(数据略)。以上结果表明pEGFPC1-LC3B真核表达载体构建成功。
2.2 检测GFP-LC3B融合蛋白的表达

图1 目的基因LC3B的PCR扩增M:DNA marker DL2000;1:退火温度为58℃时的PCR产物
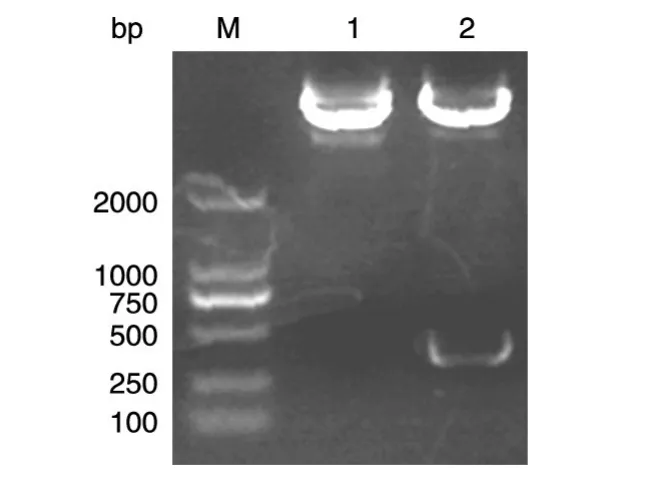
图2 重组质粒的EcoRⅠ/KpnⅠ酶切鉴定M:DNA marker DL2000;1:pEGFP-C1空载体;2:pEGFP-C1-LC3B
将上述阳性克隆提取质粒并转染ZR75-1细胞,实验组转染重组质粒pEGFP-C1-LC3B,对照组转染pEGFP-C1空载体,24 h后收细胞通过Western印迹检测LC3B的表达,以GAPDH为内参。结果显示,转染pEGFP-C1-LC3B重组质粒的实验组表达相对分子质量为43×103的特异性条带,而转染pEGFP-C1空载体的对照组表达的特异性条带相对分子质量为27×103(图3),与预期结果相符,表明GFP-LC3B融合蛋白在ZR75-1细胞中表达成功。
2.3 倒置荧光显微镜观察GFP-LC3B的表达
将重组质粒pEGFP-C1-LC3B和空载体pEGFP-C1分别转染ZR75-1细胞,得到稳定表达GFP-LC3B的实验组和稳定表达GFP的对照组,实验组和对照组的复孔均用自噬诱导剂雷帕霉素刺激,在荧光显微镜下观察(×20),转染pEGFP-C1-LC3B的实验组细胞经自噬诱导剂雷帕霉素处理后,细胞质中出现绿色荧光聚集体,而转染pEGFP-C1的对照组在雷帕霉素处理前后,胞质中的绿色荧光蛋白分布均匀(图4)。
3 讨论
自噬是一种进化上高度保守的膜加工过程[9],其发生包括双层膜结构的小囊泡-自噬吞噬体的形成,它可以吞没如线粒体、内质网、核糖体等细胞内容物,将它们运输至溶酶体结合以至降解[1]。通过降解,自噬使有缺陷的细胞器、折叠或聚集的蛋白质以及长期存在的大分子物质得到更新,在维持细胞内环境稳态方面起着重要的作用。除此之外,肿瘤形成、细胞死亡等过程也会受到自噬的影响[10]。自噬在肿瘤中的作用是一把双刃剑:一方面,自噬通过移除被损坏的细胞器和蛋白质以及保护基因组的稳定性来抑制肿瘤的发生;另一方面,自噬已经被证实在肿瘤微环境中会促进肿瘤细胞的存活[11-14]。鉴于自噬在恶性疾病中的双重角色[15],调整自噬在肿瘤治疗中发挥的作用是非常必要的,且有待进一步深入研究[16-17],以便于充分利用自噬在肿瘤中的抑制作用,降低其在肿瘤中的促进作用。

图3 Western印迹检测GFP及GFP-LC3B的表达1:转染pEGFP-C1对照载体;2:转染pEGFP-C1-LC3B

图4 荧光显微镜观察LC3B在ZR75-1细胞中的自噬泡形成(×20)箭头示自噬小体位置
自噬是一个由一系列自噬相关蛋白介导完成的动态过程,其中ATG8家族蛋白是自噬溶酶体发挥作用的关键蛋白。LC3B是哺乳动物中被广泛研究的ATG8家族分子,既可以水溶性的LC3B-Ⅰ存在,也可以脂溶性的LC3B-Ⅱ存在[18]。正常情况下,胞内合成的LC3B以水溶性的LC3B-Ⅰ存在,在压力、饥饿等应激状态下,LC3B-Ⅰ与自噬体膜表面的磷脂酰乙醇胺(phosphatidylethanolamine,PE)结合形成LC3B-Ⅱ并聚集到自噬体膜上,使LC3B-Ⅱ的含量上调,因此LC3B-Ⅱ的含量可以反映自噬泡数量[18],LC3B-Ⅱ被作为自噬体的标志分子并广泛用于自噬的相关研究。
本研究成功构建了带GFP标签的人LC3B重组质粒,将其转染至ZR75-1细胞中,表达GFP与LC3B的融合蛋白。正常情况下,可见到胞质中均匀分布的绿色荧光蛋白,而在自噬发生后,可以观测到呈点状分布的自噬小体的形成。因此,可以应用荧光显微镜来检测自噬的发生,这为进一步研究自噬在肿瘤细胞中的发生以及机制奠定了基础。
[1] Mizushima N,Levine B,Cuervo A M,et al.Autophagy fights disease through cellular selfdigestion[J], Nature, 2008,451(7182):1069-1075.
[2] Yang Z,Klionsky D J.Eaten alive:a history of macroautoph⁃agy[J].Nat Cell Biol,2010,12(9):814-822.
[3] Reinhart B J,Slack F J,Basson M,et al. The 21-nucleo⁃tide let-7 RNA regulates developmental timing in Caenorhab⁃ditis elegans[J].Nature,2000,403(6772):901-906.
[4] Sato K,Tsuchihara K,Fujii S,et al.Autophagy is activated in colorectal cancer cells and contributes to the tolerance to nutrient deprivation[J].Cancer Res,2007,67(20):9677-9684.
[5] Mizushima N,Klionsky D J.Protein turnover via autophagy:implications for metabolism[J].Annu Rev Nutr,2007,27(1):19-40.
[6] Lao Y,Wan G,Liu Z,et al.The natural compound oblongi⁃folin C inhibits autophagic flux and enhances antitumor effica⁃cy of nutrient deprivation[J].Autophagy,2014,10(5):736-749.
[7] He H,Dang Y,Dai F,et al.Post-translation modifications of three members of human MAPILC3 family and detection of a novel type of modification for MAPILC3B[J].Biol Chem,2003,278(3):29278-29287.
[8] Xie Z,Klionsky D J.Autophagosome formation:core machin⁃ery and adaptations[J].Nat Cell Biol,2007,9(10):1102-1109.
[9] Rubinsztein D C,Mariño G,Kroemer G,et al.Autophagy and aging[J].Cell,2011,146(5):682-695.
[10]Rosenfeldt M T,Ryan K M.The role of autophagy in tu⁃mourdevelopmentand cancertherapy[J].ExpertRevMol Med,2009,11(1):36-38.
[11]Mathew R,Karantza-Wadsworth V,White E.Role of autopha⁃gy in cancer[J].Nat Rev Cancer,2007,7(12):961-967.
[12]Maiuri M C,Tasdemir E,Criollo A,et al.Control of autopha⁃gy by oncogenes and tumor suppressor genes[J].Cell Death Differ,2009,16(1):87-93.
[13]Levine B.Cell biology:autophagy and cancer[J].Nature,2007,446(7137):745-747.
[14]Yang Z J,Chee C E,Huang S,et al.The role of autophagy in cancer:therapeutic implications[J].Mol Cancer Ther,2011,10(9):1533-1541.
[15]Carew J S,Kelly K R,Nawrocki S T.Autophagy as a target for cancer therapy:new developments[J].Cancer Manag Res,2012,4(1):357-365.
[16]Ichimura Y,Kirisako T,Takao T,et al.A ubiquitin-like sys⁃tem mediates protein lipidation[J].Nature,2000,408(6811):488-492.
[17]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue ofyeastApg8p,is localized in autophagosome membranesafterprocessing[J].EMBO J,2000,19(21):5720-5728.
[18]Kabeya Y,Mizushima N,Yamamoto A,et al.LC3,GAB⁃ARAP and GATE16 localize to autophagosomal membrane de⁃pending on form-II formation[J].J Cell Sci,2004,117(13):2805-2812.
