比索洛尔对高血压合并舒张性心力衰竭血管内皮功能及左心室舒张功能的影响
2015-05-03祝河忠陈佳娟潘庆敏
祝河忠,陈佳娟,潘庆敏
(湖北医药学院附属太和医院老年科,湖北 十堰 442000)
高血压是心力衰竭常见病因之一,对左心室舒张功能的损害早于左心室收缩功能[1]。舒张性心力衰竭(DHF)是一组以具有心力衰竭的症状和体征、左心室射血分数正常为特征的临床综合征。本研究中观察比索洛尔对高血压合并DHF患者左心室舒张功能、氨基末端脑钠肽前体(NT-proBNP)、内皮素-1及一氧化氮水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
选取医院老年病房2010年1月至2012年12月入院的高血压合并DHF患者130例,其中男69例,女61例。诊断标准[2]:收缩压≥140 mmHg和(或)舒张压≥90 mmHg,或有服用降压药物者;符合 DHF诊断标准[3],有充血性心力衰竭的症状及体征,左心室收缩功能正常或轻度减低且左心室未扩大,心脏解剖结构改变(左心室肥厚/左心房扩大)和(或)舒张功能不全的证据且排除心包疾病、肥厚型心肌病或限制型心肌病等。所有患者随机分为对照组和试验组,各65例。两组患者基本临床资料比较,差异无统计学意义(P>0.05)。具有可比性,见表 1。
1.2 方法
对照组常规给予阿司匹林、血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、钙拮抗剂和利尿剂等药物治疗。试验组在对照组基础上给予富马酸比索洛尔片(德国默克公司,注册证号 H20100677,规格为每片 2.5 mg)2.5 mg /d,每 3 d 增加 2.5 mg,最大剂量增至 10 mg/d,休息时心率控制在 50次 /分以上,平均用量6.5 mg。于治疗前及治疗3个月后测定左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、左心室射血分数(LVEF);测定二尖瓣舒张早期最大血流速度(E)、舒张晚期的最大血流速度(A),E峰减速时间(EDT),并计算左心室舒张功能指标(E/A);测定舒张早期最大血流速度(E′)及舒张晚期二尖瓣环运动速度(A′),以 E/E′评价左心室充盈压;多普勒超声心动图测定等容舒张时间(IVRT)。分别于治疗前及治疗后3个月晨间空腹12 h抽血,离心分离出血清,-80℃冰箱保存;采用电化学发光分析仪检测血清NT-proBNP,放射免疫法测定血浆内皮素-1,硝酸还原酶法测血清一氧化氮。
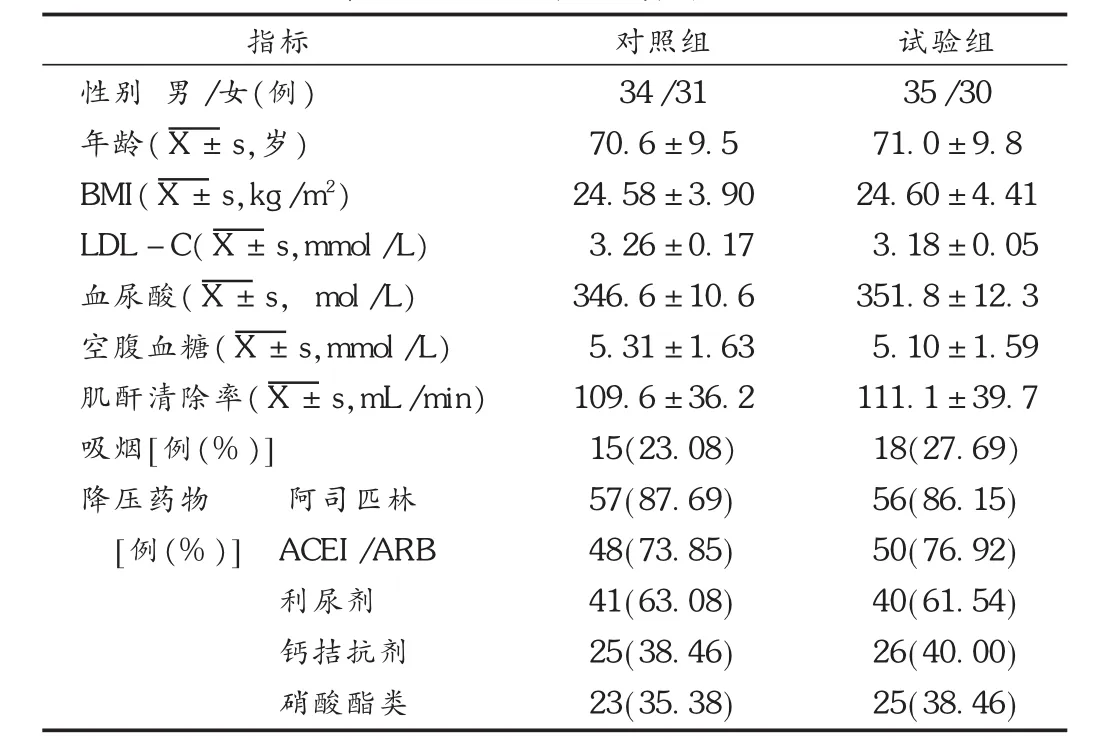
表1 两组患者一般资料比较
1.3 统计学处理
采用SPSS 11.0统计软件进行分析。计量资料以均数±标准差(±s)表示,治疗前后比较采用配对 t检验,组间比较采用两独立样本 t检验;计数资料用百分比表示,行卡方检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表5。
表2 两组患者超声指标比较(±s,n=65)
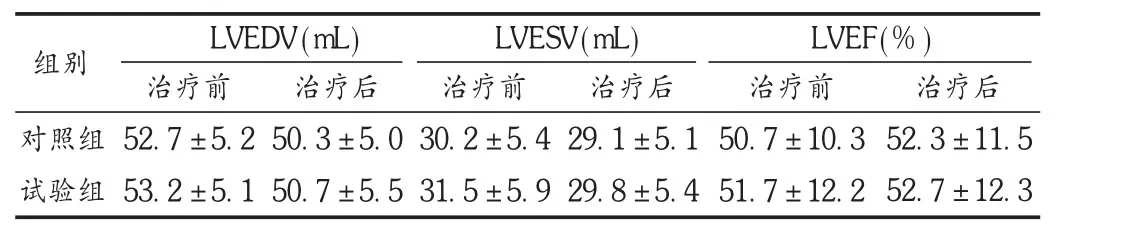
表2 两组患者超声指标比较(±s,n=65)
组别LVEDV(mL) LVESV(mL) LVEF(%)对照组试验组治疗前52.7±5.2 53.2±5.1治疗后50.3±5.0 50.7±5.5治疗前30.2±5.4 31.5±5.9治疗后29.1±5.1 29.8±5.4治疗前50.7±10.3 51.7±12.2治疗后52.3±11.5 52.7±12.3
表3 两组患者心功能指标比较(±s,n=65)
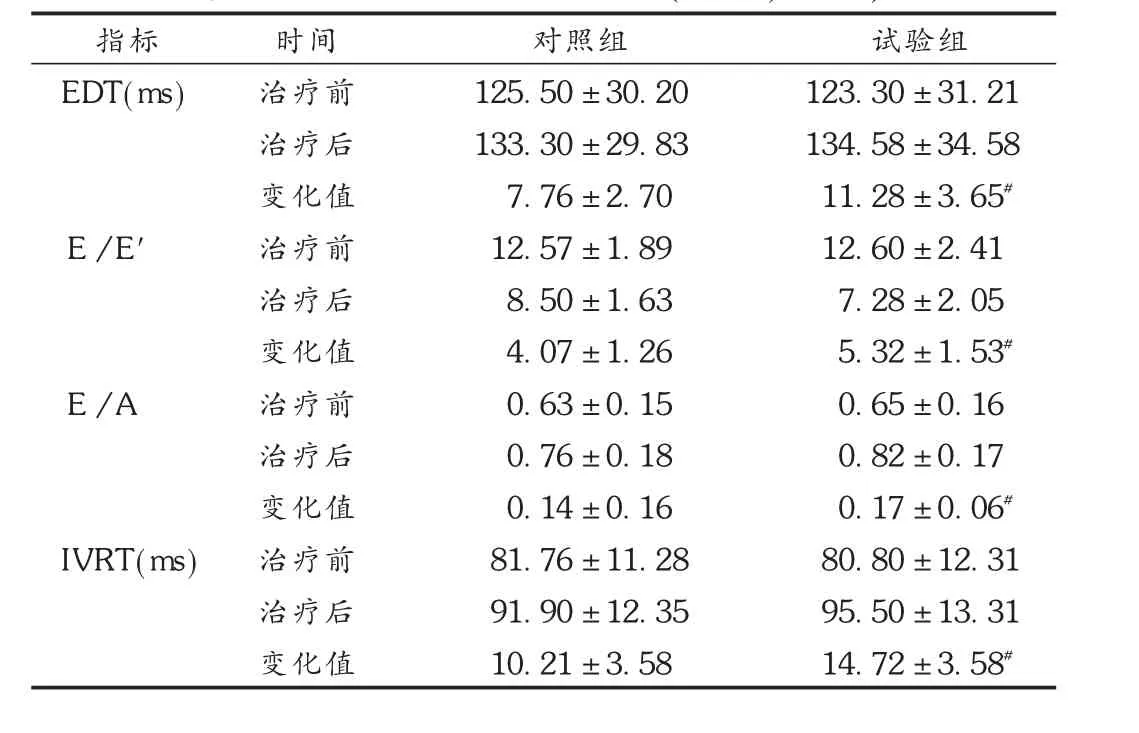
表3 两组患者心功能指标比较(±s,n=65)
指标EDT(ms)E /E′E/A IVRT(ms)时间治疗前治疗后变化值治疗前治疗后变化值治疗前治疗后变化值治疗前治疗后变化值对照组125.50±30.20 133.30±29.83*7.76±2.70 12.57±1.89 8.50±1.63*4.07±1.26 0.63±0.15 0.76±0.18*0.14±0.16 81.76±11.28 91.90±12.35*10.21±3.58试验组123.30±31.21 134.58±34.58*11.28±3.65#12.60±2.41 7.28±2.05*5.32±1.53#0.65±0.16 0.82±0.17*0.17±0.06#80.80±12.31 95.50±13.31*14.72±3.58#
表4 两组患者血压和心率比较(±s,n=65)

表4 两组患者血压和心率比较(±s,n=65)
注:与本组治疗前比较,P<0.05;与对照组比较,P<0.05。表 4和表 5 同。
组别 心率(次/分) 收缩压(mmHg) 舒张压(mmHg)对照组试验组治疗前79.3±8.7 80.1±9.1治疗后73.3±9.1*63.6±4.6*变化值6.0±2.0 16.5±7.0#治疗前155.7±12.5 154.8±10.7治疗后121.5±7.7*119.8±6.3*变化值34.2±13.2 35.0±8.7治疗前89.1±11.4 92.7±12.3治疗后69.3±10.8*65.2±5.9*变化值19.8±8.9 27.5±9.3#*#
表5 两组患者血清NT-proBNP、一氧化氮、内皮素-1水平比较(±s,n=65)

表5 两组患者血清NT-proBNP、一氧化氮、内皮素-1水平比较(±s,n=65)
组别 NT-proBNP(ng/L) 一氧化氮(μmol/L) 内皮素-1(ng/L)对照组试验组治疗前4.36±0.80 4.33±0.90治疗后2.53±0.55*1.75±0.76*变化值1.84±0.64 2.58±0.78#治疗前44.87±10.23 41.10±12.05治疗后45.19±13.08 57.27±13.60*变化值0.32±0.01 16.17±9.79#治疗前65.13±6.25 68.82±9.14治疗后65.26±7.20 53.12±7.85*变化值0.13±0.04 15.70±6.31#
3 讨论
早期诊断及治疗左心室舒张功能障碍对于心力衰竭的预后具有十分重要的意义。多普勒超声心动图是目前临床上应用最广泛的用来评价舒张功能的无创性检查技术[4],但受心率、年龄、心室负荷状态和操作者的技术和经验等因素的影响,临床应用有一定的局限性。NT-proBNP是proBNP的内源性片段,对于舒张功能障碍的诊断具有较高的敏感性和特异性[5]。目前研究表明,高血压合并左心室舒张功能不全患者多有NT-proBNP增高,因此检测NT-proBNP水平可作为超声心动图诊断心舒张功能不全的有效补充。
高血压是导致DHF的常见疾病之一[1],炎症细胞因子与慢性心功能不全有密切关系,炎症细胞因子不仅参与心力衰竭的发生发展,而且与心功能不全的严重程度密切相关。高血压合并DHF患者血浆内皮素-1浓度升高,其强大的缩血管作用加重血流动力学障碍,增加心脏后负荷和心室僵硬度,参与心室肥厚及心肌纤维化,引起心室的顺应性降低、舒张功能不全。目前,认为一氧化氮在心力衰竭中发挥心脏保护作用,可增加心室的顺应性,高血压合并DHF患者心脏一氧化氮生物活性下降,一氧化氮依赖的冠状动脉舒张功能受损,同时一氧化氮生物活性的下降促进了心脏功能不全患者心肌重构。心室重塑是所有心力衰竭的病理生理基础,故认为血管内皮功能不全同样促进了DHF的发生发展,可能与细胞因子异常表达调控有关,提示调控细胞因子的表达可能是抑制DHF患者心脏重构的一种重要治疗方法。高血压合并左心室舒张功能不全患者血清内皮素-1等细胞因子水平明显增高[6],一氧化氮水平降低[7]。
研究表明,血管内皮功能障碍在慢性心力衰竭的发病过程中起着重要作用,而且是病情恶化的重要因素之一[8]。β受体阻滞剂能够抑制交感神经系统的活性、抑制血液循环中儿茶酚胺的释放,减缓心肌重构,减少室性或室上性心律失常的发生,减低慢性心力衰竭死亡率,是慢性心力衰竭的常规用药。比索洛尔是一种高选择性的 β1受体拮抗剂,因选择性高、不良反应少、半衰期长等优点被广泛应用于临床[9]。本研究结果表明,给予常规治疗后NT-proBNP水平降低,左心室舒张功能改善,但血浆内皮素-1、一氧化氮水平无明显变化;加用比索洛尔后,患者血浆NT-proBNP水平降低更加明显,内皮素-1下降,一氧化氮浓度明显增加,进一步改善了患者的左心室舒张功能。研究结果提示,比索洛尔在常规治疗的基础上进一步改善高血压合并左心室舒张功能不全患者的心功能,作用机制可能不仅是对抗交感神经活性、阻滞肾素-血管紧张素-醛固酮系统活性[10],还可能与调节改善内皮功能相关,从而进一步阻滞和逆转心肌重构,改善舒张功能及预后。但本研究观察时间相对较短,样本量有限,其机制有待进一步研究。
参考文献:
[1]Pirat B,Zoghbi WA.Echocardiograhpic assessment of left ventricular diastolic function[J].Anadolu Kardiyol Derg,2007,7(3):310-315.
[2]中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743.
[3]McMurray JJ,Adamopoulos S,Anker SD,et al.ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012:The Task Force for the diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology.Developed in collaboration with the Heart Failure Association(HFA) of the ESC[J].Eur J Heart Fail,2012,14(8):803-869.
[4]Nagueh SF,Appleton CP,Gillebert TC,et al.Recommendations for the evaluation of left ventricular diastolic function by echocardiography[J].J Am Soc Echocardiogr,2009,10(2):165-193.
[5]Tschöpe C,Kasner M,Westermann D,et al.The role of NT-proBNP in the diagnostics of isolated diastolic dysfunction:correlation with echocardiographic and invasive measurements[J].Eur Heart J,2005,26(21):2 277-2 284.
[6]Yamamoto K,Masuyama T,Sakata Y,et al.Roles of renin-angiotensin and endothelin systems in development of diastolic heart failure in hypertensive hearts[J].Cardiovasc Res,2000,47(2):274-283.
[7]Westermann D,Riad A,Richter U,et al.Enhancement of the endothelial NO synthase attenuates experimental diastolic heart failure[J].Basic Res Cardiol,2009,104(5):499-509.
[8]Fischer D,Rossa S,Landmesser U,et al.Endothelial dysfunction in patients with chronic heart failure is independently associated with increased incidence ofhospitalization,cardiac transplantation,ordeath[J].EurHeartJ,2005,26(1):65-69.
[9]Siu CW,Pong V,Jim MH,et al.β-blocker in post-myocardial infarct survivors with preserved left ventricular systolic function[J].Pacing Clin Electrophysiol,2010,33(6):675-680.
[10]Sciarretta S,Paneni F,Palano F,et al.Role of the renin-angiotensin-aldosterone system and inflammatory processes in the development and progression of diastolic dysfunction[J].Clin Sci,2009,116(6):467-477.
