微囊栓制剂降低尼美舒利豚鼠肝毒性的实验研究
2015-05-02曲宏烜陈新梅徐溢明孙笑蕾
曲宏烜,陈新梅,徐溢明,赵 元,孙笑蕾
(1.山东中医药大学药学院,山东 济南 250355;2.山东大学医学院,山东 济南 250000;3.山东中医药大学实验中心,山东 济南 250355)
尼美舒利(nimesulide,NIM)是一种新型的非甾体抗炎药,其解热镇痛抗炎作用显著,临床应用比较广泛。但近年来,其肝损伤不良反应多有报道,具体表现为肝功能异常,天冬氨酸氨基转移酶(Aspartate transaminase,AST)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)含量增高等。为保障用药安全,故限制了其使用[1,2]。为降低尼美舒利的肝毒性,本课题组将其制成微囊栓。微囊栓具有栓剂和微囊的双重优势[3],与普通栓相比,具有缓释、降低毒副作用的特点,且具有血药浓度稳定,维持时间长等优点[4]。本实验考察了尼美舒利微囊栓对豚鼠肝脏的影响,以期提高NIM临床用药的安全性。
1 材料
1.1 仪器 UV-3010紫外分光光度计(日本岛津);FA1004N电子天平(上海精密科学仪器有限公司);XSP-2C光学显微镜(上海长方光学仪器有限公司);予华SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司)。
1.2 试药 ALT试剂盒(南京建成生物工程研究所,批号:C009-1141103);AST试剂盒(南京建成生物工程研究所,批号:C010-1141103);尼美舒利原料药(武汉大华伟业医药有限公司,批号:XH201301248002,纯度 99%)。
1.3 动物 SPF级豚鼠,355 g左右,由山东鲁抗医药股份有限公司提供,许可证号:SCXK(鲁)2013-0001。
2 方法与结果
2.1 药物制备 NIM普通栓、NIM微囊栓均由本实验室制成。每0.5 g栓剂约含 NIM原料药3.3 mg。
2.2 动物分组 试验动物随机分成NIM普通栓组、NIM微囊栓组。饲养于20℃,相对湿度为60%的环境下适应一周,自由进食和饮水。试验前,禁食1 d,可自由饮水。1天后开始试验。
2.3 试验数据的测定 豚鼠每天直肠给药2次,早晚各1次,每次0.5 g。期间,自由进食和饮水,每天记录豚鼠的食量和水量。每隔2 d测定豚鼠的体重。给药15天后,采用空气栓塞法处死豚鼠。解剖后取肝脏称重,计算肝指数(肝指数=肝脏重量/豚鼠体重);每组取相同质量相同部位的肝组织,制备肝组织匀浆,来测定肝组织匀浆液中AST、ALT的含量,剩余肝脏留作病理切片[5,6]。试验数据用统计学软件SPSS 19.0进行分析,P<0.05为具有统计学差异,结果见表1、2。
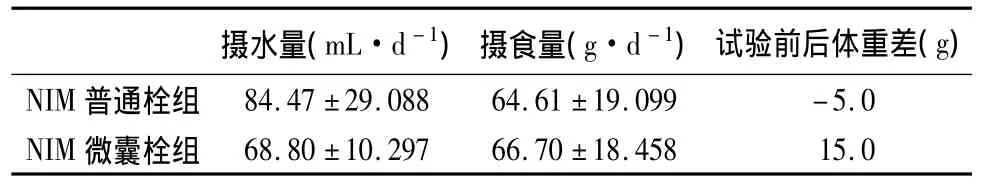
表1 豚鼠每日平均食量、水量及试验前后体重差值
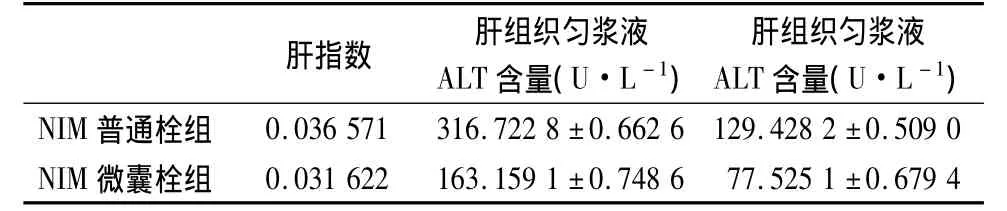
表2 豚鼠肝指数以及肝组织匀浆液中ALT、AST含量
由表1可知:两组豚鼠摄食量没有显著差异,即是否用药对豚鼠的饮食没有影响。虽然NIM普通栓组的每天饮水量明显偏大,但根据统计学分析,发现两组豚鼠的饮水量没有显著性差异。对于体重,NIM普通栓组为负值,NIM微囊栓组为正值,即NIM普通栓组与NIM微囊栓组有显著差异。
由表2可以看出,两组豚鼠的肝指数没有显著差异。而对肝组织匀浆液中ALT、AST含量,两组数据具有显著性差异。NIM微囊栓组明显低于NIM普通栓组,即NIM微囊栓与NIM普通栓相比,能减弱肝脏中ALT、AST含量。
2.4 肝脏病理切片 将豚鼠肝脏病理切片,并HE染色,显微镜下观测病理结构,结果见图1。NIM普通栓组肝索、肝窦结构清晰,且基本完整,肝细胞基本正常,个别细胞发生气球样变。NIM微囊栓组肝索、肝窦结构清晰,且大都完整,肝细胞大多正常。NIM普通栓组与NIM微囊栓组有显著差异。

图1 各组豚鼠肝脏病理切片图(HE,×100)
3 讨论
本试验的试验动物选择为豚鼠,是综合豚鼠肛门大小及饲养难易程度的考虑。实验室常用的动物有小鼠、大鼠、豚鼠、家兔等。重0.5 g栓剂的直径,在豚鼠肛门直径大小的承受范围内,且豚鼠比其它试验动物温顺,便于饲养和给药。
本试验结果表明,NIM微囊栓组豚鼠与NIM普通栓组豚鼠相比,其肝组织匀浆液中AST、ALT含量明显偏低,且通过观察豚鼠的肝组织病理切片,可以看出NIM微囊栓组的肝细胞病变偏轻。综上,进一步表明微囊栓与普通栓相比能够降低NIM的肝毒性。
微囊栓降低肝脏毒性的机理,可以从两方面来看。一方面是栓剂,栓剂能够避免肝脏的首过效应[7],减少药物的代谢失活。另一方面是微囊,微囊是一种人工半透膜,采用缓释、控释微囊化材料将药物制成微囊后,药剂等小分子物质可控地从囊内持久缓慢释放,并扩散到体内起长期治疗的目的[8]。同时,可以使药物浓度集中于靶区,降低毒副作用[9]。故把原料药做成微囊栓能够降低对肝脏的毒性。
本试验中,通过各组豚鼠肝组织匀浆液的数值大小来判定它们的肝脏受损情况大小。肝组织匀浆液中ALT、AST含量虽说可以表明结果,但血液中AST、ALT却是目前最常用的反应肝损伤的生化指标。具体血液中AST、ALT含量,今后还有待试验验证。之前有试验验证普通栓与微囊栓的体外释放情况[10]。结果显示,微囊栓和普通栓相比,具有较好的体外缓释效果。也有试验通过测定NIM栓剂血药浓度,得出以市售NIM普通片为参比制剂,NIM直肠栓的相对生物利用度为84.75%的结论[11]。NIM栓剂和微囊栓的体内释放情况,还有待试验进一步深入验证。
[1]梁玉华,刘劲.19例尼美舒利所致肝脏损害的调查分析[J].海南医学,2011,22(19):34 -35.
[2]邵建芳,王志成,王惠媛,等.尼美舒利肝脏损害不良反应探究[J].中国处方药,2014,1:20 -21.
[3]李喜香,刘效栓,包强,等.新型栓剂制备工艺及其药动学特征研究进展[J].中国药事,2013,27(7):740-744.
[4]陈圣洁,陈志红.栓剂新剂型的研究概况[J].医学理论与实践,2006,19(10):1158 -1159.
[5]刘聪,陈新梅,袁玉芳.脂质体降低尼美舒利肝脏毒性的初步研究[J].药学研究,2014,33(7):382 -383.
[6]袁玉芳,陈新梅,刘聪.尼美舒利脂质体对小鼠体重和摄食量的影响[J].化工时刊,2014,28(7):24-25.
[7]陈新梅,高晓黎,孙卫东,等.尼美舒利栓药代动力学及相对生物利用度研究[J].西北药学杂志,2003,18(3):116-119.
[8]杨晓昀,陈儿同,周燕,等.微囊化技术在医学领域中的应用与进展[J].中国组织工程研究与临床康复,2010,14(29):5483 -5488.
[9]周松,陈腾.微囊化技术在药物研究中的应用[J].医药导报,2007,26(2):179 -181.
[10]杨宜华,刘毅,赵子明,等.萘普生微囊栓的制备及其质量控制[J].中国药房,2011,22(25):2363 -2365.
[11]陈新梅,高晓黎,白丽.用药效学试验筛选尼美舒利新剂型[J].中国药学杂志,2003,38(11):841 -844.
