酶法合成松香酸淀粉酯的抗氧化性研究
2015-04-29李贺林日辉刘作娇贺俊斌李训碧龙寒
李贺 林日辉 刘作娇 贺俊斌 李训碧 龙寒
摘要 采用酶催化方法合成了取代度为0.085的松香酸淀粉酯,经过红外光谱分析,发现在1 732 cm-1处产生酯键的特征吸收峰,扫描电镜分析结果表明酯化修饰化反应不仅发生在淀粉的非定型区,而且发生在淀粉的结晶区。在不同浓度、温度和pH的条件下,采用1,1-二苯基-2-三硝基苯肼(DPPH)法分析了松香酸淀粉酯的抗氧化性能。结果表明,与木薯淀粉、预处理淀粉相比,松香酸淀粉酯的抗氧化性得到提高。其中,在最佳浓度条件下,松香酸淀粉酯对DPPH自由基抑制率为31.66%,比木薯淀粉、预处理淀粉抑制率分别提高了1.14%和3.02%;在最佳pH条件下,松香酸淀粉酯对DPPH自由基抑制率为31.75%,比木薯淀粉、预处理淀粉抑制率分别提高了4.4%和2.1%;在最佳温度条件下,松香酸淀粉酯对DPPH自由基抑制率为32.95%,比木薯淀粉、预处理淀粉抑制率分别提高了2.37% 和 0.81%。该研究将为酶催化合成的松香酸淀粉酯在食品、化妆品等领域的应用提供理论依据。
关键词 松香;酶;酯化;抗氧化性
中图分类号 S188+.3 文献标识码 A 文章编号 0517-6611(2015)11-016-04
木薯淀粉是低廉、丰富、易得的可再生资源,它是由多个葡萄糖单元组成的天然多糖亲水性高分子化合物,由于淀粉亲水性质的局限性,限制了淀粉在工业中的进一步应用,为了扩拓宽淀粉的应用领域,通常需要对淀粉进行改性,进而对淀粉衍生物进行深入研究。 连喜军等[1]采用DPPH法研究了不同品种甘薯淀粉的抗氧化性;林艳平等[2]研究了玉米淀粉硫酸酯的抗氧化性;张晓变等[3]研究了双醛马铃薯淀粉的抗氧化性能;而有关以松香和木薯淀粉为原料在脂肪酶的催化作用下制备松香酸淀粉酯并对其抗氧化性能的研究尚未见报道。
松香,从针叶树分泌物而得到的一种天然产物,是以脱氢枞酸、左旋海松酸和海松酸为主的混合物,其分子式为C19H29COOH。松香酸结构中不仅有“-COOH”和“C=C”2个活性中心,而且还存在三环非骨架的特殊结构,三环非骨架结构类似于石油基脂环族和芳族化合物。松香作为还原剂在焊接方面进行应用[4],在高温下,铜易被氧化,造成虚焊和焊接不牢等,采用松香为还原剂,可以阻止铜被氧化,从而保证焊接质量。同时,通过利用三环非骨架的亲电取代反应引入卤素原子、硝基、羟基、羰基等,对芳香苯环修饰来提高化合物生物活性[5]。Esteves等[6-7]和Zaharescu等[8]、Littmann等[9]研究表明,通过利用脱氢枞酸异丙基的位阻,通过酯化、硝化、还原、N-芳基化反应制备一系列12、14位二芳胺,研究了这些位阻胺作为抗氧化剂的作用,有望在医药、高分子材料、食品等工业得到广泛应用。Gigante等[10]通过以脱氢枞酸为原料,制备了脱氢枞酸茶多酚衍生物,并对其抗菌、抗癌、抗诱变、抗病毒、抗类风湿性和抗硝基氧化性能进行了测定。
目前,方华祥等[11]和唐世华等[12]利用松香作为羧基供体采用化学法合成松香淀粉酯。然而,酶法与化学法相比具有反应条件温和、生产成本低和副产物较少等优点。笔者选取木薯淀粉、预处理淀粉、松香酸淀粉酯作为研究对象,采用DPPH法研究了松香酸淀粉酯的抗氧化性,结果表明,合成产物松香酸木薯淀粉酯的抗氧化性较原淀粉和预处理淀粉得到改善,以期为进一步拓展酶催化合成的松香酸淀粉酯在食品,化妆品、生物材料等领域的应用提供理论依据。
1 材料与方法
1.1 材料木薯淀粉(食品级):广西岑溪市三角淀粉有限责任公司;松香木薯淀粉淀粉酯:广西高校微生物与植物资源利用重点实验室自制;1,1-二苯基苦基苯肼(DPPH):上海楷洋生物技术有限公司;无水乙醇(AR):成都市科龙化工试剂厂;氢氧化钠(AR):天津市博迪化工有限公司。
AL104电子天平:梅特勒-托利多仪器(上海)有限公司;HJ-6A多头磁力搅拌器:金坛市鸿科仪器厂;Magna 550型傅立叶变换红外光谱仪:美国赛默飞世尔科技公司;SUPRA 55型场发射扫描电子显微镜:ZEISS。
1.2 合成工艺流程
1.2.1 木薯淀粉的预处理。
将氢氧化钠与尿素以一定的质量比加入到100 ml蒸馏水中,配制成一定浓度的氢氧化钠/尿素水溶液,并置于冰箱中冷却,在快速机械搅拌下慢慢加入一定质量的木薯淀粉干基,搅拌直至得到透明、均相的淀粉糊。滴加稀盐调节溶液pH至中性,缓慢滴加95%的乙醇水溶液洗涤数次直至无氯离子,再用无水乙醇洗涤以脱去水分,70 ℃下真空干燥12 h得到预处理淀粉。
1.2.2 松香淀粉酯的合成。
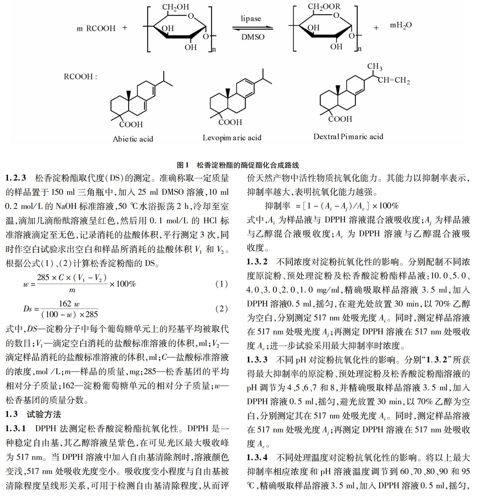
在150 ml三角瓶中,分别加入一定质量的原木薯淀粉和预处理木薯淀粉,然后加入一定量的松香和二甲亚砜溶液,摇匀,溶解后,加入一定量的Novozym 435固定化脂肪酶,恒温反应一定时间。反应结束后,冷却到室温,离心取上清液,在剧烈搅拌下加入150 ml甲醇,有大量沉淀析出,离心,甲醇洗涤3次,每次20 ml,再用30 ml丙酮洗涤4 h后离心,产物于烘箱中70 ℃恒温干燥,粉碎制得成品。其合成路线见图1。
1.2.3 松香淀粉酯取代度(DS)的测定。
准确称取一定质量的样品置于150 ml三角瓶中,加入25 ml DMSO溶液,10 ml 0.2 mol/L的NaOH标准溶液,50 ℃水浴振荡2 h,冷却至室温,滴加几滴酚酞溶液呈红色,然后用 0.1 mol/L 的 HCl 标准溶液滴定至无色,记录消耗的盐酸体积,平行测定3次,同时作空白试验求出空白和样品所消耗的盐酸体积V1和V2。根据公式(1)、(2)计算松香淀粉酯的DS。
w=285×C×(V1-V2)m×100%(1)
Ds=162 w(100-w)×285 (2)
式中,DS—淀粉分子中每个葡萄糖单元上的羟基平均被取代的数目;V1—滴定空白消耗的盐酸标准溶液的体积,ml;V2—滴定样品消耗的盐酸标准溶液的体积,ml;C—盐酸标准溶液的浓度,mol /L;m—样品的质量,mg;285—松香基团的平均相对分子质量;162—淀粉葡萄糖单元的相对分子质量;w—松香基团的质量分数。
1.3 试验方法
1.3.1 DPPH 法测定松香酸淀粉酯抗氧化性。
DPPH是一种稳定自由基,其乙醇溶液呈紫色,在可见光区最大吸收峰为 517 nm。当 DPPH 溶液中加入自由基清除剂时,溶液颜色变浅,517 nm 处吸收光度变小。吸收度变小程度与自由基被清除程度呈线形关系,可用于检测自由基清除程度,从而评价天然产物中活性物质抗氧化能力。其能力以抑制率表示,抑制率越大,表明抗氧化能力越强。
抑制率 =[1-(Ai-Aj)/Ac]×100%
式中,Ai为样品液与 DPPH 溶液混合液吸收度;Aj为样品液与乙醇混合液吸收度;Ac为DPPH 溶液与乙醇混合液吸收度。
1.3.2 不同浓度对淀粉抗氧化性的影响。
分别配制不同浓度原淀粉、预处理淀粉及松香酸淀粉酯样品液:10.0、5.0、4.0、3.0、2.0、1.0 mg/ml,精确吸取样品溶液 3.5 ml,加入DPPH溶液0.5 ml,摇匀,在避光处放置30 min,以70%乙醇为空白,分别测定517 nm处吸光度Ai。同时,测定样品溶液在517 nm处吸光度Aj;再测定DPPH溶液在517 nm处吸收度Ac;进一步试验采用最大抑制率时浓度。
1.3.3 不同pH对淀粉抗氧化性的影响。
分别“1.3.2”所获得最大抑制率的原淀粉、预处理淀粉及松香酸淀粉酯溶液的pH调节为4、5、6、7和8,并精确吸取样品溶液3.5 ml,加入DPPH溶液0.5 ml,摇匀,避光放置30 min,以70%乙醇为空白,分别测定其在517 nm处吸光度Ai。同时,测定样品溶液在517 nm处吸光度Aj;再测定DPPH溶液在517 nm处吸收度Ac。
1.3.4 不同处理温度对淀粉抗氧化性的影响。
将以上最大抑制率相应浓度和pH溶液温度调节到60、70、80、90和95 ℃,精确吸取样品溶液3.5 ml,加入DPPH溶液0.5 ml,摇匀,避光放置30 min,以70%乙醇为空白,分别测定其在517 nm处吸光度Ai。同时,测定样品溶液在517 nm处吸光度Aj;再测定DPPH溶液在517 nm处吸收度Ac。
1.4 红外光谱结构表征 用溴化钾压片法压片,将样品充分研磨进行FT-IR扫描,波数范围500~4 000 cm-1。
1.5 扫描电镜分析 将少量样品均匀分散到导电胶上,在其表面喷金进行测试,采用SUPRA 55型场发射扫描电子显微镜(field-emission scanning electron microscopy,FE-SEM)观测分析样品的形貌。
2 结果与分析
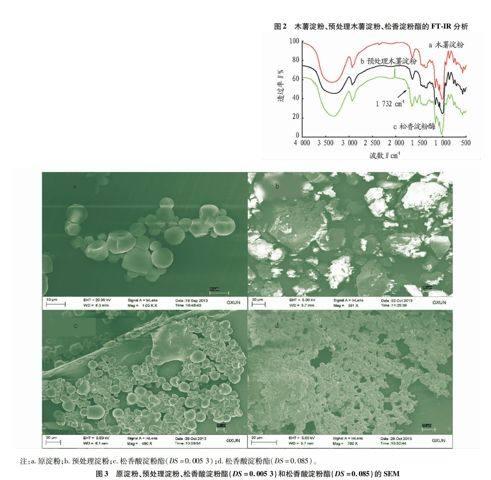
2.1 红外光谱分析通过红外光谱分析对比图2 a、b 、c 、d可以发现,在3 348 cm-1附近有一宽峰为氢键缔合的-OH的伸缩振动,2 932 cm-1附近为 C-H 不对称伸缩振动,1 152、1 080和1 015 cm-1附近为C-OH伸缩振动吸收峰,均属于淀粉分子的特征吸收峰;而图2c 松香酸淀粉酯在1 732 cm-1处出现酯羰基C=O的伸缩振动吸收峰;红外分析结果表明松香和淀粉在固定化脂肪酶的催化作用下发生了酯化反应,产物为松香淀粉酯[13]。
2.2 扫描电镜分析从图3可以看出,原淀粉呈圆形或椭圆形,表面光滑且结构良好。预处理淀粉,淀粉经氢氧化钠/尿素混合水溶液处理后,淀粉表面结构有一定程度的破坏,但还维持一定的形貌。未经预处理的淀粉与松香酸发生酯
化反应后,其表面光滑且结构良好,与原淀粉结构相似。预处理松香酸淀粉酯,其颗粒结构完全被破坏,表面粗糙且规
整度差,与原淀粉、预处理淀粉和松香酸淀粉酯相比呈现出完全不同的形貌结构。因此,这成为松香与淀粉发生酯化反应的又一有力佐证,且表明酯化过程不仅发生在淀粉的非定型区,而且发生在淀粉的结晶区[14]。
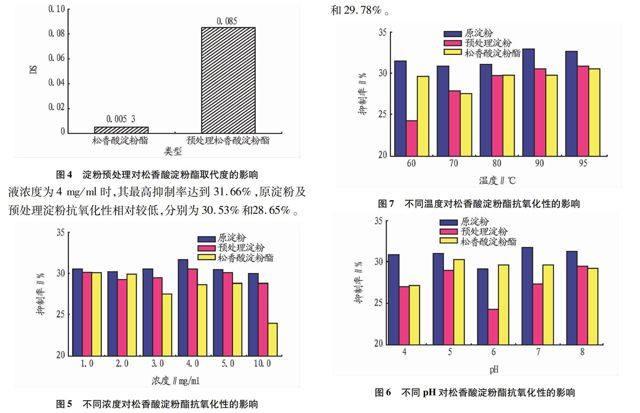
2.3 淀粉预处理对松香酸淀粉酯取代度的影响由图4可知,原淀粉氢氧化钠/尿素混合水溶液预处理后,通过酶促酯化反应制备的松香酸淀粉酯DS=0.085,而未经预处理的淀粉制备的松香酸淀粉酯DS=0.005 3。结果表明,松香酸淀粉酯的DS大小与淀粉的活化预处理有密切关系。与原淀粉相比,淀粉经过预处理后,导致其致密结晶区域遭到破坏,化学试剂相对容易向淀粉分子中渗透,提高了淀粉分子的反应活性,因此,酯化反应的化学反应活性提高,DS提高,其结果与SEM结果相佐证[15]。
2.4 不同浓度对淀粉抗氧化性的影响原淀粉、预处理淀粉、松香酸淀粉酯(DS=0.085)在pH 7、处理温度70 ℃时,不同浓度条件下清除羟自由基抑制程度见图5。由图5可知,经过酯化修饰后的松香酸淀粉酯的抗氧化性最高,且在淀粉液浓度为4 mg/ml时,其最高抑制率达到 31.66%,原淀粉及预处理淀粉抗氧化性相对较低,分别为30.53%和28.65%。
2.5 不同pH对淀粉抗氧化性的影响原淀粉、预处理淀粉、松香酸淀粉酯(DS=0.085)在4 mg/ml、处理温度70 ℃时,不同pH条件下清除羟自由基抑制程度见图6。由图6可知,经过酯化修饰后的松香酸淀粉酯的抗氧化性较高,在pH=7和pH=8时最高抑制率达到 31.75%和31.26%,而原淀粉及预处理淀粉抗氧化性相对较低。考虑到松香酸淀粉酯在碱性条件下容易酯水解反应,因此,后续试验选取最佳pH=7。在pH=7时,原淀粉和预处理淀粉的抑制率分别为27.35%和29.65%。
2.6 不同处理温度对淀粉抗氧化性的影响原淀粉、预处理淀粉、松香酸淀粉酯(DS=0.085)在4 mg/ml、处理温度70 ℃时,不同处理温度条件下清除羟自由基抑制程度见图7。由图7可知,经过酯化修饰后的松香酸淀粉酯的抗氧化性较高,在处理温度为90 ℃时松香酸淀粉酯的抑制率高达32.95%。同时,原淀粉与预处理淀粉的抑制率分别为30.58%和29.78%。
3 结论与讨论
(1)考察了不同浓度、温度和pH条件下,采用DPPH法分析了松香酸淀粉酯的抗氧化性能。结果表明,与木薯淀粉、预处理淀粉相比,松香酸松香酸淀粉酯(DS=0.085)的抗氧化性提高。其中,在最佳浓度条件下,松香酸淀粉酯对DPPH自由基抑制率为31.66%,比木薯淀粉、预处理淀粉抑制率分别提高了1.14%和3.02%;在最佳pH条件下,松香酸淀粉酯对DPPH自由基抑制率为31.75%,比木薯淀粉、预处理淀粉抑制率分别提高了2.367% 和 0.807%;在最佳温度条件下,松香酸淀粉酯对DPPH自由基抑制率为32.95%,比木薯淀粉、预处理淀粉抑制率分别提高了4.4% 和2.1%;木薯淀粉、预处理淀粉、松香酸淀粉酯对DPPH自由基抑制率分别为30.58%、29.78%和32.95%。该研究为松香酸木薯淀粉的开发和应用提供了理论依据。
(2)虽然该研究松香酸淀粉酯的抗氧化性能较原淀粉和预处理淀粉提高不显著,但已有大量关于松香衍生物抗氧化性能的报道。因此,下一步将通过对松香酸淀粉酯的三环非骨架的特殊结构进一步修饰研究,以获得高抗氧化性能的松香酸淀粉酯。
参考文献
[1]连喜军,王亮,王吰,等.DPPH法研究不同品种甘薯抗性淀粉抗氧化性[J].粮食与油脂,2009(6):26-28.
[2] 林艳平,张艳萍.玉米淀粉硫酸酯的抗氧化性研究[J].食品工业科技,2012,33(8):149-151.
[3] 张晓变,邢连华,李正君,等.双醛马铃薯淀粉的理化性质及抗氧化性[J].天津科技大学学报,2013,28(3):1-5.
[4] SCHULER P.Natural antioxidants exploited commercially[M]//Food antioxidants.Springer Netherlands,1990:99-170.
[5] 高宏,宋湛谦,商士斌.脱氢枞酸芳环改性的研究进展[J].林产化学与工业,2011,31(5):109-116.
[6] ESTEVES M A,NARENDER N,MARCELO-CURTO M J,et al.Synthetic derivatives of abietic acid with radical scavenging activity[J].Journal of Natural Products,2001,64(6):761-766.
[7] ESTEVES M A,BRITES M J,MARCELO-CURTO M J,et al.Secondary amines from dehydroabietic acid as antioxidant additives[J].Key Engineering Materials,2002,230:404-407.
[8] ZAHARESCU T,JIPA S,SETNESCU R,et al.Synergistic effects on thermal stability of ethylene-propylene elastomers stabilized with hindered pHenols and secondary amines[J].Polymer Testing,2002,21(2):149-153.
[9] LITTMANN E R.Composition of matter and method of producing:US,2,201,237[P].1940-05-21.
[10] GIGANTE B,SANTOS C,SILVA A M,et al.Catechols from abietic acid:synthesis and evaluation as bioactive compounds[J].Bioorganic & Medicinal Chemistry,2003,11(8):1631-1638.
[11] 方华祥,段文贵,申长茂,等.歧化松香木薯淀粉酯的微波合成及表征[J].应用化工,2008,37(4):377-384.
[12] 唐世华,李景权,覃浩鹏,等.松香酸淀粉酯的合成与结构表征[J].林产化学与工业,2011,31(6):55-60.
[13] 李贺,林日辉,粟佳婷,等.酶促酯化制备松香酸淀粉酯的性质及结构表征[J].化工学报,2014,65(10):4123-4130.
[14] LIN R H,LI H,LONG H,et al.Synthesis of Rosin Acid Starch Catalyzed by Lipase[J].Bio Med Research International,2014,http://dx.doi.org/10.1155/2014/647068.
[15] LIN R H,LI H,LONG H,et al.Optimization of lipase-catalyzed rosin acid starch synthesis by response surface methodology[J].Journal of Molecular Catalysis B:Enzymatic,2014,105:104-110.
责任编辑 李占东 责任校对 况玲玲
