借助ITS序列用GFP标记巴西橡胶树棒孢霉落叶病病原菌
2015-04-29刘晓妹等
刘晓妹等


摘 要 由多主棒孢菌(Corynespora cassiicola)侵染引起的巴西橡胶树棒孢霉落叶病是影响橡胶树产胶量的主要病害之一。为了开展该病原菌在活体叶片中的病理学研究,本实验将绿色荧光蛋白gfp基因表达盒插入了多主棒孢菌经定点突变后的ITS序列中,构建了重组质粒pITGH,并经PEG介导转化了原生质体,获得了GFP标记的多主棒孢菌转化子,所获得的转化子经过连续7次转接培养后仍能在分生孢子、分生孢子梗、芽管和菌丝中稳定地发出强烈的绿色荧光,其生长特性和致病性与野生菌株无明显差异。
关键词 巴西橡胶树;多主棒孢菌;绿色荧光蛋白;ITS定点突变;标记
中图分类号 S432.4 文献标识码 A
Abstract Corynespora leaf fall(CLF)disease, caused by the fungal pathogen Corynespora cassiicola, is a major disease of rubber tree(Hevea brasiliensis)that affects the production of natural rubber. The objective of this paper was to provide desired materials for studing pathogenesis on living leaves. The green fluorescent protein(GFP)-expression vector pITGH was constructed by inserting a gfp cassette into rDNA-ITS of site-directed mutagenesis. C. cassiicola protoplasts were transformed by pITGH using a PEG-mediated method. A GFP-tagged transformat was gained. The transformation was efficient, and GFP expression remained stable for at least seven subcultures with fluorescence clearly visible in both the hyphae and spores. The transformed isolate also retained its pathogenicity and growth pattern, both similar to those of wild type. This result would be useful for understand biology,observing infection process, predicting the CLF disease and evaluating resistance of H. brasiliensis to C. cassiicola by means of leaf colonization studies.
Key words Hevea brasiliensis; Corynespora cassiicola; GFP; rDNA-ITS of site-directed mutagenesis; Marker
doi 10.3969/j.issn.1000-2561.2015.03.022
巴西橡胶树是重要的热带作物之一,其产品天然橡胶与钢铁、石油、煤炭并列为四大工业原料。由多主棒孢菌[Corynespora cassiicola(B. & C.) Wei]侵染引起的巴西橡胶树棒孢霉落叶病是影响橡胶树产胶量的主要病害之一[1]。该病菌能侵染为害280多种植物[2]。关于该病菌的生物学特性、遗传多样性以及病害防治等方面已开展了较多研究[3-4],而且已深入到分子研究水平,已报道了4个致病相关基因CCK1[3]、CMP1[4]、CCHog1[5]和cas[6],但有关该菌GFP标记的研究国内外尚未见报道。
与传统的组织印迹法、放射性标记核酸探针法、GUS染色法等非活体检测方法相比,绿色荧光蛋白(green fluorescent protein,GFP)因发光稳定、对活细胞无伤害和不需添加外源底物,就可以在活细胞中实现实时动态监测等优点[7],利用GFP标记靶标植物病原菌成为了目前研究病原菌与寄主之间互作的重要手段[8],迄今已标记成功的植物病原菌有芒果尖孢炭疽菌(Colletotrichum acutatum)[9]、芒果畸形病病菌(Fusarium proliferatum)[10]、香蕉、西瓜枯萎病菌(Fusarium oxysporum)[11-13]、稻曲病菌(Ustilaginoidea virens)[14]、棉花黄萎病菌(Verticillium dahlia)[15]、西瓜细菌性果斑病菌(Acidovorax citrulli)[16]等,极大地便利了这些病原菌在定植、组织侵染过程及品种侵染差异性等方面的研究。GFP也被广泛用于标记病原菌的致病相关基因[17-18],为研究其时空表达特点,揭示病原菌致病机理提供了有利的手段。为了在活体寄主上研究多主棒孢菌与巴西橡胶树叶片的互作关系,本研究拟通过定点突变ITS序列和PEG介导途径,将多主棒孢菌构建成了能发出绿色荧光的标记菌株,以期为下一步研究该病菌在活体橡胶叶片上的生物学、侵染过程、预测病害和筛选抗病品种等打下良好的材料基础。
1 材料与方法
1.1 材料
1.1.1 供试病原菌和质粒 巴西橡胶树棒孢霉落叶病病原菌多主棒孢菌[Corynespora cassiicola(B. & C.)Wei]单孢菌株CC004,由中国热带农业科学院环境与植物保护研究所提供。潮霉素B(HmB)抗性基因hygB来源于质粒pCT74[8],由美国Oregon大学Ciuffetti博士提供。
1.1.2 供试药剂和培养基 Fungal gDNA Kit、Mini Plasmid Kit为BioMiga产品;pMD18-T simple vector、E. coli JM109、X-Gal、IPTG、XhoⅠ、EcoRⅠ、Marker DL 2 000、Marker DL 15 000均为TaKaRa产品;2×HS Taq-Mixture Kit、TIANgel Midi Purification Kit为TIANGENE产品。潮霉素B为Roche进口分装,Ampicillin为Amresco进口分装。溶壁酶购自广东省微生物研究所。用于制备PDA、PDS、PD培养液、LB培养基的试剂为国产分析纯试剂。
1.2 方法
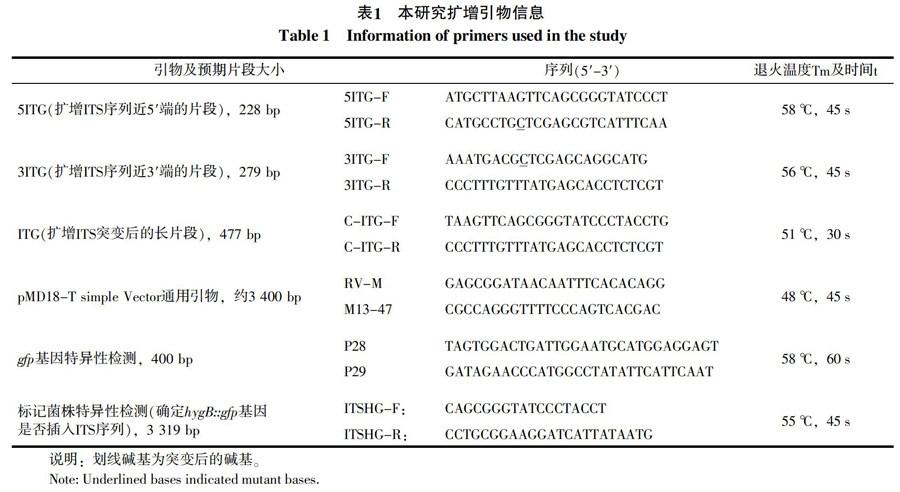
1.2.1 GFP标记多主棒孢菌的策略与方法 从pCT74质粒上酶切hygB::gfp片段需要限制性内切酶XhoⅠ(CTCGAG)和EcoRⅠ。在CC004菌株的ITS序列上[4],只存在EcoRⅠ,而无XhoⅠ位点,但在第324~329位点有与XhoⅠ位点相似的序列TTCGAG,若通过设计引物(5ITG-F/5ITG-R、3ITG-F/3ITG-R、C-ITG-F/C-ITG-R),将该位点的碱基T定点突变为C,即可获得含XhoⅠ酶切位点的ITS新序列(命名ITG)。将ITG克隆至pMD18T-simple vector上(pITG),再用XhoⅠ和EcoRⅠ双酶切pITG和pCT74,回收线性化pITG和hygB::gfp片段,通过T4连接酶将hygB::gfp插入pITG,即可获得重组质粒pITGH。再用pITGH转化CC004菌株原生质体,因其hygB::gfp两侧为ITS部分序列,所以可通过同源重组将hygB::gfp整合入CC004菌株的ITS序列上,最终获得gfp标记的多主棒孢菌(图1)。引物见表1,扩增体系(50 μL):2×HS Taq Mixture 25.0 μL,上/下游引物(10 μmol/L)各2.0 μL,模板1.0 μL(扩增5ITG和3ITG片段时以CC004菌株总DNA为模板,扩增ITG片段时以回收的5ITG和3ITG产物为模板),ddH2O 20.0 μL。5ITG、3ITG、ITG片段扩增程序:95 ℃ 5 min;95 ℃ 30 s,退火温度(Tm)及时间(t)见表1,72 ℃ 1.5 min,35个循环;72 ℃ 10 min。gfp检测程序:96 ℃ 4 min;94 ℃ 50 s,58 ℃ 60 s,72 ℃ 60 s,30个循环;72 ℃ 10 min。其余操作见相应试剂盒。
1.2.2 重组质粒pITGH的PCR鉴定 用pMD18-T simple vector通用引物RV-M/M13-47检测,并将符合预期的重组质粒寄往深圳华大基因科技服务有限公司测序,进一步证实序列的正确性。
1.3 pITGH转化多主棒孢菌菌株CC004原生质体
1.3.1 CC004菌株对潮霉素B的敏感性测定 在含20、30、40、50、60、70、80 μg/mL的Hm B的PDA培养基上接种菌饼,28 ℃培养7 d,确定Hm B对CC004菌株的最低抑菌浓度。
1.3.2 CC004菌株原生质体制备及其PEG介导的转化与再生 参考刘晓妹[3]的方法,制备CC004菌株原生质体,使其浓度为2×107~3×107个/mL,立即转化,即在10 mL无菌尖底离心管中,加入100 μL原生质体、40 μL pITGH质粒、50 μL 2×STC溶液,轻轻混匀后,冰浴20 min,加入2 mL 60% PEG 4000溶液,轻轻混匀,室温放置10~20 min,再加入适量PDS 再生培养液,使最终总体积为5 mL,轻轻混匀,封口后在28 ℃培养箱光照培养36 h,取1 mL涂抹于含80 μg/mL Hm B和适量链霉素的PDS平板上,共涂抹5皿,28 ℃黑暗培养10~15 d后,挑取单菌落在激光共聚焦显微镜下镜检荧光。
1.3.3 GFP标记菌株的荧光稳定性检测 选择绿色荧光最强的菌落,单孢纯化后在不含Hm B的PDA培养基上连续7次转接培养,在培养的初期(2 d)、中期(5 d)和后期(10 d),镜检其荧光稳定性并拍照。
1.3.4 GFP标记菌株的PCR鉴定 先用gfp基因特异性引物P28、P29检测1.3.3获得的单孢菌株,再从插入片段的外侧ITS序列上设计引物,即标记菌株特异性检测引物ITSHG-F/ITSHG-R,检测并测序扩增产物,以证实hygB::gfp基因插入了标记菌株的ITS序列中。
1.3.5 GFP标记菌株的菌落形态观察和致病性测定
将标记菌株和野生型菌株在不含Hm B的PDA培养基上28 ℃培养5 d后,观察菌落形态和大小。再用无菌水洗下配成2 000个孢子/mL的悬浮液,刺伤接种巴西橡胶树感病品种‘RIM600嫩绿色叶片,28 ℃保湿培养,定时观察。用无菌水作空白对照。每处理重复5片叶。
2 结果与分析
2.1 多主棒孢菌菌株CC004的5ITG、3ITG和ITG片段扩增结果
图2表明,5ITG、3ITG、ITG扩增条带的大小分别约为230、280、480 bp ,符合预期。测序表明:大小477 bp的ITG序列在第210位点(ITS第324位点)的碱基T被突变为了碱基C,具备了XhoⅠ的酶切位点。
2.2 重组质粒pITGH的PCR鉴定
用引物M13-47和RV-M从重组质粒pITGH上扩增获得约3 400 bp的片段(图3),说明hygB::gfp(3.0 kb)片段已插入了ITG(477 bp)的XhoⅠ和EcoRⅠ酶切位点之间,测序表明重组质粒pITGH-3序列完全正确,可以用于后续转化。
2.3 gfp基因转化多主棒孢菌菌株CC004原生质体
2.3.1 CC004菌株对潮霉素B的敏感性测定
CC004菌株在含Hm B的PDA平板上培养7 d,结果表明:Hm B对CC004菌株的最低抑菌浓度为80 μg/mL。
2.3.2 GFP标记菌株的荧光稳定性检测 连续7次转接培养后,用激光共聚焦显微镜观察GFP标记菌株,仍可在培养初期、中期和后期的分生孢子及其萌发的芽管、分生孢子梗以及菌丝体中观察到强烈的绿色荧光(图4)。说明gfp基因在CC004菌株中能稳定遗传和表达。
2.3.3 GFP标记菌株的PCR鉴定 提取转化子菌株基因组DNA后,用gfp特异性引物P28/P29进行PCR检测,得到约400 bp的预期片段,而在野生菌株中未扩增出此条带(图5),可见gfp基因已整合到了转化子基因组中。再用标记菌株特异性检测引物ITSHG-F/ITSHG-R检测,在转化子和野生菌株中分别扩增到约3 300 bp和520 bp的预期片段(图6),说明转化子得到了完全纯化,且hygB::gfp基因插入了标记菌株的ITS序列中,此结果被扩增产物的后续测序结果进一步得到了证实。
2.3.4 GFP标记菌株的菌落形态观察和致病性测定
由图7可以看出,GFP标记菌株与野生型的菌落形态和大小略有差别,但差异不明显;其致病性与野生型菌株也无明显差别,均能引起典型坏死斑(图8),说明本试验用GFP标记CC004菌株获得成功。
3 讨论与结论
本研究结果表明,经转化的菌株在选择压为80 μg/mL的Hm B 平板中央都长出了菌落,几乎都能发出绿色荧光,转化成功率约100%。然而,在培养基边缘,尤其是培养皿壁上长出的菌落基本上都不发光,可能与倒平板时在边缘或壁上产生的冷凝水不含Hm B有关。因此,建议筛选时应以平板中央为主,或涂板时注意,要尽量在平板中央小范围涂抹,以免溅入冷凝水中生长,造成假阳性。
人们普遍采用含绿色荧光蛋白基因gfp的载体如pCT74转化目标菌的方法来标记目标菌[9-10,12],但其随机性强,有可能会将gfp基因插入到目标菌的一些功能基因组上而破坏了这些基因的正常表达和调控,进而影响到后续研究数据的准确性。rDNA-ITS序列是真核生物核糖体上5.8 S rDNA和18 S rDNA之间的插入间隔序列,为冗余功能的保守重复序列。本研究利用定点突变改造ITS序列后,构建了gfp标记载体pITGH,借助该载体上两侧的ITS部分序列,通过同源重组将hygB::gfp基因标记到CC004菌株的ITS序列上,不仅充分利用了ITS多拷贝、易克隆等优点、提高了标记成功率,同时又降低了因随机插入产生不良影响的概率,所获得的标记菌株更能代表野生型菌株的原始特性,值得推荐。
参考文献
[1] Pu J J, Zhang X, Qi Y X, et al. First record of Corynespora leaf fall disease of Hevea rubber tree in China[J]. Australasian Plant Disease Notes, 2007, 2(1): 35-36.
[2] Farr D, Rossman A Y, Palm M E, et al. Fungal databases[OL]. Systematic Botany & Mycology Laboratory, ARS, USDA. Retrieved Dec 13 2007, from Http://nt.arsgrin.gov/fungaldatabases/., 2014-06-15.
[3] 刘晓妹. 巴西橡胶树棒孢霉落叶病病菌MAPK基因(CCK1)和毒素基因(ct)克隆与功能鉴定[D]. 海口: 海南大学, 2012.
[4] 漆艳香. 中国巴西橡胶树棒孢霉落叶病病原学研究[D]. 南宁: 广西大学, 2010.
[5] 王延丽, 林春花, 时 涛, 等. 巴西橡胶树棒孢霉落叶病菌Hogl同源基因的克隆和序列分析[J].热带作物学报, 2013, 34(3): 424-428.
[6] Barthe P, Pujade-Renaud V, Breton F, et al. Structural analysis of cassiicolin, a host-selective protein toxin from Corynespora cassiicola[J]. Journal of Molecular Biology, 2007, 367(1): 89-101.
[7] 蒋 明, 吕枷薪, 黄余磊, 等. 绿色荧光蛋白在植物病理学研究中的应用[J]. 植物保护, 2011, 37(5): 39-43.
[8] Lorang J M, Tuori R P, Martinez J P, et al. Green fluorescent protein is lighting up fungal biology[J]. Applied and Environmental Microbiology, 2001, 67(5): 1 987-1 994.
[9] 张 俊, 吕延超, 刘晓妹, 等. 芒果尖孢炭疽病病原菌的绿色荧光蛋白基因标记[J]. 热带作物学报, 2011, 32(9): 1 708-1 710.
[10] 吕延超, 蒲金基, 谢艺贤, 等. 绿色荧光蛋白基因标记芒果畸形病病原菌研究[J]. 广东农业科学, 2010(8): 194-195.
[11] Li C Y, Chen S, Zuo C W, et al. The use of GFP-transformed isolates to study infection of banana with Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2011, 131(2): 327-340.
[12] 李春强, 梁慧施, 夏亦荠, 等. GFP标记的尖孢镰刀菌西瓜专化型侵染西瓜过程观察[J]. 热带作物学报, 2011, 32(10): 1 935-1 939.
[13] 殷晓敏, 徐碧玉, 郑 雯, 等. 香蕉枯萎病菌侵染香蕉根系的组织学过程[J]. 植物病理学报, 2011, 41(6): 570-575.
[14] 潘 波. 水稻品种抗稻曲病鉴定和病菌酰胺酶基因的克隆及原核表达[D]. 长沙: 湖南农业大学, 2012.
[15] 徐 明, 桂月晶, 祁伟彦, 等. 绿色荧光蛋白基因标记棉花黄萎病菌[J]. 植物保护, 2013, 39(5): 128-133.
[16] 魏中仁. 西瓜细菌性果斑病菌的GFP基因标记及在西瓜体内的定殖[D]. 福州: 福建农林大学, 2013.
[17] 张运峰.玉米大斑病菌STK1基因对附着胞发育和渗透胁迫的调控及其细胞学定位载体构建[D]. 保定: 河北农业大学, 2009.
[18] 李 亚. 稻瘟病菌四个LIM蛋白编码基因及Gγ亚基编码基因的生物学功能研究[D]. 杭州: 浙江大学, 2013.
