日本兽用抗菌药耐药性监控系统及风险管理
2015-04-27马苏张晶杜昕波
马苏,张晶,杜昕波
(1.中国兽医药品监察所,北京100081;2.中国农业大学动物医学院,北京100193)
日本兽用抗菌药耐药性监控系统及风险管理
马苏1,2,张晶1,杜昕波1
(1.中国兽医药品监察所,北京100081;2.中国农业大学动物医学院,北京100193)
介绍日本兽用抗菌药耐药性监控系统并分析日本食品动物源细菌耐药现状和抗菌药使用情况,以期为我国动物源细菌耐药性监控管理提供参考和借鉴。
日本;兽用抗菌药;耐药性;监控
随着集约化、规模化养殖业的快速发展,细菌感染性疾病对畜牧养殖业的发展造成了严重的经济损失。抗菌药被广泛用于感染的控制。一些报告显示许多动物源细菌开始对这些抗菌药产生耐药性。抗菌药耐药性细菌日益增多,不仅给动物健康带来不良影响,对公共卫生也带来严重问题。由于无法获得全国范围内动物源细菌耐药性相关数据,日本于1999年建立了兽用抗菌药耐药性监控系统(The Japanese Veterinary Antimicrobial Resistance Monitoring System,JVARM),对食品动物(牛、猪、鸡)中大肠杆菌、沙门氏菌等耐药性进行监控。本文介绍日本兽用抗菌药耐药性监控系统及风险管理,以期为我国动物源细菌耐药性监控管理提供借鉴。
1 JVARM的建立背景及目标
1.1 背景 1969年,Swann[1]总结了农业领域抗菌药的使用,建议对动物源、动物产品和人源细菌包括其抗菌药耐药性,进行定期、广泛监测。近年来,人们越来越关心食品动物使用抗菌剂与细菌耐药性在食品链中出现的关系,许多国际会议都以此为主题[2-4]。在日本,为了稳定和改进人们的生活方式,发展国家经济,1999年建立了关于食品、农业和农村领域的基本法律。该法旨在改进食品卫生和质量管理,确保食品安全,并改善食品质量。随着该法的颁布实施,兽用抗菌药耐药性监控系统的建立被提上了日程。
1.2 目标 JVARM的目标是监控食品动物中细菌抗菌药耐药性状况和动物用抗菌药的消费量。此外,其目的还在于确定在食品动物中使用抗菌药的效力,促进抗菌药的谨慎使用并查明公共卫生问题。
2 JVARM的职责框架
JVARM(图1)由3个部分组成:动物使用抗菌药的监测;从健康动物中分离人畜共患菌和指示菌耐药性的监测;从患病动物中分离致病菌耐药性的监测。日本农林渔业部(Ministry of Agriculture,Forestry and Fisheries,MAFF)负责动物养殖领域,但不负责食品卫生。因此,所检测的细菌均分离于食品动物养殖场,而不是食品产品。
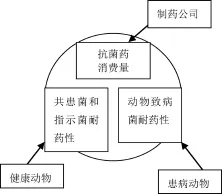
图1 JVARM的职责框架
2.1 抗菌药消费量的监测 抗菌药消费量监测系统如图2所示。根据日本药事法规定,制药公司每年需向国家兽医分析实验室(NVAL)提交生产和进口动物用抗菌药相关数据。NVAL随后汇总、分析和评估这些数据,由MAFF总部在每年度“动物使用药物量和准药品量”报告中公布这些数据。对抗菌药消费量的统计仅包括动物使用的治疗抗菌药,并按照动物种类细分。然而,鉴于一种抗菌剂通常会用于多种动物,因此所收集的数据只是对每个目标物种药物消费量的估算。

图2 抗菌药消费量的监控
2.2 细菌耐药性监控 日本不断收集细菌进行耐药性检测,包括从健康动物中分离的人畜共患菌和指示菌,从患病动物中分离的致病菌。其中人畜共患菌包括沙门氏菌、空肠弯曲菌和结肠弯曲菌;指示菌包括大肠杆菌、O157和粪肠球菌或屎肠球菌,以及耐万古霉素肠球菌。致病菌包括沙门氏菌、金黄色葡萄球菌、胸膜肺炎放线菌、化脓性放线杆菌、多杀性巴氏杆菌、链球菌属和克雷伯菌属细菌。检测的共患菌和指示菌从牛、猪、肉鸡和蛋鸡的粪便样本中分离。每年每个辖区从每种动物中分离6个样本。每个样本收集2株细菌用于药敏试验。检测的致病菌从疾病诊断提交的样本中分离。通过琼脂扩散法检测细菌的MIC。琼脂扩散法按照国家临床试验标准化委员会(CLSC)要求进行[5]。
3 JVARM系统介绍
3.1 JVARM的实施 如图3所示。参加JVARM的共有195个家畜卫生服务中心(LHSC),隶属于县办事处。LHSC作为JVARM的参与实验室,负责分离和鉴定目标细菌,检测细菌MIC。LHSC将检测结果和耐药性细菌报送至JVARM的参考实验室NVAL。NVAL负责保存耐药细菌,汇总和分析所有数据并报告至MAFF总部。此外,NVAL还进行分子流行病学和细菌耐药机理的研究。
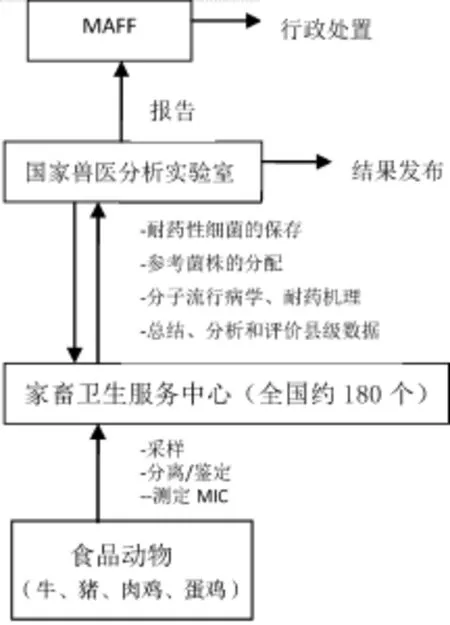
图3 细菌耐药性的监控
3.2 质量保证/质量控制系统 参与执行药敏试验的实验室实行质量管理,进行质量控制,有助于监控检测过程、相关试剂性能和人员的精确性和准确性。参与的实验室严格采取标准化技术收集可靠和可重复的数据。此外,NVAL每年举办关于抗菌药耐药性的全国性培训课程,对目标细菌分离、鉴定和药敏试验的标准化实验方法进行培训。近来,还在实验室间开展了主要细菌分离鉴定等能力验证。能力验证是保证JVARM参与试验室实验质量的基础,确保MIC数据报告准确无误。
3.3 数据的公布 由于抗菌药耐药性问题直接影响动物和人类健康,尽快发布抗菌药耐药性信息十分重要。日本官方通过3个步骤公布这些信息,首先通过MAFF周报“动物卫生新闻”,然后在科学期刊上发表,最后通过NVAL网页公布。
虽然JVARM开始于1999年,符合OIE关于抗菌药耐药性监测的相关要求[6-7],但仍需采取进一步措施来确保日本动物健康和公共卫生。
4 日本兽用抗菌药耐药性监控系统报告(2008-2011)
2013年,日本农林渔业部、国家兽医分析实验室联合发布了日本兽用抗菌药耐药性监控系统报告(2008-2011)[8],概述了从健康食品动物中分离的食源性细菌和指示菌的耐药趋势、其与抗菌药使用之间的关系,以及JVARM项目中耐药性细菌的流行状况。
4.1 日本用于治疗或生长促进剂使用的兽用抗菌药产品现状分析 表1中显示了2007~2010年日本的肉类动物屠宰量,数据从肉类和禽类屠宰场获得。在过去的10年里,除了牛肉,其他肉类动物产品的数量没有明显变化。虽然牛的屠宰量从1995年的150万下降到2003年的120万,但近3年来已经恢复。猪和禽的养殖规模虽然每年都有增加,但日本农场主的数量却因为竞争而有所下降。

表1 肉类和禽类屠宰场屠宰动物量 (1000头/只)
2004~2010年日本兽医药品的平均销售量大约为870吨。总体来说,动物用抗菌药的消费总量逐渐降低。相对于牛和禽类来说,猪使用抗菌药更为频繁。四环素类药物的消费量占兽用抗菌药总量的40%,由于严格控制氟喹诺酮和头孢类抗菌药的使用,其销售量不到1%。从20世纪50年代开始,抗菌药开始作为饲料添加剂使用。在日本,所用抗菌药饲料添加剂在上市前都必须进行国家检验。从2007年到2009年,总量相当稳定,平均171吨。2009年之后,总量有所上升,这主要与离子载体类药物的增加有关。离子载体类和多肽类药物占饲料添加剂的比例较大,分别为113吨(64.3%)和35吨(20.2%),而其他药物,包括四环素和大环内酯类分别为2.5吨(1.4%)和5.7吨(3.3%)。
4.2 耐药性监控
4.2.1 大肠杆菌 2008~2011年,JVARM共对2862株大肠杆菌分离株进行药敏试验,其中牛源1120株、猪源567株、肉鸡源582株、蛋鸡源593株。所有被测的抗菌药在这些菌株中都发现了耐药菌株。这些大肠杆菌分离株对大多数抗菌药的耐药率都比较稳定,对四环素(土霉素2008-2009;四环素2010-2011)、链霉素(二氢链霉素2008-2009;链霉素2011)和氨苄西林的耐药率较高。
总体来说,猪和肉鸡的大肠杆菌耐药率最高。猪源或肉鸡源大肠杆菌分离株对二氢链霉素(耐药率分别为50.7%和34.4%~40.8%)、链霉素(43.4%和28.6%)、土霉素(62.5%~65.2%和51.0%~73.1%)、四环素(58.6%~60.0%和47.2%~56.4%)、氨苄西林(22.1%~32.9%和42.1%~48.5%)、卡那霉素(6.9%~15.9%和12.3%~24.6%)、氯霉素(18.6%~26.1%和9.3%~16.2%)、甲氧苄啶(2008-2009,23.9%~32.6%和30.2%~32.3%)和磺胺甲恶唑(2010-2011,26.2%~27.1%和23.6%~25.6%)的耐药性最普遍。
4.2.2 沙门氏菌 2008~2011年,JVARM共分离688株沙门氏菌(牛源301株、猪源236株、鸡源151株)进行药敏试验。主要血清型有鼠伤寒沙门氏菌(244株,35.5%),霍乱沙门氏菌(85株,12.4%)和婴儿沙门氏菌(48株,7%)。在牛和猪中鼠伤寒沙门氏菌是主要血清型(分别为134/301,44.5%和108/236,45.8%)。在鸡中婴儿沙门氏菌是主要血清型(35/151,23.2%)。
除了恩诺沙星和环丙沙星外,分离的沙门氏菌对大部分测试的抗菌药都有耐药性。2008~2011年分离的沙门氏菌对主要抗菌药的耐药率都比较稳定。对四环素(土霉素2008-2009;四环素2010-2011)、二氢链霉素(2008-2009)和氨苄西林的耐药率较高。
总体来说,猪源沙门氏菌的耐药率最高。猪源沙门氏菌对二氢链霉素(93.5%~100%,2008-2009)、土霉素(72.7%~81.5%,2008-2009)、四环素(61.9%~71.2%,2010-2011)、氨苄西林(25.4%~47.8%)、卡那霉素(9.5%~27.3%)和氯霉素(6.8%~27.3%)、甲氧苄啶(27.3%~32.6%,2008-2009)和磺胺甲恶唑(25.4%~33.9%,2010-2011)的耐药性较普遍。猪源沙门氏菌对萘啶酸的耐药率居中(3.4%~20.7%),牛源和鸡源的耐药率较低(分别为0~7.4%和2.8%~10.5%)。没有发现耐恩诺沙星(2008-2009)和耐环丙沙星(2010-2011)的菌株。所有分离的动物源沙门氏菌均对头孢唑啉耐药,但耐药率较低(0~10%)。
5 日本耐药性相关抗菌药产品风险管理
5.1 抗菌药用于治疗和生长促进剂的管理 当前日本抗菌药物的使用总量比抗菌药饲料添加剂使用量大,因此,优先考虑兽用抗菌药物作为细菌耐药性的相关风险因素。在日本用于治疗目的的抗菌药产品,通过药事法来管理。该法旨在管理药物、准药物和医疗服务相关事务,以确保其在生产、制造(进口)、经营、零售和使用各环节的质量有效、安全。用于生长促进剂的抗菌剂产品,通过饲料安全和质量促进法来管理。相对于作为兽医药品使用的抗菌剂,抗菌药饲料添加剂在使用时的浓度更低,周期更长。因此,明确养殖动物在用于人类消费屠宰7 d前,不能使用抗菌剂生长促进剂。
5.2 抗菌剂兽药产品的批准及监测 在日本抗菌剂兽医药品批准进入市场有特殊的要求。抗菌剂兽医药品的批准需要以下数据:抗菌谱,近日田间分离靶细菌、指示菌和食源菌的药敏试验数据。鉴于公共卫生和动物健康问题,还要附加进行耐药性试验。批准用于食品动物的,还需要在自然环境下抗菌药基质稳定性相关数据。通常是由MAFF主持召开专业会议来评估数据。用于食品动物的还要通过食品安全委员会来评估。药事和食品卫生委员会是部级咨询组织,负责评估兽医药品的质量、有效性和安全性。只有一种兽医药品满足所有要求,MAFF部长才会批准该药品。对于对公共卫生特别重要的氟喹诺酮和第三代头孢这些特殊抗菌药,不能批准其用于动物,除非人类使用的相应药物再检验期结束。
在日本兽医药品上市后的监控分两个阶段:一是新型兽医药品的再检验,二是所有兽医药品的再评价。在新型兽医药品再检验期结束后,需要提交药品有效性、安全性和公共畜禽健康的相关田间调查数据。对于抗菌药,也要提交耐药性监控结果。对于所有批准的药物,MAFF根据要求进行有效性、安全性、残留和耐药性细菌的检验。
5.3 抗菌剂兽药产品的使用管理 大多数抗菌剂兽药产品是处方药,由兽医开具处方并控制其使用,从而确保畜禽产品中的药物含量不超过MRLs。对于标签、药物说明书都有明确的规定。说明书内容必须包括以下所有内容:①规定的药物;②指示的疾病和细菌种类;③给药途径、计量和使用管理期;④禁药期/休药期;⑤使用注意事项:如不良反应和处理事项;⑥如果是特殊抗菌药(氟喹诺酮和第三代头孢),还应包括该药不能作为第一选择使用的解释说明。销售后,药品销量和靶致病菌、食源性致病菌抗菌药耐药性监控数据必须提交至MAFF。
5.4 风险评估 动物使用抗菌剂产生细菌耐药性的风险评估,特别是人畜共患菌产生耐药性的风险评估由食品安全委员会(FSC)提供给MAFF。FSC建于2003年,是基于食品安全基本法建立的一个风险评估组织,独立于MAFF和卫生劳动福利部(MHLW)的风险管理。FSC根据OIE、CODEX和FDA建立的抗生素耐药性指导原则进行风险评估。
5.5 风险管理 日本依据FSC的风险评估实施风险管理,已经制定了管理指南以减少由食品动物和水产动物使用抗菌剂产生耐药性的风险。该指南的目的在于降低对人类健康的不良反应,内容涉及养殖动物用药的风险管理抉择。在日本风险管理战略是逐步建立的。首先,根据FSC的风险评估结果考虑现有和可能的风险管理抉择。在扩大公布评估结果时,尤其应考虑确定风险管理抉择,并谨慎公布高风险评估。其次,需考虑批准的每种靶动物和给药途径的全部因素,才能确定风险评估抉择。必要时,还应进行包括公共评论程序的风险交流。根据适合的抗菌药耐药性风险管理指南建立兽用抗菌剂风险管理策略时,还应考虑到养殖业中使用抗菌剂的风险和利益。
在日本动物养殖中必须使用兽用抗菌剂。在现有条件下,细菌病和病毒病如口蹄疫、禽流感不断爆发,临床兽医必须使用不同种类的抗菌剂来治疗发生的流行病和突发疾病。因此亟需对耐药性相关抗菌药产品进行风险管理。目前,日本正在对牛和猪中使用氟喹诺酮、猪中使用托拉霉素、奶牛中使用吡利霉素的耐药性进行风险分析。
[1] Swann M M.Report of the joint committee on the use of antibiot⁃ics in animal husbandry and veterinary medicine[R].London:Her Majesty’s Stationary Office(HMSO).1969.
[2] Office International desÉpizooties.The use of antibiotics in animals ensuring the protection of public health[R].Paris:Proceeding of European Scientific Conference.1999.
[3] World Health Organization.The medical impact of the use of antimicrobials in food animals[R].Berlin:Report of WHO meeting.1997.
[4] World Health Organization.Use of quinolones in food animals and potential impact of human health[R].Geneva:Report of WHO meeting.1998.
[5] Shryock T R,Apley M,Jones R N,et al.Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals[S].
[6] Franklin A,Acar J,Anthony F,et al.Antimicrobial resistance:harmonisation of national antimicrobial resistance monitoring and surveillance programmes in animals and in animal-derived food[J].Rev Sci Tech Off Int Epiz,2001,20(3):859-870.
[7] WhiteD G,Acar J,Anthony F,et al.Antimicrobial resistance:standardisation and harmonisation of laboratory methodologies for the detection and quantification of antimicrobial resistance[J].Rev Sci Tech Off Int Epiz,2001,20(3):849-858.
[8] http://www.maff.go.jp/nval/tyosa_kenkyu/taiseiki/pdf/jvarm2008_ 2011.pdf[OB/OL].
(编辑:侯向辉)
The Japanese Veterinary Antimicrobial Resistance Montitoring System and Risk Management
MA Su1,2,ZHANG Jing1,DU Xin-bo1
(1.China Institute of Veterinary Drug Control,Beijing 100081,China;2.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China)
This paper introduced the Japanese veterinary antimicrobial resistance monitoring systems(JVARM).The purpose of this study was to analyze the antimicrobial resistance in bacteria in food-producing animals and the consumption of antimicrobial drugs used in animals in Japan,which should be used for reference during the surveillance and management of antimicrobial resistance from animal source in China.
Japanese;veterinary antimicrobial drug;resistance;monitor
2015-01-23
A
1002-1280(2015)05-0058-04
S851.66
马苏,硕士,从事兽药监察管理工作。E-mail:happyms@163.com
