欧前胡素增强多柔比星对HeLa细胞的抗肿瘤效应
2015-04-27浙江省立同德医院妇产科检验科浙江杭州300
郑 颖,姜 凯(浙江省立同德医院妇产科,检验科,浙江杭州300)
欧前胡素增强多柔比星对HeLa细胞的抗肿瘤效应
郑颖1△,姜凯2
(浙江省立同德医院1妇产科,2检验科,浙江杭州310012)
[摘要]目的:研究欧前胡素是否能提高宫颈癌HeLa细胞株对多柔比星的敏感性。方法: MTT法检测HeLa细胞用欧前胡素和多柔比星处理后的活力。Western blot检测HeLa细胞用欧前胡素和多柔比星处理后Bcl-2蛋白家族成员(Mcl-1、Bcl-2、Bcl-xL、Bad和Bax)的表达水平。流式细胞术检测HeLa细胞用欧前胡素和多柔比星处理后的凋亡水平和线粒体膜电位的变化情况。构建Mcl-1真核表达载体,MTT法检测Mcl-1表达载体转染对欧前胡素联合多柔比星治疗宫颈癌效果的影响。结果:欧前胡素在体外可显著提高多柔比星对宫颈癌细胞系HeLa的杀伤活性。欧前胡素可显著降低HeLa细胞Mcl-1的表达,而多柔比星对Mcl-1的表达水平无影响。相比于欧前胡素或多柔比星单治疗组,两者联合可显著诱导HeLa细胞发生凋亡并降低其线粒体膜电位。体外转染Mcl-1真核表达载体显著降低多柔比星联合欧前胡素对HeLa细胞的杀伤活性。结论:欧前胡素通过靶向于Mcl-1增强多柔比星对宫颈癌细胞的杀伤活性。
[关键词]欧前胡素;多柔比星; Mcl-1;宫颈癌
1000-4718(2015) 09-1578-06
[修回日期]2015-06-05
宫颈癌是全球发病率第2位的妇科肿瘤,每年有超过50万患者被诊断为宫颈癌,好发于40岁以上女性,手术和化疗目前仍是治疗宫颈癌的主要手段[1]。多柔比星是目前最主要的抗肿瘤药物之一,能有效治疗肺癌、宫颈癌、前列腺癌等[2-3]。以多柔比星为主的化疗方案在肿瘤治疗中越来越被重视,然而随着多柔比星的反复使用,肿瘤细胞将逐渐对其产生耐药,且药物的心脏毒性也渐渐凸显,因此目前亟待解决的问题就是如何选用最佳的辅助药物以取得最好的疗效并降低多柔比星的耐药性[4]。欧前胡素是一种呋喃香豆素类化合物,是从中药白芷中提取的主要活性成分[5]。现在临床上主要用于抗炎症、抗凝血、抑制心肌肥厚等[6-7]。最近有文献报道欧前胡素还有一定的抗肿瘤作用,能抑制肿瘤细胞的增殖,阻碍其细胞周期,甚至可直接诱导肿瘤细胞发生凋亡[8-9]。然而欧前胡素单独用药的疗效并不十分理想[10]。因此本文的目的在于研究中药欧前胡素是否能提高宫颈癌细胞对多柔比星的敏感性。
材料和方法
1实验材料
多柔比星、欧前胡素、MTT和Annexin V凋亡试剂盒购于Sigma; DMEM培养基、胎牛血清购于Gibco;细胞蛋白提取液购于江苏碧云天;人Mcl-1、Bcl-2、Bcl-xL、Bad、Bax及β-actin多克隆抗体购于CST; TRIzol试剂、逆转录试剂盒、pcDNA3.1、Lipofectamine 2000购于Invitrogen; SYBR Green试剂购于日本TaKaRa; ECL试剂盒购于Pierce; 5,5’,6,6’-四氯-1,1’,3,3’-四乙基苯并咪唑羰花青碘化物(JC-1)购于Molecular Probes。各PCR引物由上海生工生物工程有限公司合成。
2主要方法
2.1细胞培养人宫颈癌细胞系HeLa购于ATCC。HeLa细胞系培养在含10%胎牛血清的DMEM培养基中,在37℃恒温培养箱中培养,通入5% CO2。
2.2MTT法检测HeLa的细胞活力及多柔比星对HeLa的半数抑制浓度(IC50)将HeLa细胞按每孔5×103接种在96孔板上孵育12 h。之后将欧前胡素和多柔比星加入培养体系中孵育48 h。加入20 mL MTT (5 g/L)培养4 h,移除孔内培养基,加入100 μL DMSO,振荡后在570 nm波长下测定吸光度(A)。相对细胞活力用实验组与对照组的A值的比值表示。IC50根据多柔比星浓度与相对细胞活力曲线确定。
2.3Real-time PCR检测Mcl-1的表达宫颈癌细胞系HeLa总RNA用TRIzol试剂提取。cDNA用逆转录试剂盒按操作说明步骤由总RNA合成。Mcl-1的定量PCR扩增使用SYBR Green试剂,GAPDH作为内参照,Mcl-1的相对表达由2-ΔΔCt法计算[11]。Mcl-1的上游引物为5’-TGGCTAAACACTTGAAGACC-3’,下游引物为5’-GGAAGAACTCCACAAACCC-3’; GAPDH的上游引物为5’-CCACTCCTCCACCTTTG-3’,下游引物为5’-CACCACCCTGTTGCTGT-3’。
2.4Western blot实验药物处理后,收集HeLa细胞,用蛋白裂解液进行细胞裂解,提取总蛋白质。将蛋白提取液用12.5%的SDS-PAGE进行分离,将电泳分离胶通过电转方法将蛋白质转到PVDF膜上,用Mcl-1、Bcl-2、Bcl-xL、Bad、Bax或β-actin多克隆抗体孵育过夜,之后再用带辣根过氧化物酶的II抗孵育2 h,蛋白条带用ECL试剂盒显色发光。
2.5HeLa细胞凋亡的检测将HeLa细胞用欧前胡素和多柔比星处理24 h,收集细胞,按照凋亡检测试剂盒说明书操作步骤将细胞用Annexin V和碘化丙啶(PI)室温孵育15 min,用流式细胞术检测细胞凋亡情况。
2.6线粒体膜电位(ΔΨm)的检测将HeLa细胞接种在6孔板中孵育12 h。换新鲜培养基后加入欧前胡素和多柔比星继续处理HeLa细胞24 h,收集细胞,加入5 μmol/L JC-1 37℃孵育20 min,用流式细胞术检测细胞线粒体膜电位。正常细胞发生红色荧光,膜电位越低,红色荧光越弱[12]。
2.7质粒构建及转染以HeLa细胞的cDNA为模板,将Mcl-1的开放阅读框架以分子克隆的方法与pcDNA3.1连接后构建成pcDNA3.1-Mcl-1重组真核表达质粒[13]。待HeLa细胞生长到铺满培养瓶约80%密度后,将pcDNA3.1-Mcl-1质粒(2 mg/L)用Lipofectamine 2000试剂按照试剂说明书步骤转染入HeLa细胞中。
3统计学处理
实验数据用均数±标准差(mean±SD)表示,用SPSS 12.0统计分析软件进行处理,实验重复3次,采用非配对双侧t检验进行组间分析,以P<0.05为差异有统计学意义
结果
1欧前胡素增强多柔比星对HeLa细胞的杀伤活性
欧前胡素单独作用对HeLa细胞的抑制作用不强,欧前胡素需超过80 μmol/L时才能显著抑制He-La细胞的细胞活力(图1)。选择低浓度10 μmol/L欧前胡素与多柔比星一起联合治疗HeLa细胞,结果发现低浓度的欧前胡素可显著提高多柔比星对He-La细胞的杀伤活性并显著降低HeLa细胞对多柔比星的IC50(图2)。
2欧前胡素抑制HeLa细胞Mcl-1的表达
欧前胡素(10 μmol/L)可显著降低HeLa细胞Mcl-1的表达,但对其它Bcl-2家族蛋白(Bcl-2、BclxL、Bad和Bax)无影响,多柔比星(4 μmol/L)对He-La细胞Mcl-1的表达亦无影响(图3)。
3欧前胡素增强多柔比星对HeLa细胞凋亡的诱导效应

Figure 1.The relative viability of HeLa cells treated with various concentrations of imperatorin.Mean±SD.n=3.*P<0.05 vs 0 μmol/L group.图1不同浓度欧前胡素对HeLa细胞活力的影响
低浓度的欧前胡素(10 μmol/L)和多柔比星(4 μmol/L)单治疗组HeLa细胞的凋亡水平差异不显著。然而将两者联合使用后,对HeLa细胞的凋亡诱导效应显著提升(图4),表明欧前胡素和多柔比星存在药物协同效应。
4欧前胡素促进多柔比星的抗肿瘤效应是通过下调Mcl-1起作用
MTT实验结果发现外源性Mcl-1的强制表达可显著抑制欧前胡素(10 μmol/L)对多柔比星(4 μmol/L)的协同效应(图5)。另外,相比于欧前胡素(10 μmol/L)和多柔比星(4 μmol/L)单治疗组,两者联合能显著诱导HeLa细胞线粒体膜电位的下降,而外源性Mcl-1可阻止ΔΨm的降低(图6)。
讨论

Figure 2.Imperatorin enhanced the cytotoxicity of doxorubicin to HeLa cells.Mean±SD.n=3.*P<0.05 vs doxorubicin group.图2欧前胡素增强多柔比星对HeLa细胞的杀伤活性
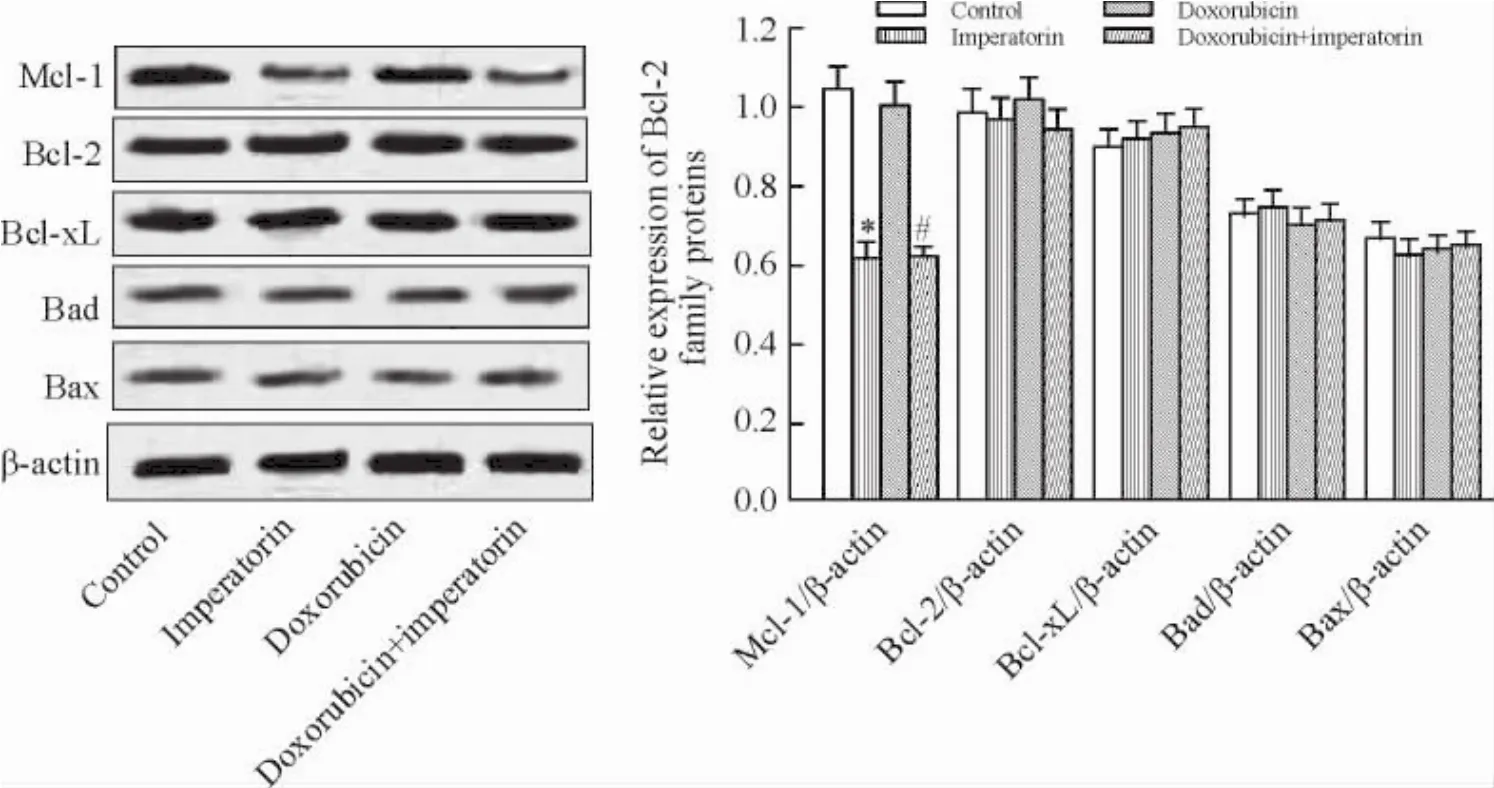
Figure 3.Imperatorin down-regulated the expression of Mcl-1 in the HeLa cells.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs doxorubicin group.图3欧前胡素下调HeLa细胞Mcl-1的表达水平

Figure 4.Imperatorin increased the apoptotic rate of HeLa cells induced by doxorubicin.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs doxorubicin group.图4欧前胡素增强多柔比星对HeLa细胞的凋亡诱导效应
尽管多柔比星是目前治疗肿瘤的一线化疗药物,然而在经过重复用药后,肿瘤细胞往往通过减少多柔比星的转运摄取、增加DNA修复能力、降低凋亡率等机制产生对多柔比星的耐药性[14-15]。为了克服这一局限性,在进行多柔比星化疗的基础上,再联合另外一种药物以减弱肿瘤细胞对多柔比星的耐药显得十分重要。在本研究中,作者发现虽然低剂量欧前胡素的直接抗宫颈癌作用比较弱,但却可显著提升一线化疗药物多柔比星对HeLa的杀伤活性,表明中药欧前胡素可与多柔比星发挥协同治疗作用。
Bcl-2蛋白家族包括促凋亡成员和抗凋亡蛋白成员(如Mcl-1、Bcl-2、Bcl-xL、Bad和Bax等),这些蛋白的相对表达水平决定了细胞是否进入凋亡程序[16]。Mcl-1是Bcl-2蛋白家族中的抗凋亡蛋白成员,包含3个BH(Bcl-2 homology)位点。Mcl-1蛋白定位于细胞线粒体膜上,通过与促凋亡蛋白Noxa、Puma、Bim、Bid等结合,使它们失活从而发挥抗细胞凋亡作用[17]。因此,Mcl-1的过表达有助于保护细胞逃避凋亡信号,包括宫颈癌在内的多种肿瘤,其Mcl-1的表达水平均显著上调[18]。Wei等[19]发现敲除Mcl-1基因后,胰腺癌细胞可发生自发性凋亡,且其对化疗药物吉西他滨的敏感性显著增强,可见由于Mcl-1的抗凋亡作用,高表达的Mcl-1成为肿瘤细胞抵抗化疗药物杀伤活性的重要机制[20],Mcl-1基因已经成为肿瘤治疗的新靶点。

Figure 5.Imperatorin enhanced the cytotoxicity of doxorubicin to HeLa cells via down-regulating Mcl-1 expression,and this effect was inhibited by the transfection of pcDNA3.1-Mcl-1 plasmid.Mean±SD.n=3.*P<0.05 vs pc-DNA3.1-empty.图5欧前胡素通过下调Mcl-1的表达增强多柔比星对He-La细胞的杀伤活性
在本研究中,我们发现欧前胡素能显著降低He-La细胞Mcl-1的表达水平,而多柔比星对Mcl-1基因的表达无影响,因此我们推测欧前胡素增强多柔比星抗宫颈癌活性的机制可能和Mcl-1有关。为了验证这一观点,我们将外源性Mcl-1通过质粒在HeLa细胞中强制高表达,之后发现欧前胡素对多柔比星的协同抗肿瘤作用丧失,证实了欧前胡素增强多柔比星抗肿瘤活性的机制可能和下调Mcl-1表达水平有关。由于Mcl-1的表达水平和凋亡密切相关,而凋亡的诱导往往和线粒体的失能有关[21]。我们进一步发现欧前胡素联合多柔比星能显著降低HeLa细胞的线粒体膜电位,提示欧前胡素促进多柔比星引起的凋亡诱导效应的机制可能是通过下调宫颈癌细胞Mcl-1的表达,进而引起线粒体膜电位丧失,诱导细胞发生线粒体途径的凋亡。综上所述,欧前胡素-Mcl-1-线粒体途径与多柔比星的抗宫颈癌活性密切相关,它可能成为肿瘤化疗的一个新的靶点。
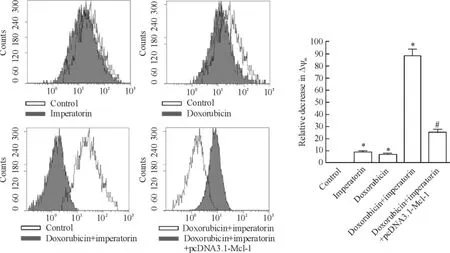
Figure 6.Doxorubicin plus imperatorin significantly decreased the ΔΨmin the HeLa cells,and this effect was inhibited by the transfection of pcDNA3.1-Mcl-1 plasmid.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs doxorubicin+ imperatorin group.图6多柔比星联合欧前胡素显著降低HeLa细胞的线粒体膜电位
[参考文献]
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1) : 11-30.
[2]Orzechowska EJ,Girstun A,Staron K,et al.Synergy of BID with doxorubicin in the killing of cancer cells[J].Oncol Rep,2015,33(5) : 2143-2150.
[3]曾小平,王红梅,黄永红,等.阿霉素联合致敏树突状细胞对荷宫颈癌小鼠的治疗作用[J].中国病理生理杂志,2013,29(4) : 734-738.
[4]Wang Z,Yang L,Xia Y,et al.Icariin enhances cytotoxicity of doxorubicin in human multidrug-resistant osteosarcoma cells by inhibition of ABCB1 and down-regulation of the PI3K/Akt pathway[J].Biol Pharm Bull,2015,38 (2) : 277-284.
[5]Appendino G,Bianchi F,Bader A,et al.Coumarins from Opopanax chironium.New dihydrofuranocoumarins and differential induction of apoptosis by imperatorin and heraclenin[J].J Nat Prod,2004,67(4) : 532-536.
[6]García-Argáez AN,Ramírez Apan TO,Parra Delgado H,et al.Anti-inflammatory activity of coumarins from Decatropis bicolor on TPA ear mice model[J].Planta Med,2000,66(3) : 279-281.
[7]Zhang Y,Cao Y,Zhang Y,et al.Furanocoumarins-imperatorin inhibits myocardial hypertrophy both in vitro and in vivo[J].Fitoterapia,2010,81(8) : 1188-1195.
[8]Choochuay K,Chunhacha P,Pongrakhananon V,et al.Imperatorin sensitizes anoikis and inhibits anchorage-independent growth of lung cancer cells[J].J Nat Med,2013,67(3) : 599-606.
[9]Luo KW,Sun JG,Chan JY,et al.Anticancer effects of imperatorin isolated from Angelica dahurica: induction of apoptosis in HepG2 cells through both death-receptor-and mitochondria-mediated pathways[J].Chemotherapy,2011,57(6) : 449-459.
[11]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4) : 402-408.
[12]Prathapan A,Vineetha VP,Raghu KG.Protective effect of Boerhaavia diffusa L against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells[J].PLoS One,2014,9(4) : e96220.
[13]Sun JG,Xiang J,Zeng XL,et al.Clitocine induces apoptosis and enhances the lethality of ABT-737 in human colon cancer cells by disrupting the interaction of Mcl-1 and Bak[J].Cancer Lett,2014,355(2) : 253-263.
[14]Wang T,Huang B,Lei X,et al.A let-7b binding site SNP in the 3’-UTR of the Bcl-xL gene enhances resistance to 5-fluorouracil and doxorubicin in breast cancer cells [J].Oncol Lett,2015,9(4) : 1907-1911.
[15]Kang Q,Yan S.Piperlongumine reverses doxorubicin resistance through the PI3K/Akt signaling pathway in K562/A02 human leukemia cells[J].Exp Ther Med,2015,9 (4) : 1345-1350.
[16]Zhao J,Li X,Zou M,et al.miR-135a inhibition protects A549 cells from LPS-induced apoptosis by targeting Bcl-2 [J].Biochem Biophys Res Commun,2014,452 (4) : 951-957.
[17]Thomas LW,Lam C,Edwards SW.Mcl-1: the molecular regulation of protein function[J].FEBS Lett,2010,584 (14) : 2981-2989.
[18]Pignochino Y,Grignani G,Cavalloni G,et al.Sorafenib blocks tumour growth,angiogenesis and metastatic potential in preclinical models of cervical cancer through a mechanism potentially involving the inhibition of ERK1/2,MCL-1 and ezrin pathways[J].Mol Cancer,2009,8: 118.
[19]Wei SH,Dong K,Lin F,et al.Inducing apoptosis and enhancing chemosensitivity to gemcitabine via RNA interference targeting Mcl-1 gene in pancreatic carcinoma cell [J].Cancer Chemother Pharmacol,2008,62(6) : 1055-1064.
[20]Michels J,Obrist F,Vitale I,et al.MCL-1 dependency of cisplatin-resistant cancer cells[J].Biochem Pharmacol,2014,92(1) : 55-61.
[21]Zhang XJ,Mei WL,Tan GH,et al.Strophalloside induces apoptosis of SGC-7901 cells through the mitochondrion-dependent caspase-3 pathway[J].Molecules,2015,20(4) : 5714-5728.
(责任编辑:林白霜,罗森)
Antitumor effect of imperatorin enhances cytotoxicity of doxorubicin to HeLa cells
ZHENG Ying1,JIANG Kai2
(1Department of Obstetrics&Gynaecology,2Department of Laboratory Medicine,Tongde Hospital of Zhejiang Province,Hangzhou 310012,China.E-mail: tongdezhengying@163.com)
[ABSTRACT]AIM: To determine whether imperatorin would enhance the effect of doxorubicin therapy on cervical cancer in vitro.METHODS: The viability of HeLa cells treated with imperatorin and doxorubicin was determined by MTT assay in vitro.The expression of Bcl-2 protein family (Mcl-1,Bcl-2,Bcl-xL,Bad and Bax) in HeLa cells treated with imperatorin and doxorubicin was evaluated by Western blot analysis.The apoptosis and mitochondrial membrane potential (ΔΨm) in the HeLa cells treated with imperatorin and doxorubicin were analyzed by flow cytometry.A Mcl-1 expression vector was constructed,and its role in the cytotoxicity of imperatorin plus doxorubicin to HeLa cells was detected by MTT assay.RESULTS: Addition of imperatorin significantly enhanced the cytotoxicity of doxorubicin to HeLa cells in vitro.Mcl-1 expression was down-regulated by imperatorin but was not influenced by doxorubicin in the HeLa cells.A combination of imperatorin and doxorubicin induced apoptosis and ΔΨmcollapse more significantly compared with the treatment with imperatorin or doxorubicin alone.Furthermore,the imperatorin-induced sensitization for doxorubicin cytotoxicity to HeLa cells was abolished by the transfection with Mcl-1 expression plasmid.CONCLUSION: The combination of doxorubicin with imperatorin enhances the antitumor effect of doxorubicin on cervical cancer cells via targeting Mcl-1.
[KEY WORDS]Imperatorin; Doxorubicin; Mcl-1; Cervical cancer
通讯作者△Tel: 0571-89972339; E-mail: tongdezhengying@163.com
[收稿日期]2015-04-13
[中图分类号]R730.23; R735.7
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.008
[文章编号]1000-4718(2015)09-1578-06
