当归多糖对血管型痴呆低糖低氧PC12细胞凋亡的影响
2015-04-26邓健男曾静玲李海龙杨植媛杨长生
邓健男,曾静玲,李海龙,杨植媛,杨长生
(1.武汉市中医医院,湖北 武汉430100;2.甘肃中医学院,甘肃 兰州730000)
当归多糖对血管型痴呆低糖低氧PC12细胞凋亡的影响
邓健男1,曾静玲1,李海龙2,杨植媛2,杨长生2
(1.武汉市中医医院,湖北 武汉430100;2.甘肃中医学院,甘肃 兰州730000)
目的:观察当归多糖 (Angelica Sinensis Polysaccharide ride,ASP ) 对低亚硫酸钠诱导的低糖低氧PC12细胞模型的影响,探讨当归多糖影响细胞凋亡的作用机制。方法:将体外培养的大鼠肾上腺嗜铬肿瘤细胞(PCl2细胞)分为空白对照组、OGD(oxygen-glucose deprivation)模型组、当归多糖组,采用MTT法检测各组细胞存活率,采用比色法检测LDH、T-SOD、MDA酶学指标,采用流式细胞仪检测细胞凋亡率,采用RT-PCR检测Bax和Bcl-2表达情况。结果:缺糖缺氧损伤组细胞存活率均显著低于空白对照组(P<0.05),各剂量当归多糖组细胞存活率均高于损伤组,且200μg·L-1浓度的当归多糖组细胞存活率最高,差异均具有统计学意义(P<0.05)。结论:当归多糖可提高LDH、T-SOD活性,降低MDA含量,有效降低细胞凋亡率,可不同程度地保护PC12细胞。
当归多糖;血管型痴呆;细胞凋亡
细胞缺糖缺氧(Oxygen-Glucosedeprivation,OGD)损伤多见于脑缺血、心肌缺血等缺血性损伤疾病。ODG是血管性痴呆(Vascular dementia,VD)的典型症状,其发生发展与神经细胞所处的OGD环境有密切关系。坏死和凋亡是缺血性神经细胞损伤的两种主要形式。当归作为中医圣药,含有阿魏酸、藁本内酯、当归多糖等多种成分,对免疫系统、循环系统、呼吸系统、血液系统等均有一定的药理作用[1-2]。笔者选择当归多糖进行研究,尝试从酶学角度揭开当归治疗VD的机制。
1 材料与仪器
PC-12细胞(上海中科院生物研究所);LDH、T-SOD、MDA试剂盒(南京建成生物工程研究所,批号:20110928);新生小牛血清(Gibco公司);DMEM培养基(Sigma公司,批号:20120430);低亚硫酸钠(天津精细化工有限公司,批号:20120405);Benchmark plus连续波长酶标仪(上海新振仪器设备有限公司);倒置显微镜(日本奥林巴斯光学株式会社,型号:IX71);COULTER EPICS XL流式细胞仪(美国beckman公司);CFX-96实时反应系统(美国博乐公司)。
2 方法
2.1 VD细胞模型制备和分组
参考石瑞丽等[3-4]方法稍加改进建立OGD模型,在CO2培养箱(37℃,5%CO2)中,采用含15%新生小牛血清的DMEM培养液培养PC12细胞,2~3天传代1次,取对数生长期细胞进行实验。将正常DMEM培养液(含15%的新生小牛血清)培养的PC12细胞作为正常对照组;在5%CO2、37℃培养箱中,将各组缺糖缺氧1、4、12h的PC12细胞模型组分别用含20mmol·L-1与40mmol·L-1低亚硫酸钠的无糖PBS液培养相应时间后作为模型组,测定相关指标。
2.2 四氮唑蓝比色法(MTT法)检测细胞活力
采用 MTT 法检测造模后PC12细胞的活力变化,待PC12细胞生长至对数生长期时,采用DMEM培养基将细胞浓度调至3×105个·mL-1。将上述各组细胞悬液分别以100μL/孔的计量滴入96孔培养板,设置正常细胞对照孔和调零孔,向调零孔中加入100μL DMEM完全培养基,向对照组孔中加入100μL细胞悬液。实验处理后各组每孔加入MTT 10μL,37℃孵育4h后移弃培养液,每孔加入150μL DMSO,振荡10min,使结晶物充分溶解。在570nm波长下,采用酶联免疫检测仪测定各孔光吸收值(OD值),记录结果。
2.3 生化法检测细胞培养上清液LDH、MDA和SOD含量
经损伤处理后,收集细胞上清液,参照试剂盒说明书,采用比色法于紫外可见分光光度计上检测上清液中LDH、MDA和SOD活性。
2.4 流式细胞术检测凋亡情况
采用Annexin V-FITC和PI双染流式细胞仪检测细胞凋亡情况,调整细胞计数为1×106个·mL-1,接种于T-50培养瓶中,参照试剂盒说明书进行检测,记录激发光波长为475nm处的荧光强度。
2.5 统计学方法

3 结果
3.1 细胞活力检测
采用MTT法检测细胞活力发现,与空白对照组比较,40mmol·L-1低亚硫酸钠1h模型组细胞存活率显著降低,差异具有统计学意义(P<0.05),但随着时间的延长,细胞存活率又有所回升,可能与造模剂的逐渐消耗有关;与模型组比较,各给药组细胞存活率均显著升高,差异具有统计学意义(P<0.05)。见表1。

表1 当归多糖对不同浓度低亚硫酸钠造模各组细胞存活率的影响 ±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.2 酶学指标检测
与模型组比较,各组细胞溶液MDA含量均显著降低,T-SOD酶、LDH酶活性显著增强,差异具有统计学意义(P<0.05)。与空白对照组比较,40mmol·L-1低亚硫酸钠模型组细胞MDA含量显著升高,T-SOD酶、LDH酶活性显著下降,组间比较差异具有统计学意义(P<0.05)。不同浓度的当归多糖作用于PC12细胞后,与模型组比较,200μg·L-1当归多糖组细胞MDA含量显著降低,T-SOD酶、LDH酶活性显著增强,差异具有统计学意义(P<0.05)。见表2。
3.3 细胞凋亡率检测
各剂量当归多糖组细胞存活率均高于损伤组,且200μg·L-1浓度当归多糖组细胞存活率最高,差异均具有统计学意义(P<0.05)。见图1。


组别LDH活力(U·mL-1)T-SOD活力(U·mL-1)MDA含量(nmol·mL-1)空白组68.39±5.131.45±0.073.31±0.4340mmol·L-1低亚硫酸钠组46.43±4.13*1.24±0.06*7.10±0.27*25μg·L-1组48.72±4.47#1.30±0.06#6.06±0.31#50μg·L-1组52.49±5.12#1.32±0.05#4.60±0.44#100μg·L-1组56.81±4.47#1.34±0.06#3.63±0.56#200μg·L-1组56.76±7.23#1.32±0.04#4.35±0.41#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。



图1 各浓度当归多糖对细胞凋亡率影响
3.4 RT-PCR检测Bax和Bcl-2的表达情况
随着剂量的增加,当归多糖给药组细胞Bax表达量逐渐降低,Bcl-2表达量逐渐升高,与空白组比较差异均具有统计学意义(P<0.05)。见表3。
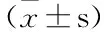

组别BaxBcl-2空白组0.85±0.031.05±0.0640mmol·L-1低亚硫酸钠造模组1.00±0.001.00±0.0025μg·L-1当归多糖组1.52±0.06△1.54±0.13△50μg·L-1当归多糖组1.39±0.05△2.16±0.23△100μg·L-1当归多糖组1.02±0.03△3.29±0.34△200μg·L-1当归多糖组0.93±0.02△7.07±0.47△
注:与空白组比较,△P<0.05。
4 讨论
脑缺血导致的神经元死亡类型包括坏死、凋亡和自噬三种[5],由于凋亡和自噬延迟发生,使其成为药物治疗的靶点,但自噬在其中的作用还存在争议[6]。缪春明等[7]通过对PC12细胞OGD损伤过程的研究发现,自噬和凋亡在细胞OGD损伤过程的早期和晚期分别占有主导地位。凋亡蛋白表达引起细胞死亡,凋亡造成的神经细胞大量丢失可能是VD发生的原因[8]。Bcl-2家族基因的表达和调控对细胞的凋亡有着至关重要的作用,其可通过多种通路参与细胞凋亡信号转导。Bax和Bcl-2是Bcl-2家族中最有代表性的促进凋亡和抑制凋亡的基因,其中Bax作为Bcl-2活性的主要调控因子,参与细胞凋亡进程[9]。
采用一定浓度的连二亚硫酸钠与培养液中的低浓度O2反应模拟缺氧环境,通过无糖PBS缓冲液模拟缺糖环境,可有效避免频繁开合培养箱导致的造模环境不稳的弊端,更方便有效地模拟ODG模型[3-4]。
最新研究表明,当归提取物以及当归组成的复方补阳还五汤对血管性痴呆患者的行为学和海马神经元形态学等有较好的改善作用。大量文献提示当归相关制剂对心血管疾病患者血管内皮细胞、神经细胞等组织的Bax和Bcl-2表达有明显调节作用,提示当归有效成分对血管性痴呆具有潜在的治疗作用[10-13]。本研究结果表明当归多糖能显著提高体外培养PC12的T-SOD、LDH的生物活性,降低MDA含量,降低细胞凋亡率,这也表明当归多糖能有效提高PC12的抗凋亡能力,可能与其调节Bcl-2/Bax的表达有关。
[1] RICE JE,VANNUCCIRC,BRIERLEY JB.Theinfluence of immaturity on hypoxic-ischemic Brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[2] 刘医辉,杨世英,马伟林,等.当归药理作用的研究进展[J].中国当代医药,2014,21(22):192-196.
[3] 石瑞丽,胡金凤,孔令雷,等.瓜子金皂苷己对连二亚硫酸钠致氧糖剥夺/复供诱导PC12细胞凋亡的抑制作用[J].中国药理学通报,2013,29(3):333-336.
[4] 许蜀闽,王培勇,马红英.连二亚硫酸钠在建立培养细胞的无氧环境中的应用[J].第三军医大学学报,2005,27(4):359-360.
[5] LIPTON P.Ichemic cell death in brain neurons[J].Physiol Rev,1999(79):1431-1568.
[6] RAMIA,KGEL D.Apoptosis meets autophagy-like cell death in the ische-micpenumbra:two sides of the game coin[J].Autophagy,2008,4(4):422-426.
[7] 缪春明,张勇,王伟伟,等.自噬及凋亡相关蛋白在PC12细胞缺糖缺氧过程中的表达及其意义[J].中国老年学杂志,2010,30(1):78-80.
[8] 罗永竖,蔺心敬,李吕力,等.血管性痴呆模型大鼠海马神经元凋亡和病理改变的实验研究[J].中国老年学杂志,2008,28(18):1788-1789.
[9] ROSSE T,OLIVIER R,MONNEY L,et al.Bcl-2 prolongs cell survival after Bax-induced release of cytochrome[J].Nature,1998,391(6666):496-499.
[10] 杨静薇,田峻,邹凡,等.当归对大鼠局灶性缺血脑组织细胞凋亡的作用[J].武汉大学学报:医学版,2004,25(1):5-18.
[11] 章军建,黄建英,张晓琴.当归对大鼠脑缺血半暗带细胞凋亡的抑制作用[J].卒中与神经疾病,2001,8(1):8-10.
[12] 区炳雄,林海.当归多糖对染铅小鼠学习记忆及海马区Bcl-2基因表达的影响[J].辽宁中医杂志,2006,33(7):901-902.
[13] 林莉,刘希婧,荣霞,等.当归对缺氧缺血性脑损伤幼年大鼠神经元的保护作用[J].四川解剖学杂志,2010,18(4):13-15.
[14] 刘凯,张选奋,张瑾,等.当归水煎液对人脐静脉内皮细胞增殖、凋亡及胶原合成的影响[J].中国美容医学,2012,21(5):782-784.
[15] 雷燕,高倩,李悦山,等.黄芪、当归及其组方促血管内皮细胞增殖作用的研究[J].中国中西医结合杂志,2003,23(10):753-756.
(责任编辑:尹晨茹)
2015-03-09
邓健男(1987-),男,湖北省武汉市中医医院药师,研究方向为方剂学。
R285.5
A
1673-2197(2015)13-0007-03
10.11954/ytctyy.201513003
