法莫替丁注射液制备工艺研究
2015-04-26崔效廷吴荣翠李瑞明贾雪峰石井冈
崔效廷,吴荣翠,李瑞明,贾雪峰,石井冈
(辰欣药业股份有限公司,山东 济宁 272000)
法莫替丁注射液制备工艺研究
崔效廷,吴荣翠,李瑞明,贾雪峰,石井冈
(辰欣药业股份有限公司,山东 济宁 272000)
目的:优选法莫替丁注射液的制备工艺,以期提高其稳定性和安全性。方法:选取有关物质、pH为评价指标,对样品进行影响因素和稳定性实验,考察在不同浓度条件下不同种类缓冲盐溶液(pH=5.7)对法莫替丁注射液的影响。结果:加入0.05mol/L乙酸-乙酸钠缓冲液可有效提高法莫替丁注射液的稳定性。结论:该优选工艺简单有效,稳定性好,质量可控。
法莫替丁注射液;工艺制备;缓冲盐溶液
法莫替丁(Famotidine)为哌基噻唑类的第三代组胺H2受体拮抗剂[1],在20世纪70年代由日本山之内制药株式会社中央研究所最早发现并合成。该药物对H2受体亲和力高,能够降低胃酸对胃黏膜的刺激,促进溃疡愈合,增加胃黏膜的血流量以增强防御因子,对消化性溃疡具有较好的治疗效果[2-3]。临床上,法莫替丁主要用于治疗消化性溃疡所引起的上消化道出血和除肿瘤、食管或胃底静脉曲张所引起的胃及十二指肠糜烂出血等疾病[4-5]。由于法莫替丁结构的特殊性,导致其在水溶液中的稳定性较差。为提高法莫替丁注射液的稳定性,本文对其制备工艺进行优化,现具体报道如下。
1 仪器与试剂
1.1 仪器
日本岛津LC-20AT高效液相色谱仪(SPD-20A二极管阵列检测器、RID-10A泵),XS205Du型电子分析天平(梅特勒-托利多仪器上海有限公司)、HWS-12电热恒温水浴锅(上海精密科学仪器有限公司);320-S型酸度计(梅特勒-托利多仪器上海有限公司)。
1.2 试剂
法莫替丁原料(郑州瑞康制药有限公司),法莫替丁对照品(中国食品药品检定研究院提供,含量为99.9%);门冬氨酸(天津天氨药业有限公司),乙二胺四乙酸二钠(天津市科密欧化学试剂有限公司);乙腈、甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 处方工艺优化
法莫替丁注射液在长期存放过程中有关物质变化明显,主要原因为法莫替丁的水解和氧化作用,其中水解为主要因素,pH影响尤为关键。通过考察不同pH对其稳定性的影响,结果发现:pH约为5.7时注射液有关物质变化最小。因此,在pH=5.7时法莫替丁注射液比较稳定。根据上述结论,考察不同浓度缓冲盐溶液(pH=5.7)对法莫替丁注射液稳定性的影响。
2.1.1 不同浓度磷酸盐溶液(pH=5.7)的筛选 原处方组成为:法莫替丁1.0g、门冬氨酸0.4g、EDTA-2Na粉末0.03g,加水100mL。在原处方基础上设计不同浓度的缓冲溶液。见表1。
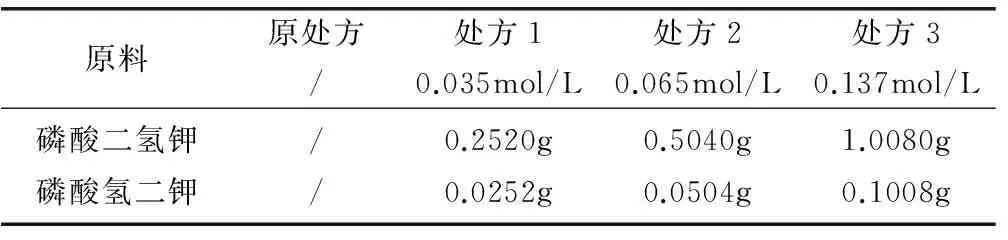
表1 不同浓度缓冲溶液配制
制备工艺过程:精密称取门冬氨酸0.4g和 EDTA-2Na粉末0.03g于250mL烧杯,加约90%的注射用水,加热至75~85℃,搅拌至全溶,待温度降到55~65℃时,加入1.0g法莫替丁,分次投入,边投边溶解,待温度降至25~35℃时,加1M的NaOH溶液调节pH至5.65,加入处方1中磷酸二氢钾和磷酸氢二钾,搅拌至完全溶解,加注射用水定容至100mL,用NaOH溶液微调pH至5.7,于100℃灭菌15min,得成品。依上述方法制备处方2、处方3样品。灭菌前后pH及有关物质变化情况见表2。
由表2结果可知,灭菌后处方1、处方2、处方3的pH变化较原处方小,且磷酸盐溶液浓度越大,其pH稳定性越高。处方3在10℃条件下放置12h后,有白色物质结块析出,法莫替丁含量没有明显减少,推测析出物质为辅料。灭菌后立即取各处方(除处方3)成品进行检测,检测结果作为0时数据;其他样品于恒温恒湿箱中放置(温度(40±2)℃,相对湿度(75%±5%)),分别于第5天、10天取样检测。检测结果见表3。
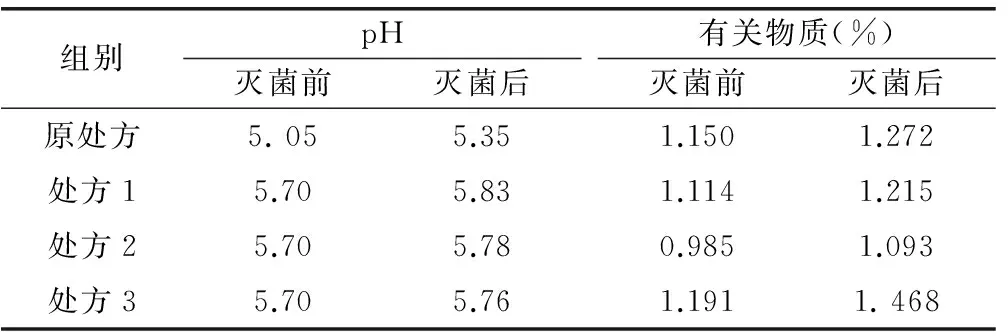
表2 灭菌前后pH及有关物质测定
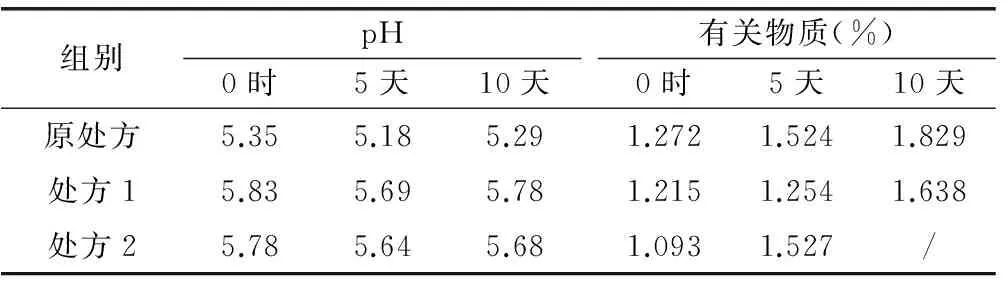
表3 各样品pH及有关物质检测结果
高温放置第5天时,处方2有少量白色物质结块析出,出现与处方3相似的结果,其色谱的主药峰峰面积没有减少,因此推测两个处方均是同一种辅料析出。经查阅文献发现,门冬氨酸在水中微溶(4.5 g/L),热水中溶解,而处方中门冬氨酸浓度为4g/L,接近饱和浓度[6]。因此,在含高浓度磷酸盐处方中,门冬氨酸的析出可能是由于磷酸盐浓度大,离子强度过大,导致门冬氨酸过饱和,从而析出。因此,本研究选用离子强度较小的缓冲盐稳定处方。
2.1.2 缓冲溶液(0.05mol/L,pH=5.7)的筛选 ①缓冲溶液(pH=5.7)的配置:乙酸-乙酸钠缓冲液(0.5mol/L):精密称取无水乙酸钠0.378g于10mL容量瓶,以注射用水溶解并定容至刻度,用冰乙酸调节pH至5.7;柠檬酸-氢氧化钠-盐酸缓冲液(0.5mol/L):精密称取柠檬酸1.05g、氢氧化钠0.685g于10mL容量瓶,加入浓盐酸0.37mL,以注射用水溶解并定容到刻度;柠檬酸-柠檬酸钠缓冲液(0.5mol/L):精密称取柠檬酸0.247g、柠檬酸钠0.987g于10mL容量瓶,以注射用水溶解并定容至刻度。②处方设计:在原处方基础上,根据“2.1.1”项处方3方法设计缓冲溶液。③工艺过程:称取门冬氨酸0.4g、 EDTA-2Na粉末0.03g于250mL烧杯,加入约90%的注射用水,加热至75~85℃,搅拌至全溶,待温度降到55~65℃时,加法莫替丁1.0g,分次投入,边投边溶解待温度降至25~35℃,加1M的NaOH溶液调节pH至5.65,将6mL缓冲液分别加入各处方溶液,搅拌完全,补充注射用水至100mL,用NaOH溶液微调pH至5.7,于100℃条件灭菌15min,得成品。灭菌前后各处方pH及有关物质检测结果见4。
由表4可见,灭菌后处方1、2、3的pH变化较原处方小;处方2中有关物质变化较明显。灭菌后立即取各处方成品进行检测,检测结果作为0时数据;其他样品于恒温恒湿箱中放置((40±2)℃,相对湿度(75%±5%)),分别于第5天、10天取样检测。结果显示:处方1的pH变化最小,有关物质变化也最小。因此,0.05mol/mL乙酸-乙酸钠缓冲液可有效控制处方有关物质的增长。检测结果见表5。
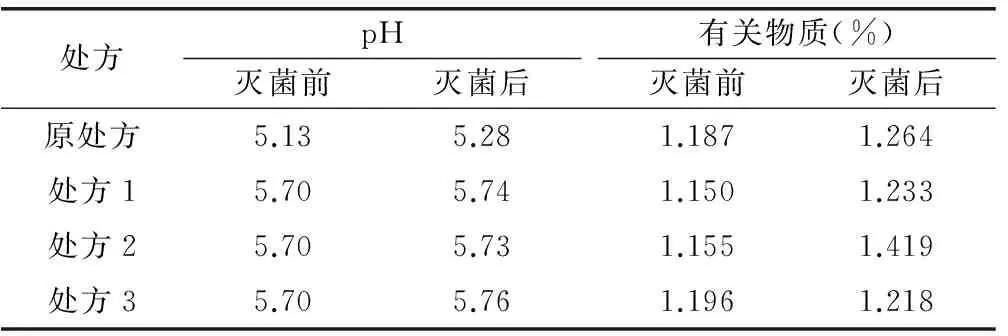
表4 灭菌前后各处方样品检测结果
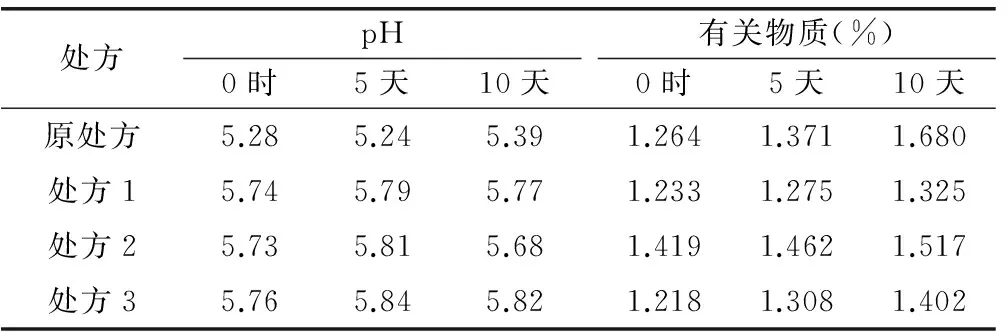
表5 各样品pH及有关物质检测结果
2.2 稳定性试验
选取原样品和处方1(0.05mol/L的乙酸-乙酸钠缓冲液)样品,分别于温度25℃、湿度60%和温度40℃、湿度75%条件下考察长期试验和加速试验样品稳定性。结果见表6、表7。
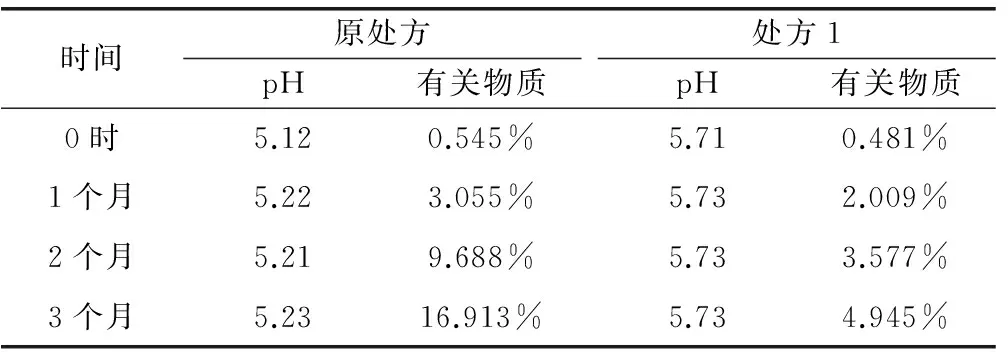
表6 加速试验结果
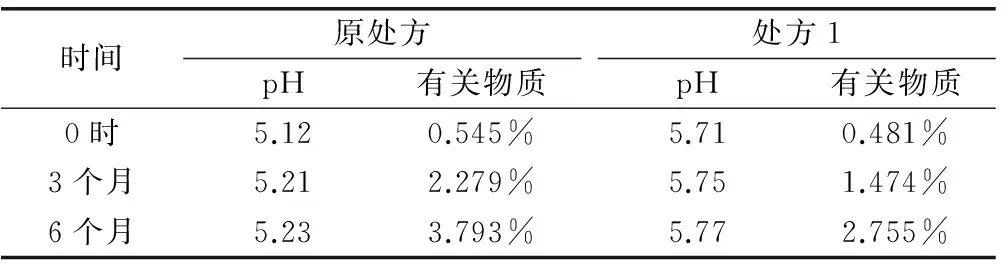
表7 长期试验结果
结果显示:样品采用密封长期包装,6个月内各项指标均符合标准,处方1稳定性较原处方更好,有关物质增加较小。
3 结论
综上所述,乙酸-乙酸钠缓冲液(0.05mol/L)可有效稳定溶液的pH,抑制法莫替丁磺酰基的水解反应,有效控制因水解产生的杂质,提高注射液的稳定性。该改进工艺简单有效,质量可控,适合于工业化生产。
[1] 陈新谦,金有豫,汤光.新编药物学[M].北京:人民卫生出版社,2007,464.
[2] 魏俊婷,迟丹怡,姚茂华,等.法莫替丁的用药调查与分析[J].药品评价,2004,1(3): 199-203.
[3] 魏秀凤,徐晶.法莫替丁治疗消化性溃疡52例临床观察[J].临床和实验医学杂志,2008,7(6): 135-136.
[4] 邓巧君,李建和,曹俊华.法莫替丁注射液的研制[J].中国当代医药,2010,17(18): 5-8.
[5] 王宏,王超.法莫替丁的临床应用[J].中国医药指南,2012,10(10): 78-79.
[6] 罗宏,吴军,邹意琼.法莫替丁注射液的制备工艺[J].中国药师,2013,16(8): 1144- 1147.
(责任编辑:李岚春)
Study on Preparation Process of Famotidine Injection
Cui Xiaoting,Wu Rongcui,Li Ruiming,Jia Xuefeng,Shi Jinggang
(Chen Xin Pharmaceutical Co.,Ltd.,Jining 272000,China)
Objective:To optimize the preparation process of famotidine injection to improve its stability and safety.Methods:Related substances and pH value as evaluation index,the injections were inspected by influencing factors and stability experiments .To evaluate the influences of buffered saline solutions on the stability of the injection(pH=5.7) different types and concentrations of solutions were prepared.Results:Adding 0.05mol/L acetic acid-sodium acetate buffer solution the stability of famotidine injection was effectively improved.Conclusion:The improved process is good in stability,controllable in quality,simple and effective.
Famotidine Injection; Screened Process; Stability; Buffer Solution
2015-03-03
崔效廷(1976-),男,硕士,山东省辰欣药业股份有限公司质量管理部部长,研究方向为药物开发与质量控制。E-mail:cxting126@sina.com;吴荣翠(1986—),女,硕士,山东省辰欣药业股份有限公司研究员,研究方向药剂学。E-mail:wurongcui@sina.com
R944
A
1673-2197(2015)16-0036-03
10.11954/ytctyy.201516016
