附子干姜与辛伐他汀及其联用治疗马兜铃酸肾病研究
2015-04-26陈燕乔张雅倩王友群
陈燕乔,张雅倩,王友群
(中国药科大学 药理研究室,江苏 南京 210009)
附子干姜与辛伐他汀及其联用治疗马兜铃酸肾病研究
陈燕乔,张雅倩,王友群*
(中国药科大学 药理研究室,江苏 南京 210009)
目的:观察附子干姜、辛伐他汀及联用对关木通所致马兜铃酸肾病模型的影响。方法:将雄性ICR小鼠随机分为5组:正常组(C)、模型组(M)、附子干姜组(FG)、辛伐他汀组(X)、附子干姜+辛伐他汀组(FGX);模型组及各治疗组小鼠灌胃给予关木通水煎剂(7g/kg·d),正常组小鼠灌胃给予等量水,给药4天后停药3天,持续4周;各治疗组自第3周起分别给予附子干姜(5g/kg·d)、辛伐他汀(10mg/kg·d)、附子干姜(5g/kg·d)+辛伐他汀(10mg/kg·d)。4周后取小鼠血清测定肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平,取肾组织测定丙二醛(MDA)、谷胱甘肽(GSH)和γ-谷氨酰转移酶(γ-GT)浓度,并记录左肾、左睾丸系数。结果:与模型组比较,各治疗组均可降低血清肌酐、尿素氮、尿酸、谷丙转氨酶、谷草转氨酶水平,且两者合用可增加附子干姜对肌酐、尿酸的排泄;与模型组比较,各给药组均能升高肾组织中γ-GT含量,且FG组与FGX能升高肾组织MDA水平,降低GSH水平。结论:附子干姜与辛伐他汀对马兜铃酸肾病均有保护作用,且两者联用可相互补充,提高治疗马兜铃酸肾病的效应。
马兜铃酸肾病;肾脏纤维化;附子干姜;辛伐他汀
马兜铃酸(Aristolochic acids,AAs)为马兜铃科植物的主要次生代谢物,对机体可产生较强的肾毒性、致癌性和致突变作用,其中马兜铃酸Ⅰ(AAⅠ)和马兜铃酸Ⅱ(AAⅡ)为其主要毒性有效成分[1]。慢性马兜铃酸肾病多由长期持续或间断性小剂量服用含马兜铃酸中草药所导致的肾间质纤维化疾病。研究发现,马兜铃酸可通过多种病理机制诱导肾近曲小管上皮细胞凋亡[2],但目前仍缺乏有效的治疗方法,因此利用动物模型进行相关研究是有必要的。
关木通性味苦寒,在机体内阻碍气化,造成阳虚阴盛,形成以寡细胞性肾间质纤维化为主要的病理特征[3],与慢性马兜铃酸肾病患者的临床表现相似。附子具有回阳救逆、温阳利水、散寒止痛的功效,现代药理学研究证实附子有改善微循环、抗寒冷和兴奋垂体—肾上腺皮质激素等作用[4],常与干姜配伍使用,可达增效减毒的作用。辛伐他汀为常见降血脂药物,研究发现,他汀类药物除降脂的肾脏保护作用外,还有非依赖降脂的肾脏保护作用,其作用机制包括抑制药物在近端肾小管细胞的聚集、产生抗脂质过氧化、减少蛋白尿,下调血管紧张素受体、改善血管内皮细胞功能,从而延缓肾脏损害[5]。本研究目的为探讨附子干姜、辛伐他汀及联合应用对慢性马兜铃酸肾病模型小鼠的治疗作用及机理。
1 材料
1.1 药品与试剂
关木通饮片购自南京市百信药房,黑附子购自于南京市益丰大药房;干姜购自于南京市先声药店,所用中药材均经专家鉴定确认;辛伐他汀(批号:140327,海南海灵化学制药有限公司)购自南京先声大药房。肌酐、尿素氮、尿酸、谷草转氨酶、谷丙转氨酶、丙二醛、γ-谷氨酰转移酶和谷胱甘肽等试剂盒购于南京建成生物工程研究所。
1.2 动物与仪器
雄性清洁级小鼠90只,体重为(25±2)g,购自南京青龙山动物繁殖厂,动物合格证号:SCXK(苏)2007-0001。实验期间给予标准饲料,自由摄食饮水,室内温度控制为20~25℃。
721分光光度计(上海第三分析仪器厂);0412-1型低速离心机(上海医疗器械有限手术器械厂);BS-110-S型电子天平(北京赛多利斯公司)。
2 方法
2.1 中药水煎剂制备
称取适量关木通,加入8倍体积自来水,浸泡1h,武火煮沸后微沸1h,4层纱布过滤,收集滤液;残渣加入6倍体积的自来水,微沸30min,亦过滤;合并两次滤液,文火浓缩,得相当于0.7g/mL关木通的水煎液。同法制备附子干姜水煎剂0.5g/mL。
2.2 实验方法
经环境适应性饲养1周后,将雄性ICR小鼠随机分为5组:正常对照组(C组)、关木通模型组(M组)、附子干姜组(FG组)、辛伐他汀组(X组)、附子干姜+辛伐他汀组(FGX组)。C组给予灌胃等体积饮用水,其他4组灌胃给予7g/kg·d的关木通水煎剂,给药4天后停药3天,持续4周;从第3周起,各给药组在给予造模药基础上再分别灌胃给予相应的治疗药物,即FG(5g/kg·d)、X(10mg/kg·d)、FG(5g/kg·d)+X(10mg/kg·d)。
2.3 指标测定
各组小鼠给药4周后,摘除眼球取血并处死解剖,血样旋转离心(1 500r·min-1,10 min)后取上层血清于-20℃下保存,用于测定血清SCr、BUN、ALT、AST、UA等指标。取左侧肝脏和肾脏的部分组织按1∶9质量体积比加入生理盐水,在冰浴条件下制成10%的组织匀浆,以2 000rpm的转速,离心10min后取上清液于-20℃保存备测。SCr、BUN、ALT、AST、γ-GT、蛋白、MDA、GSH等指标测定的具体操作按试剂盒说明书进行。
2.4 统计学分析
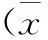
3 结果
3.1 各组小鼠左肾系数、左睾丸系数变化
与正常组比较,模型组小鼠左肾系数显著升高(P<0.01),左睾丸系数显著降低(P<0.01)。与模型组比较,各治疗组左肾系数均有显著性降低(P<0.01),左睾丸系数显著升高(P<0.01),且在降低肾系数方面附子干姜组效应最为显著。见表1。
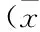
表1 各组小鼠左肾系数、左睾系数测定结果 ±s,n=8)
注:与C组比较,*P<0.05,**P<0.01;与M组比较,#P<0.05,##P<0.01。
3.2 各组小鼠血清生化指标变化
与正常对照组比较,模型组小鼠肌酐、尿素氮、尿酸和谷草、谷丙的含量均显著升高(P<0.01);与模型组相比较,FG组、X组、FGX组生化指标的含量均显著降低(P<0.01),且辛伐他汀组血清肌酐、尿酸浓度与正常组比较无明显差异。见表2。
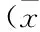
表2 各组小鼠血清生化指标测定结果比较 ±s,n=8)
注:与C组比较,*P<0.05,**P<0.01;与M组比较,#P<0.05,##P<0.01。
3.3 各组小鼠肾脏生化指标变化
与正常组比较,模型组小鼠肾脏组织中MDA、γ-GT、GSH均显著性升高(P<0.01);附子干姜组和附子干姜+辛伐他汀组均能显著性升高肾脏MDA、γ-GT的含量(P<0.01),降低GSH含量(P<0.05);辛伐他汀组小鼠肾脏组织中γ-GT的含量有显著升高(P<0.01),对MDA、GSH含量的影响与模型组无较大差别。见表3。
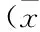
表3 各组小鼠肾脏生化指标测定结果比较 ±s,n=8)
注:与C组比较,*P<0.05,**P<0.01;与M组比较,#P<0.05,##P<0.01。
4 讨论
中医学认为,药物性肾损害为药毒侵袭脏腑,耗伤气血,或伤及脏腑后失治、误治,导致久病脏腑亏损、气血阴阳虚衰、肾精亏虚,可归于中医学虚劳范畴[6]。肾气亏虚、气化不足,升清泌浊功能障碍,不能及时转输、运化水液及毒素,从而形成湿浊、湿热、尿毒、瘀血等症状[7]。马兜铃酸类药物关木通引起的肾纤维化疾病特点为起病隐匿、进展较快。目前公认的治疗原则主要为延缓肾病进展。附子干姜辨证治疗肾阴肾阳亏,辛伐他汀对症治疗、抗炎,促进毒性药物及其代谢产物的排泄,两者合用,以期达到标本兼治的目的。
本实验结果显示,与正常对照组比较,模型组小鼠的肾脏系数显著性增加(P<0.01),睾丸系数显著性降低(P<0.01),观察发现模型组小鼠的肾脏发白肿大,睾丸萎缩,显示关木通已造成肾脏损伤,且对生殖系统造成一定损害。在肾功能不全时,肌酐、尿素氮、尿酸在体内蓄积成为对机体有害的毒素,为检查肾功能的主要指标,本实验发现模型组小鼠肌酐、尿素氮及尿酸均显著增加(P<0.01)。转氨酶为反映肝脏功能的指标,主要存在于肝细胞内,当肝细胞发生炎症、坏死、中毒等造成肝细胞受损时,转氨酶便会释放到血液里,使血清转氨酶升高。模型组结果发现,ALT、AST均显著性增加(P<0.01),研究指出AAⅠ在体内分布具有器官特异性,虽大部分在肾脏组织分布且清除缓慢,但部分在肝脏代谢可能造成一定程度的肝组织损伤[8]。γ-谷氨酰转移酶(γ-GT)主要存在于血清及除肌肉外的所有组织中,其中以肾近曲小管刷状边缘含量最高,且血清γ-GT的含量与慢性肾病进展有关[9]。本实验结果显示:模型组γ-GT显著性降低(P<0.01),推测原因可能为肾间质纤维化时肾小管上皮细胞可见刷状边缘脱落,上皮细胞浊肿,颗粒变性及坏死脱落,严重者有肾小管基膜裸露[10],从而导致γ-GT含量降低。MDA、GSH则反映肾脏损伤状态的小鼠肾脏细胞氧化还原状态。通常肾组织氧自由基的产生与清除处于相对平衡状态,但慢性肾损伤时,机体的氧化与抗氧化系统发生改变。实验中模型组显著性降低肾脏MDA(P<0.01),GSH升高(P<0.01),说明模型组小鼠肾脏中氧化还原相关酶处于低活性状态,推测可能与马兜铃酸肾病引起的肾阳虚证候有关,且γ-GT为参与谷胱甘肽及其衍生物代谢的关键酶[11],其含量降低会导致GSH的蓄积。
与模型组相比较,在肾系数与睾丸系数方面,附子干姜组、辛伐他汀组及合用组均能显著性降低肾系数(P<0.01),升高睾丸系数(P<0.01),且附子干姜肾脏保护作用最强,两者合用较辛伐他汀组有较好的降低肾系数作用。推测原因可能为附子干姜配伍使用充分发挥其温阳通脉作用;他汀类则主要通过抑制药物的聚集,产生抗炎等效应[12],合用可增强辛伐他汀肾脏保护效应。在肌酐、尿素氮与尿酸方面,治疗组能显著降低血清中的浓度(P<0.01),且辛伐他汀组促进肌酐、尿酸排泄能力最强,附子干姜降低尿素氮能力最强,两者合用可提高附子干姜对肌酐与尿酸的排泄。研究发现,他汀类药物能作用于肾近端小管细胞的SLCO4C1转运体,促进代谢产物和毒素的排泄[13]。附子干姜可发挥其通经活络、上通下达、行走于表里的作用。在谷草转氨酶与谷丙转氨酶方面,治疗组均有显著的保护作用(P<0.01)。在MDA、GSH与γ-GT含量方面,附子干姜组能显著性升高MDA与γ-GT含量(P<0.01),降低GSH含量(P<0.05);而辛伐他汀组对MDA、GSH作用不明显,能显著性升高γ-GT含量(P<0.01);两则合用可改善附子干姜对γ-GT的作用,而对MDA、GSH的作用略有降低,无显著性差异。
在慢性肾病治疗中,常选用类固醇类激素和血管紧张素转化酶进行治疗,但通常会产生较多的不良反应且疗效并不显著,因此研发新型药物已成为治疗慢性肾脏纤维化疾病的主要方向。本实验选用炮制附子干姜治疗关木通所致的马兜铃酸肾病,发挥其温脾、肾之阳、助气化而行水湿的功效,两药配伍,相须并用。现代药理学研究发现,附子干姜能发挥抗炎、降低蛋白尿及恢复肾功能的作用[14],辛伐他汀可通过影响基质金属蛋白酶家族及抑制转化生长因子β表达等作用,延缓肾脏纤维化。本实验还研究两者合用对肾病的影响,结果发现:两者合用能提高附子干姜对毒素的排泄,升高肾脏组织γ-GT的含量,提示附子干姜与辛伐他汀合用在延缓肾纤维化疾病方面可发挥各自的优势,起到协同作用,可控制肾脏纤维化发展,但其具体作用机制还需进一步探讨。
[1] BAKHIYA N.Molecular evidence for an involvement of organic anion transporters (OATs) in aristolochic acid nephropathy[J]. Toxicology,2009,264(1-2): 74-9.
[2] 宋海波.马兜铃酸毒性研究进展及风险因素分析[J].中国中药杂志,2014(12): 2246-2250.
[3] 高艳丽.关木通致大鼠慢性马兜铃酸肾病模型的建立及发病机理的研究[D].北京:中国协和医科大学,2003.
[4] 杨金风.附子对微小病变肾病大鼠的影响[J]. 辽宁中医杂志,2010(S1): 245-247.
[5] DASHTI-KHAVIDAKI S.Statins against drug-induced nephrotoxicity[J].J Pharm Pharm Sci,2013,16(4):588-608.
[6] 袁平霞,段光堂,贾志杰.辨证治疗为主治疗药物性肾损害致慢性肾衰竭32例疗效观察[J].河北中医,2011(12): 1798-1799.
[7] 米杰.慢性马兜铃酸肾病的中西医结合治疗[J].山东中医药大学学报,2005(4): 281-282.
[8] 周娜,李晓玫.马兜铃酸肾病研究的新进展[J].药物不良反应杂志,2007(1): 1-6.
[9] RYU S.Gamma-Glutamyl transferase as a predictor of chronic kidney disease in nonhypertensive and nondiabetic Korean men[J]. Clin Chem,2007,53(1):71-77.
[10] 尹广,刘正钊.马兜铃酸肾病发病机制与诊断的某些进展[J].中国中西医结合肾病杂志,2009(3): 268-271.
[11] 焦连亭,蔡钢强.高血清γ-谷氨酰转移酶对疾病的预示作用[J].国际检验医学杂志,2009,30(1):46-48.
[12] DASHTI-KHAVIDAKI S.Statins against drug-induced nephrotoxicity[J].J Pharm Pharm Sci,2013,16(4):588-608.
[13] TOYOHARA T.SLCO4C1 transporter eliminates uremic toxins and attenuates hypertension and renal inflammation[J]. J Am Soc Nephrol,2009,20(12):46-55.
[14] 马菲.附子复方治疗类风湿关节炎寒湿阻络证的有效性和安全性的临床研究[D].北京:北京中医药大学,2013.
(责任编辑:李岚春)
Effective Treatment of Aconite and Dried Ginger,Simvastatin and Combination on Renal Interstitial Fibrosis Induced by Aristolochic Acid
Chen Yaoqiao,Zhang Yaqian,Wang Youqun*
(Department of Pharmacology,China Pharmaceutical University,Nanjing 210009,China)
Objective:To explore the influence of aconite and dried ginger,simvastatin and their combination on renal interstitial fibrosis induced by aristolochic acid. Methods:Male ICR mice were randomly divided into 5 groups including control(C) group,model(M) group,aconite and dried ginger(FG)group,simvastatin(X)group,aconite and dried ginger+ simvastatin(FGX)group. The mice in control group,in model group and in three treatment group were given distilled water or Caulis Aristolochiae Manshuriensis (7g/kg·d,the first four days every week and for a period of 4 weeks),and the treatment groups were given different drugs (FG(5g/kg·d),X(10mg/kg·d),FG(5g/kg·d)+X(10mg/kg·d)since the third week by intragastric administration. At the end of the experiment,in blood serum the levels of creatine(SCr),urea nitrogen(BUN),uric acid(UA),alanine transaminase(ALT) and aspartate aminotransferase(AST) were measured; in kidney tissue the contents of malondialdehyde(MDA),glutathione(GSH),γ-Glutamyltransferase(γ-GT) were detected.Results:(1) Compared with M group,the treatment groups significantly reduced the levels of Cr,BUN,UA,ALT and AST,and when combined with simvastatin,aconite and dried ginger promoted the excretion of creatine and uric acid.(2) Compared with M group,the treatment groups improved the contents ofγ-GT,aconite and dried ginger,the combination group both increased the contents of MDA and lowered the contents of GSH. Conclusion:Aconite and dried ginger,simvastatin both exert the protection of aristolochic acid nephropathy,and when combined together,they can complement ?each other to against the renal interstitial fibrosis.
Aristolochic Acid Nephropathy;Renal Interstitial Fibrosis;Aconite and Dried Ginger; Simvastatin
2014-11-04
陈燕乔(1988-),女,中国药科大学药理研究室硕士研究生,研究方向为心血管药理。E-mail: chenyanqiao10@163.com
王友群(1956-),男,中国药科大学副教授,研究方向为心血管药理学。E-mail: wyqfbox@163.com
R277.51
A
1673-2197(2015)06-0018-03
10.11954/ytctyy.201506008
